2020年3月FDA共批准了5款新药,包括4款新分子实体药物,1款细胞疗法。
1. Azstarys(serdexmethylphenidate+速释右哌甲酯复方制剂)
Azstarys由KemPharm公司开发,每日1次,用于治疗6岁及以上患者的注意力缺陷多动障碍(ADHD)。Corium公司将负责Azstarys在美国的商业化。
Azstarys通过KemPharm专有的LAT(配体激活疗法)技术平台开发,是右哌甲酯(d-MPH)前药serdexmethylphenidate (SDX)和速释d-MPH组成的一种复方胶囊剂型。Azstarys中含有30%立即释放d-MPH和70%延迟释放的新型SDX。经胃肠道吸收后,SDX转化为d-MPH,并在一天内逐渐释放d-MPH。与市场上现有药物相比Azstarys具有立即起效和减少患者药物依赖的优点。
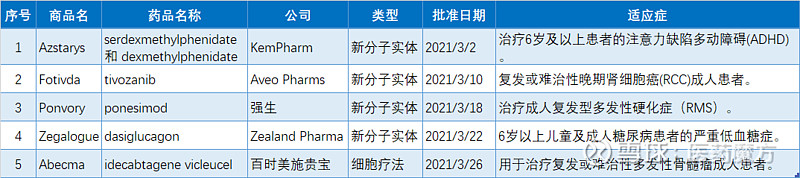
serdexmethylphenidate结构式
2. Fotivda(tivozanib)
Fotivda是一款口服VEGF受体酪氨酸激酶抑制剂(TKI),于3月10日获FDA批准上市,用于此前接受过2种及以上全身性治疗的复发/难治性晚期肾细胞癌(RCC)成年患者。
Fotivda最初由日本协和发酵麒麟发现,并于2017年8月首次在欧盟获批用于治疗晚期肾细胞癌(RCC)。Fotivda能够选择性强力抑制所有三种VEGF受体,能够在有效阻断VEGF信号通路的同时,将脱靶副作用降至最低。AVEO公司拥有在北美地区开发Fotivda用于治疗肾细胞癌(RCC)、肝细胞癌(HCC)和其他癌症权利。
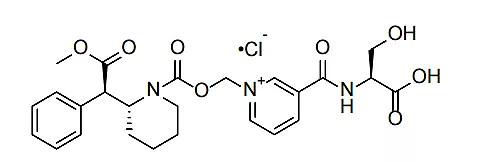
tivozanib结构式
一项代号为TIVO-3的III期临床研究评估了Fotivda vs. 索拉非尼治疗此前接受过2次或以上全身治疗后复发或难治性晚期RCC患者疗效。研究结果显示,Fotivda和索拉非尼组患者中位无进展生存期(PFS)分别为5.6个月和3.9个月,客观缓解率(OSS)分别为18%和8%。
3. Ponvory(ponesimod)
3月18日,FDA批准强生口服、每日1次,选择性鞘氨醇-1-磷酸受体1(S1P1)调节剂ponesimod上市,用于治疗复发型多发性硬化症(MS)成人患者,包括临床孤立综合征(CIS)、复发-缓解型多发性硬化症(RRMS)、活动性继发进展型多发性硬化症(SPMS)。

Ponvory获得FDA批准上市是基于一项为期2年的头对头III期临床研究结果,与特立氟胺(Aubagio)相比,Ponvory将复发型MS患者的年复发率降低了30.5%,达到优效性标准。
4. Zegalogue(dasiglucagon)
3月22日,FDA批准Zealand Pharma可溶性胰高血糖素类似物Zegalogue上市,用于治疗6岁以上儿童和成人糖尿病患者的严重低血糖症。
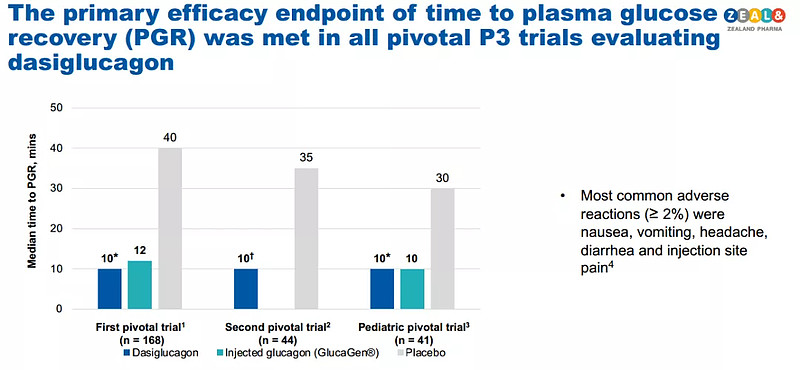
在三项关键性III期临床试验中,Zegalogue组患者血糖恢复中位时间为10min,而安慰剂组则需要30-40min。并且,在成人患者中开展的一项试验中,有99%患者血糖水平在注射后15分钟内得以恢复。
Zegalogue具有独特的稳定性,可以在水溶液的状态下稳定存在。Zealand公司同时开发了名为HypoPal的自动注射器,糖尿病患者可自己操作,快速治疗严重低血糖。
5. Abecma(idecabtagene vicleucel)
3月26日,百时美施贵宝和bluebird 联合宣布,FDA已批准Abecma(idecabtagene vicleucel; ide-cel) 上市,用于治疗复发或难治性多发性骨髓瘤成人患者,这些患者既往接受过包括免疫调节剂、蛋白酶体抑制剂和抗CD38单克隆抗体在内的四线及以上治疗。

Abecma是首个靶向B细胞成熟抗原(BCMA)的定向嵌合抗原受体(CAR) T细胞免疫疗法,同时也是BMS今年获批的第2款CAR-T疗法。
全球已获批上市的CAR-T疗法
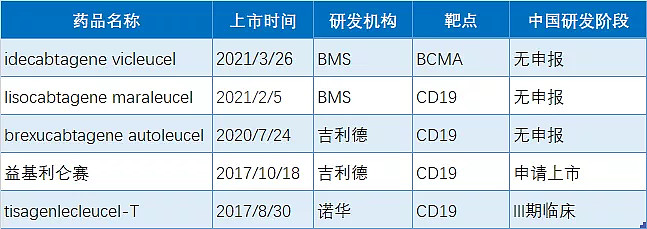
截止目前,全球已有5款CAR-T产品获批上市,包括吉利德2款,BMS 2款,诺华1款。