年底忙于俗务,连看点颇多的ESMO都来不及认真跟进,只看了一些摘要总结就有印象Amgen和BI陆续发了DLL3双抗不错的数据。渠料热点根本不给人喘息的机会,这还不到一个月,DLL3靶点的大交易就上门了,$传奇生物(LEGN)$ 向$诺华制药(NVS)$ 授权其DLL3 CAR-T产品LB2102,获得1亿美元首付款以及高达10.1亿美元的里程碑付款。

LB2102从去年底获得FDA临床许可后,正在进行针对小细胞肺癌和大细胞神经内分泌瘤的一期临床,SCLC作为发病率较高却缺乏有效治疗手段的瘤种一直是肿瘤药企的必争之地,那我们就不妨来看看DLL3靶点在SCLC治疗上的进展。
1. SCLC现有治疗情况
肺癌是世界范围内发病率和死亡率最高的疾病之一,其中SCLC占比13-17%,与NSCLC不同它起源于神经内分泌细胞,导致其成为预后和存活率最差的类型,5年存活率从原发性的27%到转移性的3%不等。
SCLC往往诊断较晚,错过最佳治疗机会,多数患者都有快速进展和转移灶,且伴随着耐药和复发,因而现有治疗方案对多数患者而言都难以长期控制肿瘤进展。现有的SOC如下:
1)一线治疗是以铂类为基础的化疗(Cisplatin/Carboplatin+Etoposide,CE方案),对局限期患者(LS-SCLC)进行同步放疗,随后对CR患者进行预防性颅内放疗,对广泛期患者(ES-SCLC)使用PD-L1单抗联用CE;
2)二线治疗在2020年Lurbinectedin获得加速批准之前,二十多年来唯一获批的只有Topotecan;
3)二线以后耐药或复发的患者则完全没有获批的治疗方案。

虽然免疫检查点抑制剂对NSCLC等实体瘤都临床获益显著,但在SCLC的一线化疗中加入PD-(L)1单抗仅在小部分患者中体现出获益,K药和O药等也相继向FDA撤回了SCLC适应症、T药和I药等在三期临床的OS提升也都只有2-3个月,在这样一个不算很小的瘤种留下了较大的空白。
2. 治疗SCLC的靶向DLL3药物
Notch信号通路是一种高度保守的细胞间通路,参与和调节肿瘤细胞的有丝分裂、增殖和分化等多种发育过程,包括肺神经内分泌细胞的发育。首先,细胞中的Notch受体结合到表面的不同的DSL配体;然后,按照不同的配体结构,Notch信号的活性物质分别在S1/S2/S3期产生,并生产Notch胞内结构域(NICD);最后,NICD进入细胞核,并结合到CBF-1/Suppressor of hairless/Lag1(CSL)形成能够调节靶基因转录的复合物。
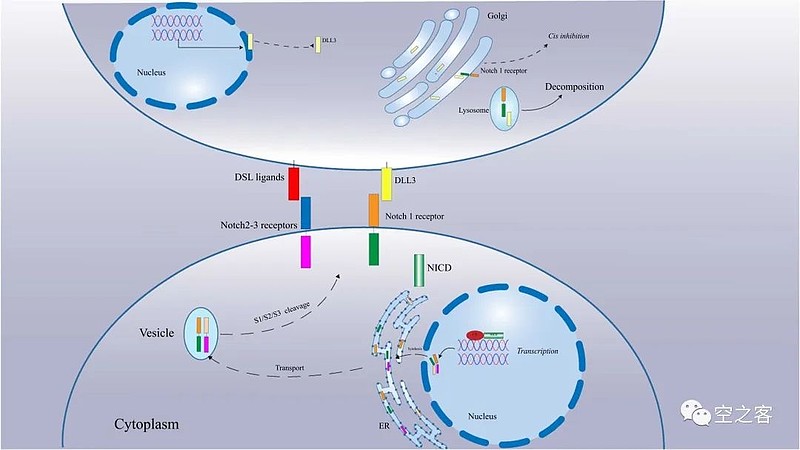
Delta样配体3(Delta-like Ligand 3,DLL3)是一种抑制性Notch通路的配体,是该信号通路的重要成员,但其在通路中的作用仍有争议![]() 。DLL3肺癌(尤其是SCLC)细胞表面广泛表达,促进SCLC等细胞的生长、并增强迁移和浸润,而在正常组织中低表达或不表达。虽然有研究表明DLL3与SCLC之间存在相关性,但其致病机制尚不清楚,DLL3阳性率与年龄、性别、TNM分期无关,其过表达也不能预测SCLC患者的预后生存。
。DLL3肺癌(尤其是SCLC)细胞表面广泛表达,促进SCLC等细胞的生长、并增强迁移和浸润,而在正常组织中低表达或不表达。虽然有研究表明DLL3与SCLC之间存在相关性,但其致病机制尚不清楚,DLL3阳性率与年龄、性别、TNM分期无关,其过表达也不能预测SCLC患者的预后生存。
虽然如此,毕竟SCLC细胞上的DLL3过表达仍然被视为治疗该疾病的重要机理基础,特别是考虑到较好的选择性,降低了仿制药的可能性,提高DLL3药物的靶向性。目前正在开发的DLL3药物主要包括ADC、双抗和CAR-T细胞治疗。
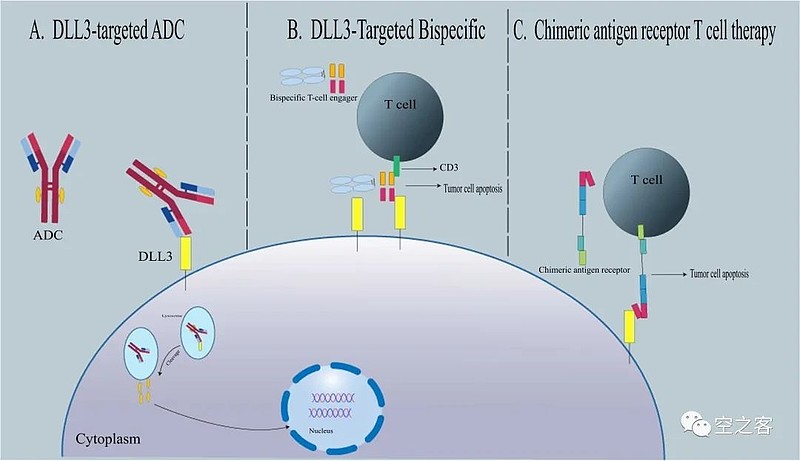
3. 靶向DLL3的ADC
最经典的DLL3 ADC药物是Abbvie买来的Rova-T,采用可裂解linker+PBD作为payload,DAR=4。
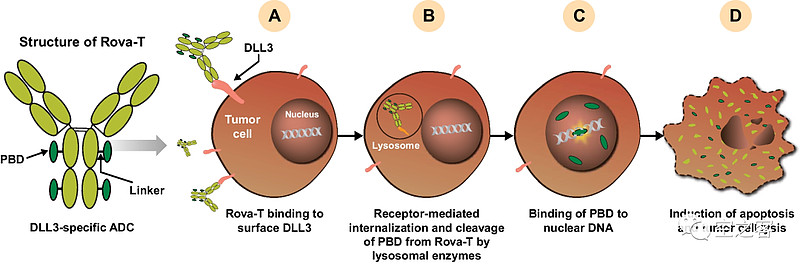
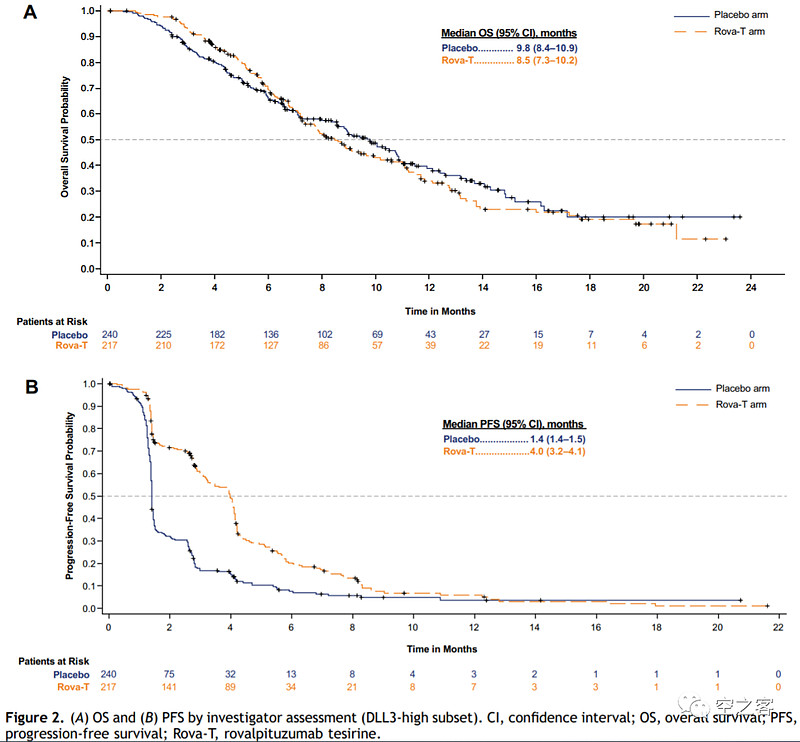
然而2021年先后公布的两个治疗SCLC的三期临床都失败了:在MERU试验中,作为一线铂类化疗后的维持疗法,Rova-T与安慰剂组对照,ORR对比为9% vs 4%,mOS对比为8.5 vs 9.8个月,mPFS对比为4.0 vs 1.4个月,最重要的有效性终点未达到显著性;在TAHOE试验中,作为针对DLL3高表达患者的二线治疗,Rova-T与Topotecan对照,ORR对比为15% vs 21%,mOS对比为6.3 vs 8.6个月,mPFS对比为3.0 vs 4.3个月,几乎被全面碾压。
网页链接(21)02067-0
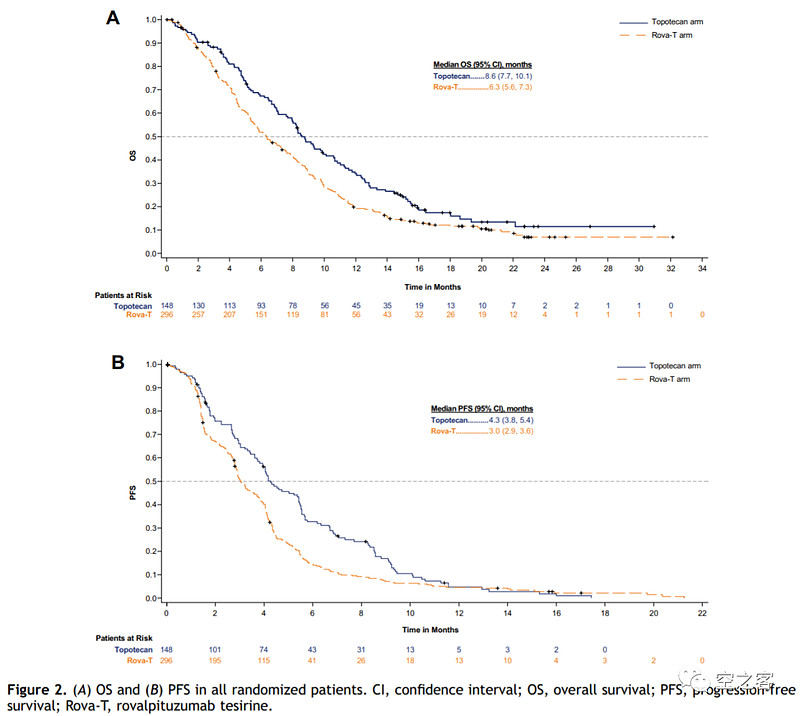
网页链接(21)01709-3/
4. 靶向DLL3的双抗
目前主流的双/多抗策略是靶向DLL3和CD3,利用不依赖MHC-I呈递的T细胞激活来杀伤肿瘤,典型结构包括:1)两段ScFv加Fc端,如Amgen的Tarlatamab;2)经典IgG骨架,如BI的BI-764532;3)三特异性融合蛋白,除了DLL3和CD3外还加上靶向血清白蛋白的一段用于延长半衰期,如Harpoon的HPN-823;4)靶向DLL3的Fab+靶向CD3的ScFv+修饰的Fc端(好生花哨),用二硫键相连,如齐鲁的QLS-31904.
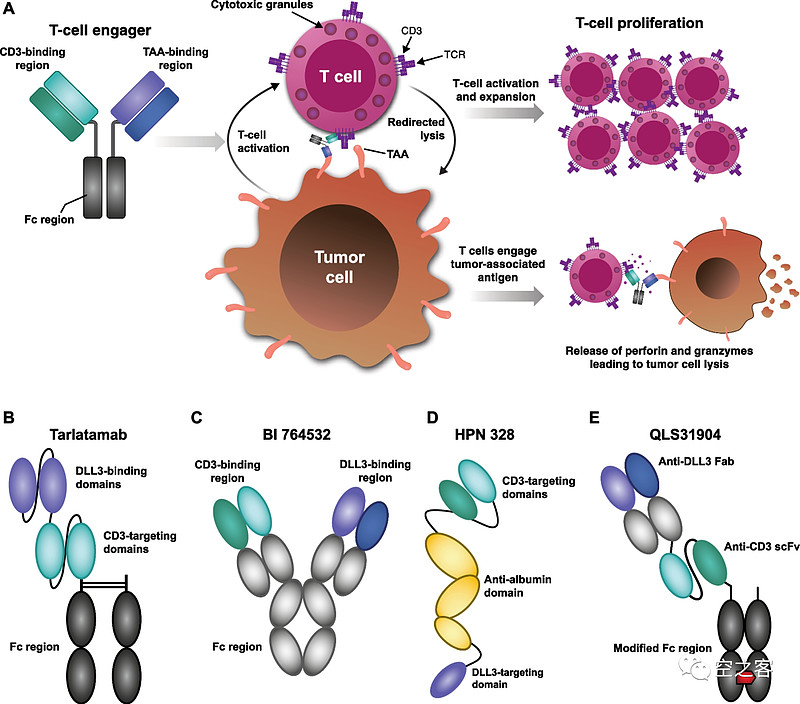
这其中进度最快也最具代表性的就是Amgen的Tarlatamab,正是它在今年ESMO公布的数据颇具看点。
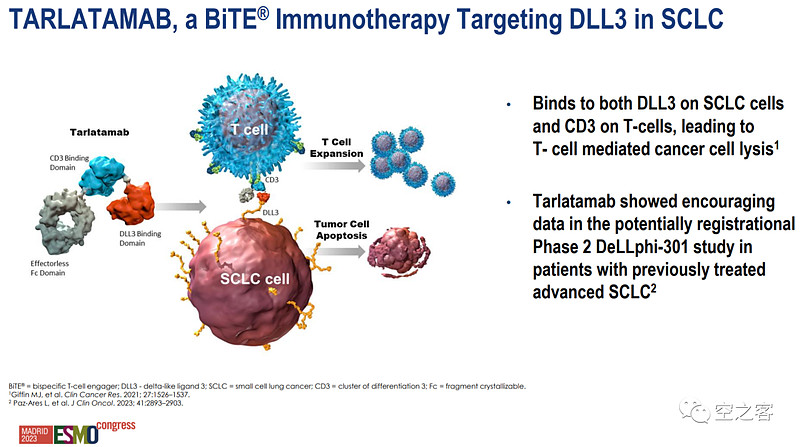
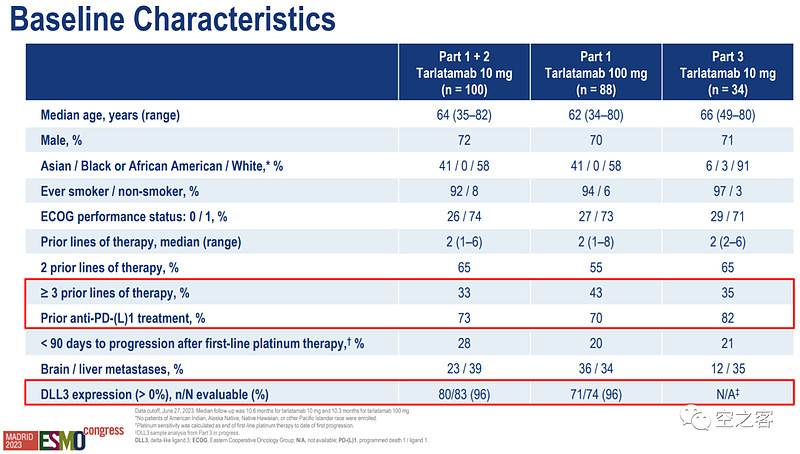
在代号为DeLLphi-301的开放标签二期临床中(NCT05060016),分为10mg和100mg两个剂量组,分别在第1天给药1mg、接着在第8天和第15天以及此后每两周一次给药10/100mg。
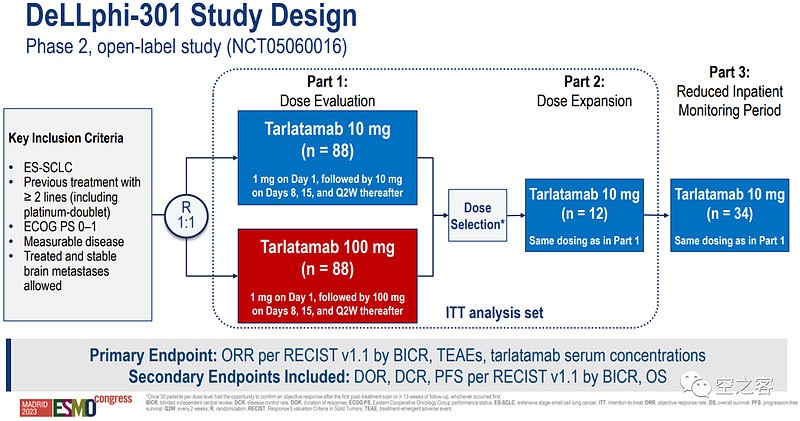
患者平均接受过2线治疗、其中接受过3线以上的超过1/3、接受过PD-(L)1的有70%以上,即相当大部分都是末线患者,绝大部分都有DLL3表达。
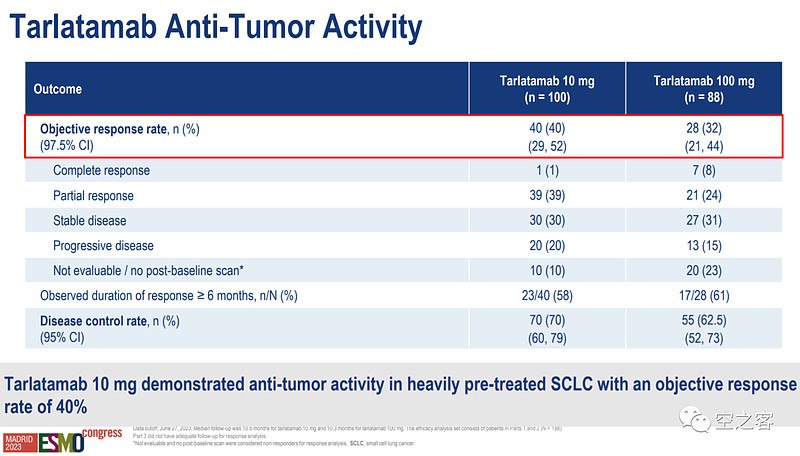
在主要临床终点ORR方面,10mg和100mg组分别为40%和32%,远远超过末线化疗15%左右的水平(甚至也高于一期临床的23%),且59%的响应患者DOR超过6个月;不过量效关系还是略有些奇葩,高剂量组虽然CR非常多,但总的ORR却偏低,因而最终三期临床也选择了低剂量组10mg。
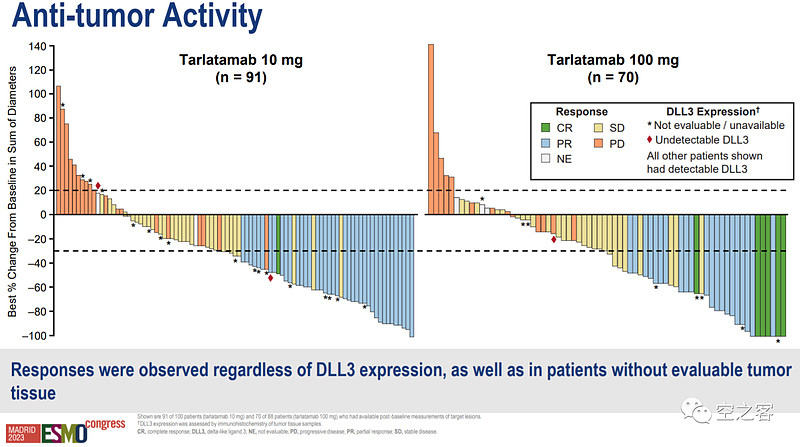
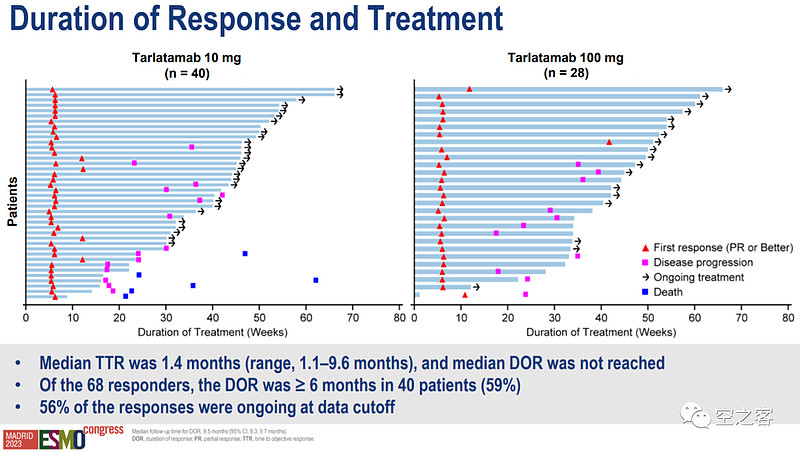
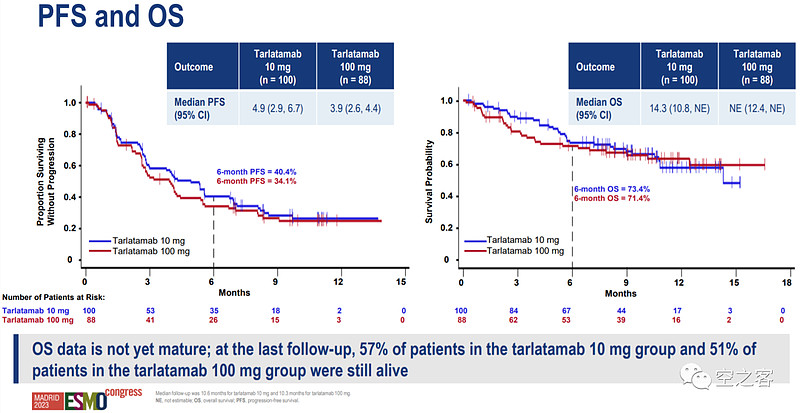
在生存期方面,两个剂量组的mPFS分别为4.9和3.9个月、半年无进展生存率分别为40.4%和34.1%,10mg组的mOS为14.3个月、100mg组OS尚未成熟、半年总生存率分别为73.4%和71.4%,与之相比末线化疗的OS不到6个月;然而,两个剂量组的生存数据依然都倒挂了。
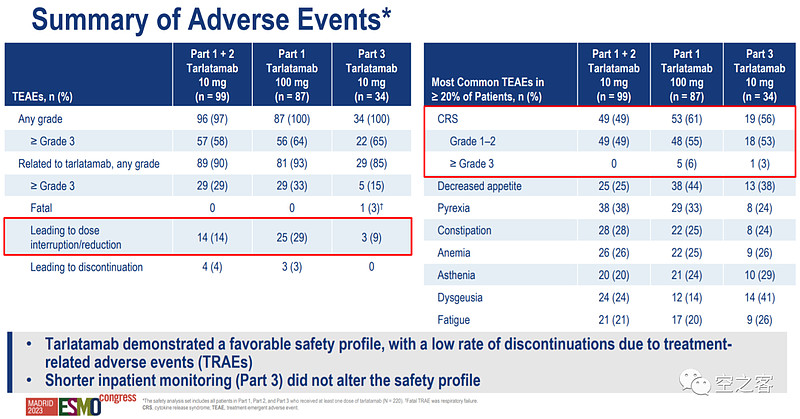
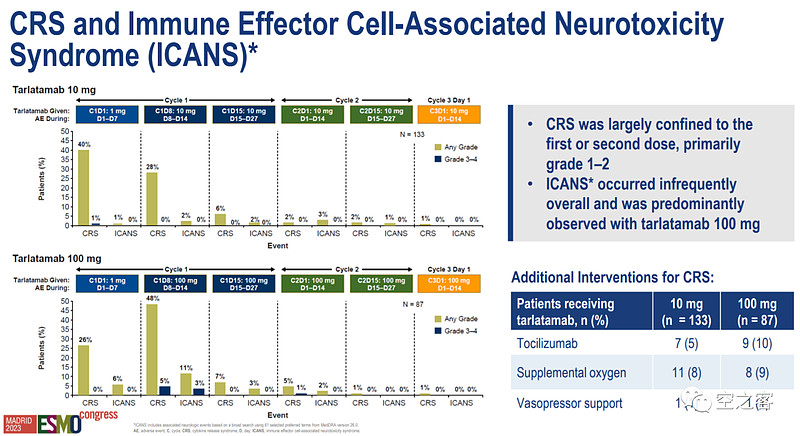
安全性方面,最重要的AE依然是CRS,在两个组分别发生率为49%和61%,而在10mg组未出现3级以上CRS、100mg组出现5例,且10mg组的ICANS事件和因AE而停药的比例都明显更低。这也是三期选择低剂量组的重要原因,如果能延续这种安全性水平,CRS整体而言看起来是可控的。
总体而言,Tarlatamab此次公布的二期SCLC数据可以说比较惊艳,针对末线患者大幅度提升了响应率和生存期,这对于几乎无药可治的患者群体意义重大。

5. 靶向DLL3的CAR-T
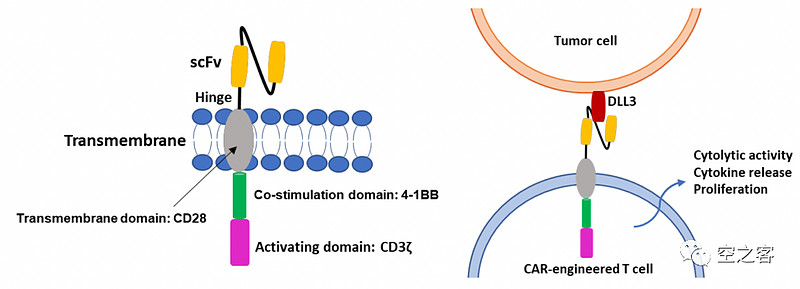
在这个方向上,先行者肯定轮不上传奇,而是DLL3狂魔Amgen,早在2018年就将AMG-119推上了临床,这是由包含DLL3 ScFv+CD28跨膜结构域+4-1BB共刺激结构域+CD3ζ信号结构域的慢病毒载体转染患者T细胞,所形成的自体CAR-T产品。
在FIH临床中共治疗了5名复发难治SCLC患者,AMG-119使用3*10^5/kg的保守起始剂量、第二剂量组使用1*10^6/kg,随后1名低剂量组和2名高剂量组的患者接受了与此前相同剂量的第二次输注。
低剂量组患者中,2名SD+1名PD;高剂量组患者中,1名PR、另1名无法评估(无法确定是否在规定时间内从SD发展到PD);且均未观察到DLT或4级以上TEAE,也未出现CRS。
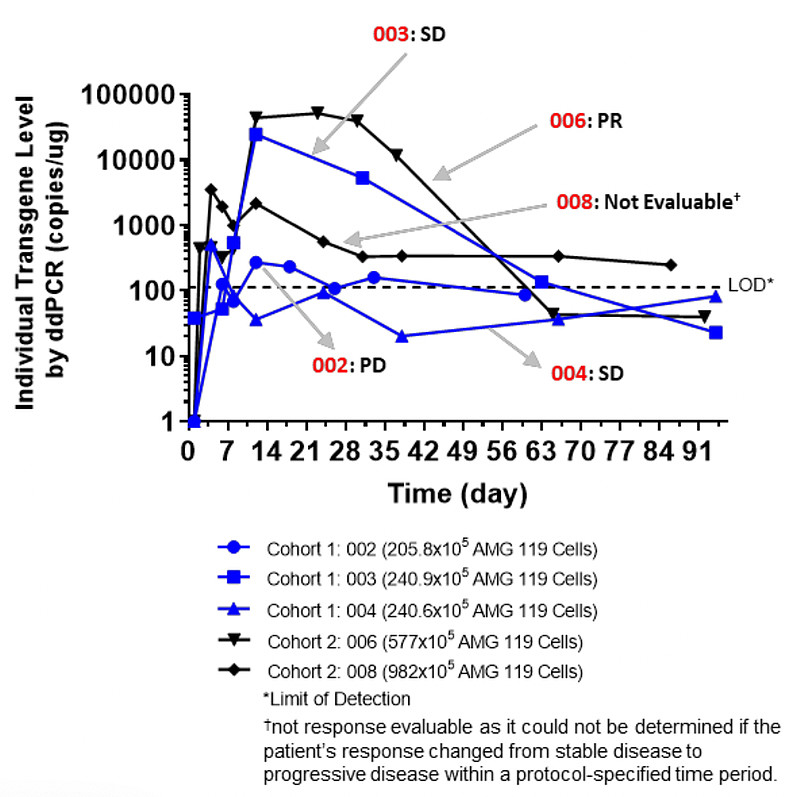
在这样一个探索性的临床之后,AMG-119基本就从Amgen的披露中消失了、CT.gov上也转为暂停,基本可以理解为Amgen在DLL3靶点已经放弃CAR-T而全力推进双抗。
那么,这款沿用标志性的双重链结合域的DLL3 CAR-T能续写传奇吗?
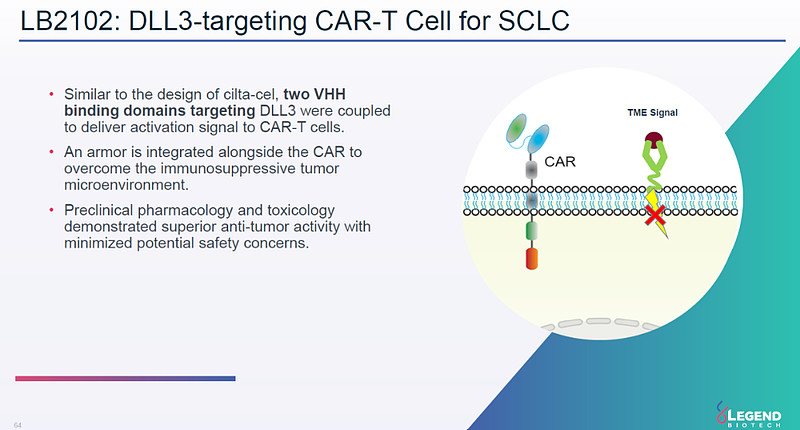
综上所述,DLL3靶点长期在暗夜中禹禹独行,Amgen双抗Tarlatamab的积极二期数据让天边依稀泛起了晨曦,而传奇与Novartis的交易在淡淡微光中添上一抹朝霞的红色。
终章无可预料,无论是传奇成就DLL3、还是DLL3成就传奇,都是值得期待的故事。