8月18日,信达生物制药集团(香港联交所股票代码:01801)宣布,胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor, GLP-1R)/胰高血糖素受体(glucagon receptor, GCGR)双激动剂IBI362在中国超重或肥胖受试者中的一项随机、安慰剂对照、多次给药剂量递增Ib期临床研究的结果刊登于国际知名期刊柳叶刀子刊EClinicalMedicine。这是中国代谢领域首个在柳叶刀系列期刊发表的创新药物I期临床研究。北京大学人民医院纪立农教授和河南科技大学第一附属医院姜宏卫教授是该文的共同第一作者,其中纪立农教授也是该文的通讯作者。

该临床研究由纪立农教授牵头,是首个在中国人群中评估周制剂GLP-1R/GCGR双激动剂安全性与疗效的临床研究。除了显著的减重疗效外,IBI362还能带来血压、血脂、肝酶和血尿酸等多重代谢特征获益。
IBI362 (LY3305677) 是一种新型GLP-1R/GCGR双激动剂周制剂,正开发用于肥胖症和2型糖尿病的治疗。这项随机、安慰剂对照、多剂量递增Ib期研究旨在评估IBI362在中国超重或肥胖成人中的安全性、耐受性、药代动力学特征和疗效。
本研究从6家研究中心入组超重(体重指数[BMI]≥24 kg/m2)并伴有食欲亢进和/或至少一种并发症,或肥胖(BMI≥28 kg/m2)成人受试者。研究共入组36例受试者,研究过程中,无受试者因安全性原因终止治疗,未报告严重不良事件。胃肠道不良事件和食欲减退是最常见的不良事件,且大多为轻度。
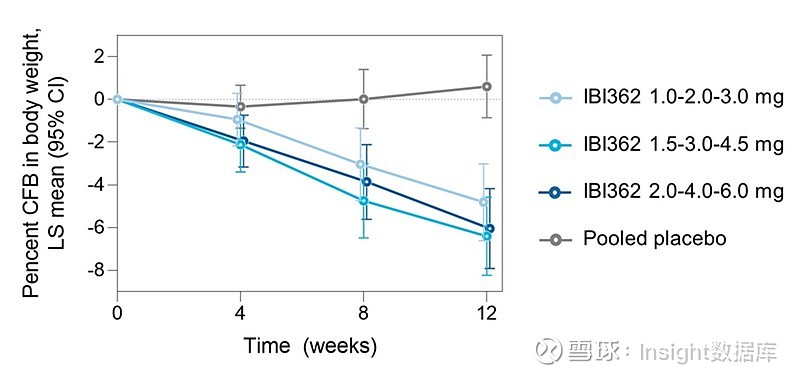
接受IBI362治疗的3例受试者的心电图检查结果提示轻度且无症状的心脏事件。第12周时,3.0 mg、4.5 mg和6.0 mg队列中接受IBI362治疗的受试者体重较基线平均百分比变化分别为−4.81%(95%CI:−6.61,−3.02)、−6.40%(−8.23,−4.58)和−6.05%(−7.91,−4.18),接受安慰剂的受试者较基线平均百分比变化为0.60%(−0.86,2.07)。同时,IBI362各剂量组在腰围、体重指数、血压、胆固醇和甘油三酯水平方面均得到改善。