4 月 9 日,百时美施贵宝宣布,Opdivo+化疗/Yervoy 一线治疗晚期或转移性食管鳞癌(ESCC)的 3 期临床研究(代号 CheckMate-648)达到积极顶线结果。

在预先设定的中期分析中,Opdivo 联合化疗在肿瘤表达 PD-L1 的患者以及所有随机化患者中的主要终点和次要终点均具有统计学意义和临床获益。此外,在表达 PD-L1 的患者中,Opdivo 联合化疗在经 BICR 评估的无进展生存期(PFS)具有显示统计学意义和临床意义。
Opdivo 联合 Yervoy 在表达 PD-L1 的患者及所有人群中的总体生存率(OS)具有统计学意义和显著临床改善,达到了其主要终点和次要终点。但是,在表达 PD-L1 的患者中,Opdivo 联合 Yervoy 未达到 BICR 评估的 PFS 主要终点。Opdivo 以及 Opdivo+Yervoy 组合的安全性与先前报道的一致。
CheckMate -648 是一项随机的 3 期临床,旨在评估 Opdivo+Yervoy 或 Opdivo+氟尿嘧啶+顺铂在不可切除的晚期或转移性食管鳞状细胞癌患者中疗效。该试验的主要终点是肿瘤表达 PD-L1 患者的总生存期(OS)和经 BICR 评估的无进展生存期(PFS),次要终点为所有患者 OS 和 BICR 评估的无进展生存期。
在 Opdivo +Yervoy 组中,患者每 2 周接受 Opdivo 3 mg / kg 的治疗,每 6 周接受 Yervoy 1 mg / kg 的治疗,治疗 24 个月或疾病进展或发生不可接受的毒性。
在 Opdivo+化疗组中,患者在第 1 天和第 15 天接受 Opdivo 240 mg 治疗,从第 1 天到第 5 天(持续 5 天)接受 800 mg /m²/天的氟尿嘧啶治疗,并在 4 周为一个周期的第 1 天接受顺铂 80 mg /m²的治疗。患者接受 Opdivo 治疗 24 个月或直到疾病进展或毒性不可接受为止,化疗直到疾病进展或毒性不可接受为止。
作为世界上首个获得监管部门批准的 PD-1 免疫检查点抑制剂, 目前 Opdivo 已在超过 65 个国家/地区获得批准。根据企业财报,Opdivo 在上市前几年销售额涨势喜人,但是自 2018 年被 K 药反超后增长开始疲软, 2020 年实现销售额 70 亿美元 (同比 -3%),首次出现下滑。
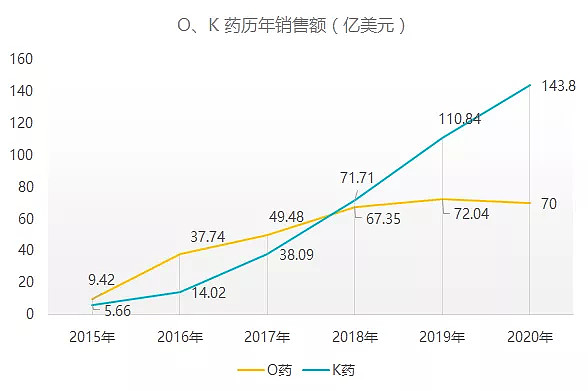
在 PD-1/L1 领域,适应证的的拓展成为市场规模扩大的核心驱动力,而 K 药近年来凭借新适应不多拓展乘风之上,直逼药王。目前两大 PD-1 均在适应症拓展上发力,拒不完全统计,K 药已获批 16 个适应症,O 药已获批 14 个适应症。
食管癌是全球第 8 大常见癌症,也是第 6 大癌症死亡原因,2020 年新增病例约 60.4 万例,死亡人数超过 54.4 万。食管癌最常见的两种类型是鳞状细胞癌(ESCC)和腺癌,它们分别约占所有食管癌的 90% 和 10%。
在国内,目前 K 药已获批二线局部晚期或转移性食管鳞状细胞癌(PD-L1 阳性,综合阳性评分 CPS≥10);国产 PD-1 中,恒瑞的卡瑞利珠单抗已获批二线食管鳞癌,此外卡瑞利珠单抗一线治疗晚期食管癌适应症也已报上市。百济神州替雷利珠单抗二线食管鳞癌也达到临床终点,预计不日即将报产。
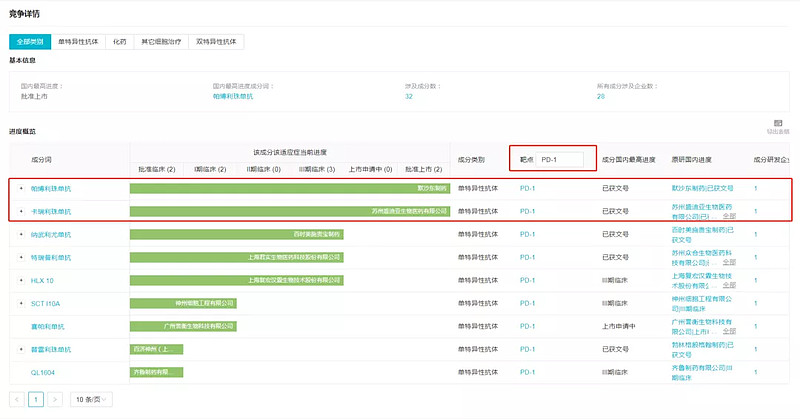
图片来源:Insight 数据库(网页链接)