大家好,我是播报员小新
这是丁香园 Insight 数据库
药圈新闻播报时间
我今天为大家带来行业内的 6 条重要新闻
今日新闻概要
1. K 药组合疗法获 CHMP 推荐批准
2. 拜耳广谱抗癌药欧盟上市在即
3. BMS 免疫刺激三联疗法获 CHMP 推荐批准
4. 阿斯利康 Lynparza 获 NICE 批准
5. 三生制药益赛普®水针剂报上市
6. 石药集团新型靶点抗肿瘤药物获临床许可

Keytruda+Inlyta 免疫组合疗法获欧盟 CHMP 推荐批准
7 月 30 日,默沙东宣布,欧洲药品管理局人用医药产品委员会(CHMP)已发布积极审查意见,推荐批准 PD-1 肿瘤免疫疗法 Keytruda(pembrolizumab)联合辉瑞新一代肾癌靶向治疗药物 Inlyta(axitinib,阿昔替尼),用于一线治疗晚期肾细胞癌(RCC)患者。

Keytruda 属于 PD-1 肿瘤免疫疗法,Inlyta 是一种口服抗血管生成药物。此次 CHMP 的积极审查意见,基于关键性 III 期临床研究 KEYNOTE-426(NCT02853331)的数据。该研究将 Keytruda+Inlyta 方案与晚期 RCC 一线标准护理药物 Sutent(索坦,舒尼替尼)进行了对比。
数据显示,在既往未接受治疗的晚期或转移性 RCC 患者中,与晚期 RCC 一线标准护理药物 Sutent 相比,Keytruda+Inlyta 方案在总生存期(OS)、无进展生存期(PFS)、总缓解率(ORR)方面表现出了统计学意义的显著改善,并且具有可控的安全性。
现在,CHMP 的审查意见将递交至欧盟委员会(EC),后者将参考 CHMP 的意见并预计在今年第三季度做出最终审查决定。

拜耳广谱抗癌药 Vitrakvi 欧盟上市在即
近日,拜耳(Bayer)宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极审查意见,推荐批准靶向抗癌药 Vitrakvi(larotrectinib),用于肿瘤中存在神经营养受体酪氨酸激酶(NTRK)基因融合的实体瘤儿童和成人患者,具体为:NTRK 基因融合阳性、局部晚期、转移性或手术切除可能导致严重并发症、没有满意的替代治疗选择的患者。
Vitrakvi 的活性药物成分为 larotrectinib,这是一种强效、口服、选择性原肌球蛋白受体激酶(TRKs)抑制剂,旨在直接靶向 TRK(包括 TRKB、TRKB、和 TRKC),关闭导致 TRK 融合肿瘤生长的信号通路。
在临床研究中,Vitrakvi 被调查治疗了 29 种不同组织学的实体瘤。结果显示,Vitrakvi 针对 TRK 融合肿瘤具有显著且持久的抗肿瘤活性,包括原发性 CNS 肿瘤和脑转移瘤,无论患者年龄及肿瘤组织学如何。


BMS/艾伯维免疫刺激疗法 Empliciti 三药方案获 CHMP 推荐批准
近日,百时美施贵宝(BMS)宣布,欧洲药品管理局人用医药产品委员会(CHMP)已发布积极审查意见,推荐批准免疫刺激疗法 Empliciti(elotuzumab)联合 Pomalyst(pomalidomide,泊马度胺)及低剂量地塞米松方案(EPd),用于既往已接受至少 2 种疗法并且接受最后一种疗法病情进展的复发或难治性多发性骨髓瘤(R/R MM)成人患者。
此次 CHMP 的积极审查意见,基于 II 期临床研究 ELOQUENT-3 的积极数据。数据显示,与 Pd 治疗组相比,EPd 治疗组疾病无进展生存期(PFS)显著延长(中位 PFS:10.25 个月 [95%CI:5.59 个月-不可估计] vs 4.67 个月 [95%CI:2.83 个月-7.16 个月])、进展或死亡风险显著降低 46%(HR=0.54,95%CI:0.34-0.86,p=0.0078)。有更高比例的患者达到非常好或更好的部分缓解(20%[n=12] vs 8.8%[n=5])。安全性方面,严重不良反应发生率,EPd 方案为 22%,Pd 治疗组为 15%。因不良反应导致的停药率,EPd 治疗组为 5.0%,Pd 治疗组为 1.8%。
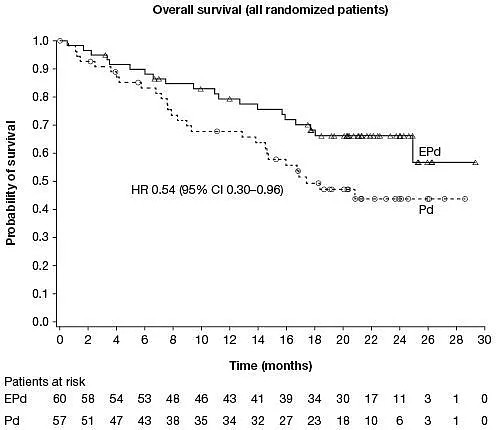
现在,CHMP 的审查意见将递交至欧盟委员会(EC),后者将参考 CHMP 的意见并在未来 2-3 个月内做出最终审查决定。在美国,FDA 于 2018 年 11 月批准 EPd 方案上述适应症。

阿斯利康/默沙东 Lynparza 获 NICE 批准,用于 BRCAm 卵巢癌一线维持治疗
近日,阿斯利康宣布其靶向抗癌药 Lynparza(中文品牌名:利普卓)已获 NICE 发布最终指导意见,批准用于英国国家卫生服务系统(NHS),作为一种一线维持疗法,用于接受一线含铂化疗后病情缓解的 BRCA 突变(BRCAm)晚期卵巢癌患者,具体为:携带 BRCA1/2 突变的晚期(FIGO 分期:III 期和 IV 期)上皮卵巢癌、输卵管癌或原发性腹膜癌患者。

此次NICE 的决定,基于关键性 III 期临床研究 SOLO-1 的结果。该研究结果显示,与安慰剂相比,Lynparza 使无进展生存期(PFS)实现统计学显著和临床意义的改善、疾病进展或死亡风险降低 70%(HR=0.30[95%CI=0.23-0.41],p<0.001)。随访 41 个月,Lynparza 治疗组中位 PFS 尚未达到,安慰剂组为 13.8 个月。Lynparza 治疗组有 60.4% 的患者在治疗 3 年后病情没有进展,安慰剂组为 26.9%。该研究中,Lynparza 的安全特征与之前的研究一致。
在中国市场,Lynparza 于 2018 年 8 月 23 日获得 NMPA 批准,用于铂敏感复发性卵巢癌的维持治疗。此次批准,使 Lynparza 成为中国市场首个获批治疗卵巢癌的靶向药物,标志着中国卵巢癌治疗进入 PARP 抑制剂时代。

三生制药预充式益赛普水针剂新药申请获药监局受理
7 月 29 日,三生制药公布,该公司旗下三生国健药业 (上海) 股份有限公司自主研发的抗体融合蛋白药物产品预充式益赛普水针剂已向国家药品监督管理局递交新药生产申请并获得受理。

益赛普®是一种重组人 II 型肿瘤坏死因子受体 — 抗体融合蛋白注射液,靶向类风湿关节炎、强直性脊柱炎和斑块状银屑病病理过程中的主要炎性介质 — TNF-α。其可与 TNF-α结合,抑制 TNF-α的生物学活性,从而达到治疗效果。
此次益赛普水针剂是中国第一个自主研发的预充式融合蛋白注射液。其用于三个适应症的治疗:活动性强直性嵴柱炎、中度及重度活动性类风湿关节炎、18 岁及 18 岁以上成人中度及重度斑块状银屑病。据研究表明,这三种疾病在我国患病率分別约为 0.3% 、0.4% 、0.1% 。目前,患者对生物制剂使用依从性尚不理想。而患者用药依从性差也是导致疾病反复发作的重要原因之一。
据悉,益赛普®于 2006 年上市粉针剂,至今已累计使超 300,000 名患者治疗获益,得到临床医生的专业认可和广泛的患者信任,并于 2017 年被納入国家医保乙类目录。预充式益赛普®水针剂将带来更多剂型选择,有望惠及更多患者。

石药集团新型靶点抗肿瘤药物「SYHA1807」获临床许可
7 月 29 日,石药集团发布公告,该集团开发的「SYHA1807」已获得中国国家药品监督管理局批准可以在中国开展临床研究。

公告显示,该产品在国内外有多件专利申请。该产品是一种新型小分子激酶抑制剂,目前全球尚无同类产品上市。本次获批的临床适应症为用于小细胞肺癌的治疗。临床前研究显示,该产品具有优异的体内外抗肿瘤活性和良好的安全性,极有希望在临床研究中展现出良好的小细胞肺癌治疗效果。
该集团将全力以赴推进该产品的临床研究工作,力争该产品尽快上市。
▲ 以上新闻精选自 Insight 医药新闻
Insight 医药新闻,每天从 200 多篇医药新闻中精选出 4-8 篇,只给你最重要的精选新闻实事。

小新的话
每天同一时间
和你一起看药圈新闻


Insight 竞品情报付费报告
服务介绍
信息爆炸、政策多变的年代,您可能需要一份竞品情报报告(Competitive Intelligence,CI),为您省去海量数据查询、信息整合的烦恼,轻轻松松掌握市场趋势,了解竞争对手行动。
Insight 竞品报告
内容涵盖面:你关注领域和竞品申报、上市、国内外临床试验动态
多维度可视化:将有进展、新公示数据标识出来,通过标签整理治疗领域、靶点,满足不同维度的搜索,让竞争格局一目了然
频次:每月一期
报告形式:PPT/PDF+Excel 原始数据,可提供中英文版本
如何获得报告服务:
1. 点击下方阅读原文,或者复制链接在浏览器打开 网页链接,填写您的报告需求
2. 或致电报告服务热线:400-6571-918