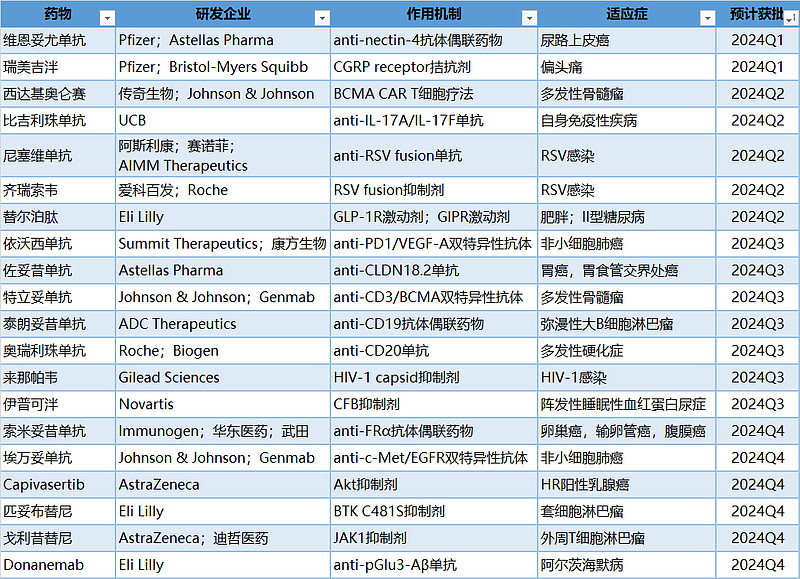
2023年已接近尾声,截至目前,国家药品监督管理局共批准了71款新药(不包括中药、新适应症),数量相比上年明显增加,另外有6款新冠药物被纳入紧急使用,抗体偶联药物德曲妥珠单抗、BCMA CAR T细胞疗法伊基奥仑赛、anti-FcRn抗体艾加莫德α、小干扰RNA药物英克司兰等重磅药物的上市改变了相应疾病的治疗格局。
当前,在中国申报上市的新药逐年增多,其中不乏针对未被满足临床需求且具有明显临床价值的药品,在新的一年来临之际,医药魔方再给大家梳理一下2024年有望在中国批准上市的重磅新药,供大家参考。
2024年有望在中国获批的重磅新药
一、肿瘤领域
2024年,在肿瘤领域预计将有多款重磅药物获批上市,如全球首个针对叶酸受体α阳性卵巢癌的ADC药物索米妥昔单抗、全球首款anti-CLDN18.2的单抗佐妥昔单抗以及康方生物50亿美元出海的重磅药物依沃西单抗等,这些first-in-class药物的获批将为中国患者带来更好的治疗选择。
维恩妥尤单抗(enfortumab vedotin,Padcev)
预计批准时间:2024Q1
维恩妥尤单抗是由Seagen(Pfizer子公司)与Agensys(Astellas子公司)开发的first-in-class靶向nectin-4的抗体偶联药物,由全人源anti-nectin-4 IgG1抗体,可降解linker以及海兔毒素payload MMAE组成,它是第一个在临床试验中证明对铂类化疗和PD1/PDL1治疗失败的尿路上皮癌有效的药物。
2018年3月FDA授予维恩妥尤单抗突破性疗法认定,2019年12月在美国通过加速审批上市,用于PD-1/L1耐药并接受过含铂辅助/新辅助化疗的患者,治疗局部晚期或转移性尿路上皮癌。2023年12月15日,维恩妥尤单抗联合帕博利珠单抗治疗局部晚期或转移性尿路上皮癌由加速批准转为常规批准,这也是首款获批的ADC+PD1联合疗法。

数据来源:NextPharma®数据库-获批适应症
2023年3月,维恩妥尤单抗首次在中国递交上市申请,该申请基于EV-203 (NCT04995419)临床数据,EV-203是一项单臂、开放标签、多中心的II期临床研究,探究维恩妥尤单抗对既往经含铂化疗和PD-1/PD-L1抑制剂治疗的中国局部晚期或转移性尿路上皮癌患者的抗肿瘤活性,ORR达37.5%。
此外,还有3款同靶点ADC药物处于临床前或临床研究阶段,其中进度仅次于维恩妥尤单抗的是由迈威生物从上海药物研究所引进的第二代nectin-4特异性ADC 9MW2821,该产品已于2023年12月启动注册性III期临床研究。
索米妥昔单抗(mirvetuximab soravtansine,Elahere)
预计批准时间:2024Q4
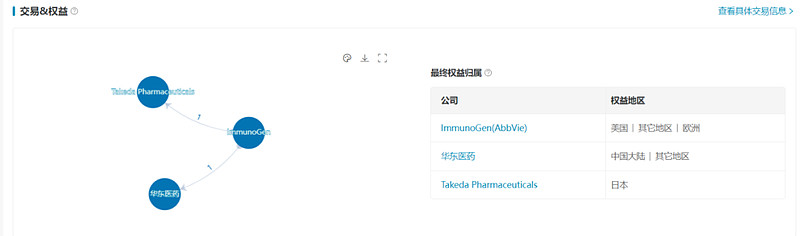
索米妥昔单抗是由ImmunoGen研发的靶向叶酸受体α(FRα)的抗体偶联药物,由一个嵌合anti-FRα IgG1抗体,可降解sulfo-SPDB linker,以及马坦霉素类抗微管蛋白剂DM4组成。
2020年10月ImmunoGen与华东医药达成战略合作,授予后者索米妥昔单抗在大中华区的开发和商业化权利,交易金额包括4000万美元预付款和2.65亿美元里程碑付款,以及一定比例的销售分成。2023年8月,ImmunoGen宣布与武田制药达成独家合作,在日本开发和商业化索米妥昔单抗。
点击下载:华东医药2023年第三季度报告(英文版)
数据来源:NextPharma®数据库-交易&权益
2022年11月,索米妥昔单抗在美国通过加速批准上市,获批用于既往经1-3线系统治疗,成人FRα阳性的铂耐药上皮卵巢癌、输卵管癌和原发性腹膜癌,并于同年被纳入NCCN指南,成为FRα阳性卵巢癌二线及以上治疗的首选药物。但由于可能带来的严重眼毒性风险,FDA对索米妥昔单抗给予黑框警告。
2023年10月,索米妥昔单抗上市申请被CDE受理,并被纳入优先审评目录。目前处于排队待审状态,有望于2024Q4在国内上市。
依沃西单抗(ivonescimab)
预计批准时间:2024Q3
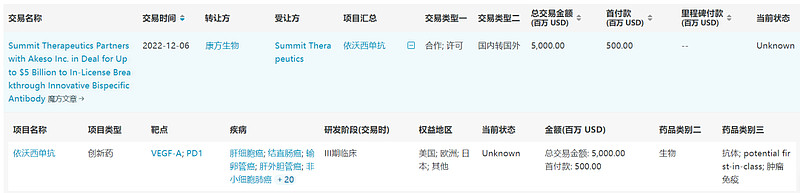
依沃西单抗是由康方生物自主研发、全球范围内首个进入上市申请阶段的anti-PD-1/VEGF四价双特异性抗体。依沃西单抗基于康方生物独特的Tetrabody技术设计,可以作为单一药物同时阻断PD-1和VEGF相关通路,从而增强抗肿瘤活性,是潜在first-in-class创新药。
2022年12月,康方生物以高达50亿美金(含5亿美金首付款)的总交易金额,外加销售净额两位数提成的合作方案,授予Summit Therapeutics在美国、欧洲、加拿大和日本独家开发和商业化依沃西单抗的权利,创下当时中国创新药物对外许可的最高纪录。
数据来源:NextPharma®数据库-交易&权益
目前,依沃西单抗在全球范围已启动开展7项注册性临床试验,其中3项是以PD-1单抗作为阳性对照药物的头对头研究。此外,依沃西单抗三个肺癌相关适应症被CDE纳入突破性治疗品种名单。
2023年8月,依沃西单抗首个NDA被CDE受理,联合培美曲塞和卡铂用于经EGFR抑制剂(EGFR-TKI)治疗后进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌的治疗,并获得优先审评资格。依沃西单抗目前处于排队待审状态,预计2024Q3在中国上市。
埃万妥单抗(amivantamab,Rybrevant)
预计批准时间:2024Q4
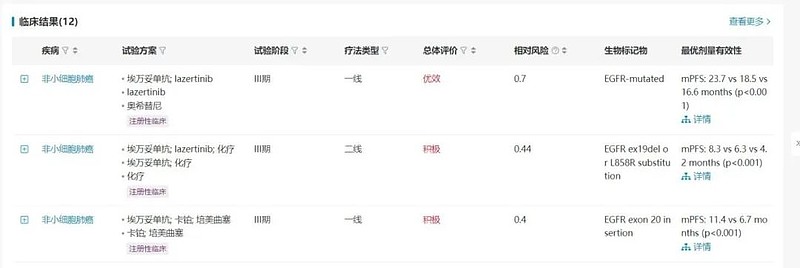
埃万妥单抗是由Genmab和Johnson & Johnson开发的一款first-in-class的c-Met/EGFR双特异性抗体。2021年5月,FDA加速批准埃万妥单抗用于正在接受或接受过含铂化疗后仍有疾病进展的EGFR Exon 20突变的非小细胞肺癌成年患者。
FDA对于埃万妥单抗的批准基于I期试验(NCT02609776)结果,针对二线EGFR exon 20插入突变患者,埃万妥单抗单药治疗的ORR达到40%。在一项III期试验(NCT04487080)中,埃万妥单抗联合lazertinib一线治疗EGFR突变的NSCLC患者的mPFS达到了23.7个月。
数据来源:NextPharma®数据库-临床结果
Johnson & Johnson于2023年10月向NMPA提交了埃万妥单抗的首个上市申请,有望于2024Q4在中国上市。
佐妥昔单抗(zolbetuximab)
预计批准时间:2024Q3
佐妥昔单抗是由德国Ganymed Pharmaceticals开发的一款靶向Claudin-18.2的IgG1抗体,用于治疗胃癌,胃食管交界处癌和胰腺癌,是同类产品中首个申请上市的药物。2016年12月,Astellas通过收购Ganymed Pharmaceticals获得佐妥昔单抗。
佐妥昔单抗已开展2项国际多中心III期注册性临床研究,均取得积极结果。Spotlight是佐妥昔单抗联合mFOLFOX6对比安慰剂联合mFOLFOX6一线治疗CLDN18.2阳性HER2阴性局部晚期不可切除或转移性胃或胃食管交界腺癌的临床研究,试验达到主要终点和次要临床终点,mPFS:10.61m vs 8.67m,mOS:18.23m vs 15.54m。
另一项注册性临床GLOW是佐妥昔单抗联合CAPOX对比安慰剂联合CAPOX一线治疗Claudin-18.2阳性HER2阴性局部晚期不可切除或转移性胃或胃食管交界腺癌的研究,mPFS:8.21m vs 6.80m,mOS:14.39m vs 12.16m。这2项临床研究结果提示佐妥昔单抗联合化疗有望成为新的Claudin-18.2阳性HER2阴性胃癌或胃食管交界腺癌的一线疗法。
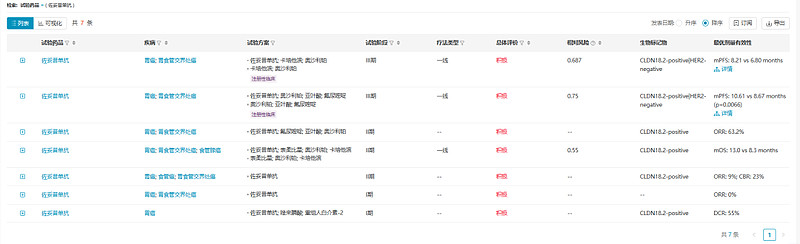
数据来源:NextPharma®数据库-临床结果
2023年6月以来,Astellas已分别在日本、美国、欧洲和中国递交上市申请,并被FDA授予优先审评资格。2023年8月CDE受理佐妥昔单抗上市申请,目前处于排队待审状态,预计2024Q3在中国获批。此外,还有3款anti-Claudin-18.2单抗处于III期临床,分别是明济生物的M108、AskGene Pharma的ASKB589和创胜集团的osemitamab。
Capivasertib (Truqap)
预计批准时间:2024Q4
Capivasertib是由AstraZeneca研发的一款first-in-class的Akt抑制剂。2023年11月,FDA批准Capivasertib联合氟维司群用于ER+/HER2-的局部晚期或转移性乳腺癌患者,这些患者接受至少一种基于内分泌的治疗方案进展后出现一种或多种PIK3CA/AKT1/PTEN改变,或在完成辅助治疗后 12 个月内复发。
Capivasertib治疗ER+/HER2-乳腺癌患者的III期临床试验(NCT04305496)取得积极临床结果。相较于氟维司群+安慰剂组,氟维司群+capivasertib组患者的疾病进展或死亡风险降低了40%,mPFS:7.2个月 vs 3.6个月。
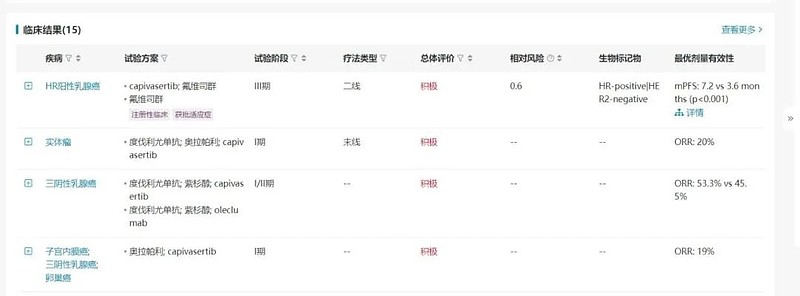
数据来源:NextPharma®数据库-临床结果
AstraZeneca于2023年10月向NMPA提交Capivasertib用于ER+/HER2-局部晚期或转移性乳腺癌患者的上市申请,目前处于排队待审状态,预计2024Q4在中国获批。
西达基奥仑赛(ciltacaptagene autoleucel,Carvykti)
预计批准时间:2024Q2
西达基奥仑赛是由传奇生物开发的针对BCMA的CAR-T细胞疗法,包含两种针对BCMA不同表位的单域抗体。2017年,Johnson & Johnson和传奇生物达成西达基奥仑赛全球合作和许可协议,交易总金额达17亿美元。
2022年2月,西达基奥仑赛被FDA批准用于治疗至少接受过四种治疗(包括免疫调节剂、蛋白酶体抑制剂和抗CD38抗体)的复发/难治性多发性骨髓瘤(RRMM)成人患者。同年在欧洲和日本获批上市。2022年,西达基奥仑赛全球销售额达1.3亿美元,2023年前三季度全球销售额超3.4亿美元。
FDA的批准基于关键I/II期试验(NCT03548207)结果,西达基奥仑赛具有优异的安全性和有效性,97例经过至少三线治疗的多发性骨髓瘤患者经治疗后ORR达到98%,sCR为67%。此外,西达基奥仑赛正在开展针对二线和一线多发性骨髓瘤的注册性临床试验。
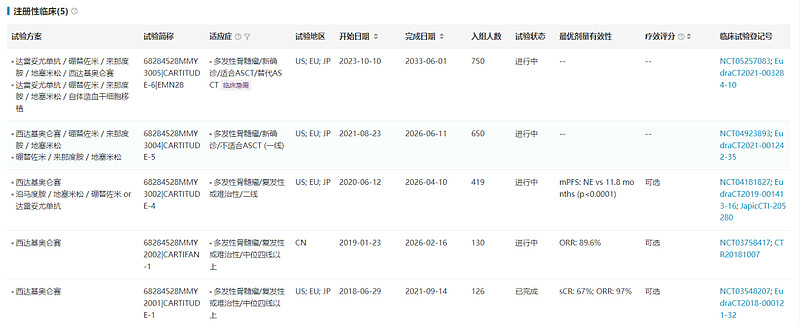
数据来源:NextPharma®数据库-注册性临床
西达基奥仑赛用于治疗复发/难治性多发性骨髓瘤被NMPA、EMA、FDA授予突破性疗法资格,也是第一个在中国获得突破性疗法资格的产品。传奇生物于2022年12月向NMPA提交西达基奥仑赛用于治疗多发性骨髓瘤的上市申请,并被纳入优先审评,预计2024Q2在中国上市。
特立妥单抗(teclistamab,Tecvayli)
预计批准时间:2024Q3
特立妥单抗是Genmab和Johnson & Johnson开发的一款first-in-class的anti-CD3/BCMA双特异性抗体。2022年8月在欧洲附条件上市,用于治疗至少接受过三种治疗(包括免疫调节剂、蛋白酶体抑制剂和抗CD38抗体)的复发/难治性多发性骨髓瘤(RRMM)成人患者,同年在美国获批。

数据来源:NextPharma®数据库-知识卡片
特立妥单抗治疗至少接受过三种治疗多发性骨髓瘤患者的I/II期临床试验(NCT04557098,NCT03145181)取得优效的临床结果。单药治疗患者的ORR达到61.8%,mFPS达到了7.4个月。
Johnson & Johnson于2023年8月向NMPA提交特立妥单抗用于至少接受过三种治疗的RRMM成人患者的上市申请(JXSS2300069),并获得了优先审评资格,预计2024Q3在中国上市。
泰朗妥昔单抗(loncastuximab tesirine,Zynlonta)
预计批准时间:2024Q3
泰朗妥昔单抗是ADC Therapeutics研发的靶向CD19的抗体偶联药物,由人源化anti-CD19 IgG1-kappa单抗通过蛋白酶切割的valine-alanine linker偶联SG3199组成,其中SG3199是一种吡咯并苯二氮杂䓬二聚体(PBD)烷基化毒素。
泰朗妥昔单抗最早于2021年4月在美国上市,它是第一个也是唯一一个获批上市的anti-CD19抗体偶联药物,作为单药治疗成人复发或难治性弥漫大B细胞淋巴瘤。该适应症的获批基于LOTIS-2临床试验(NCT03589469)数据,ORR达48.3%,CR为24.1%。2022年12月,泰朗妥昔单抗在欧洲获批上市。
2020年12月,瓴路药业与ADC Therapeutics达成合作,以在中国和新加坡开发、商业化包括泰朗妥昔单抗在内的4款ADC药物。2022年7月,瓴路药业与友华生技达成战略合作,后者获得泰朗妥昔单抗在台湾及新加坡的独家代理权。同年1月和7月,ADC Therapeutics分别与Mitsubishi Tanabe Pharma和Swedish Orphan Biovitrum合作,转让泰朗妥昔单抗在日本和欧洲的独家开发与商业化权益。
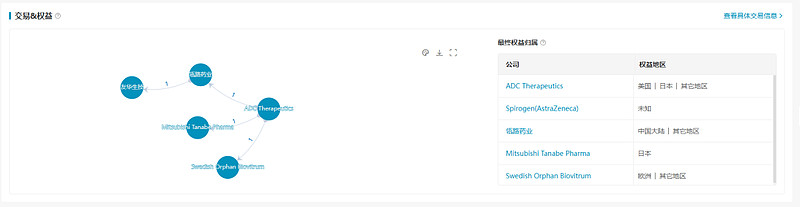
数据来源:NextPharma®数据库-交易&权益
2023年7月,泰朗妥昔单抗在中国申报上市,该申请基于II期OL-ADCT-402-001研究的积极数据。目前泰朗妥昔单抗已被纳入优先审评程序,预计2024Q3在国内上市。
匹妥布替尼(pirtobrutinib,Jaypirca)
预计批准时间:2024Q4
匹妥布替尼是由Eli Lilly研发的一款first-in-class的BTK C481S抑制剂。2023年1月,匹妥布替尼被FDA批准用于既往接受过至少二线系统治疗(包括BTK抑制剂)的复发或难治性套细胞淋巴瘤(MCL)成人患者。同年12月,匹妥布替尼被FDA加速批准用于既往接受过至少二线系统治疗(包括BTK抑制剂和BCL-2抑制剂)的慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)成人患者。
匹妥布替尼是FDA批准的第一个非共价BTK抑制剂,对于共价BTK抑制剂(伊布替尼、阿卡替尼或泽布替尼)耐药的患者,匹妥布替尼能够恢复对BTK的抑制,扩展靶向BTK的临床获益。
数据来源:NextPharma®数据库-知识卡片
Eli Lilly于2023年12月向NMPA提交匹妥布替尼用于既往接受过BTK抑制剂治疗的复发或难治性套细胞淋巴成人患者的上市申请,并获得了优先审评资格,预计2024Q4在中国上市。
戈利昔替尼(golidocitinib)
预计批准时间:2024Q4
戈利昔替尼是由迪哲医药自主研发的新一代口服高选择性JAK1抑制剂,相较 JAK家族其他成员有大于200倍的选择性,可减少因抑制JAK家族其他成员而导致的不良反应。戈利昔替尼是目前外周T细胞淋巴瘤领域唯一处于上市申请阶段的JAK1抑制剂。
数据来源:NextPharma®数据库-基本信息
注册性临床研究JACKPOT8(NCT04105010,CTR20192726)B部分结果显示,戈利昔替尼作为单药治疗二线外周T细胞淋巴瘤的ORR达44.3%,CR达23.9%,两者均高于现有治疗方案,此外在多种PTCL常见亚型中均观察到肿瘤缓解。
2023年9月,戈利昔替尼针对外周T细胞淋巴瘤的NDA被CDE正式纳入优先审评程序,目前处于排队待审状态。
二、自免领域
2024年,Roche重磅药物奥瑞利珠单抗以及UCB靶向IL-17A和IL-17F的抑制剂比吉利珠单抗有望在中国上市,其中奥瑞利珠单抗在全球已获批用于百亿美元市场的多发性硬化症领域,比吉利珠单抗则将为中国自免患者带来更优的治疗方案。
奥瑞利珠单抗(ocrelizumab,Ocrevus)
预计批准时间:2024Q3
奥瑞利珠单抗是Genentech和Biogen合作开发的重组人源化anti-CD20 IgG1抗体,已于美国和欧洲获批上市,用于治疗多发性硬化症。临床前研究显示奥瑞利珠单抗能够选择性结合B细胞表面CD20分子,而不与干细胞或浆细胞结合,因此能够保留免疫系统的重要功能。
2023年10月,Roche在第9届ECTRIMS-ACTRIMS联席会议上公布了奥瑞利珠单抗的10年随访数据,这些结果证实了奥瑞利珠单抗早期治疗在预防复发和初发进展型多发性硬化症残疾进展及维持患者活动能力中的关键作用。此外来自6,155名患者的10年安全性数据揭示了奥瑞利珠单抗的长期安全一致性。
与此同时,Roche也在推进奥瑞利珠单抗皮下注射液用于治疗多发性硬化症的研究(NCT05232825),该注册性临床结果显示,半年一次的10分钟皮下注射液不劣于半年一次的奥瑞利珠单抗静脉注射液,并且同样近乎完全抑制脑部病变。
自上市以来,奥瑞利珠单抗的销售额保持高速增长。2022年,奥瑞利珠单抗在美国销售额达到47.08亿美元,在欧洲销售额接近11.3亿美元。2023年7月,奥瑞利珠单抗在中国的上市申请获受理,目前处于排队待审状态。
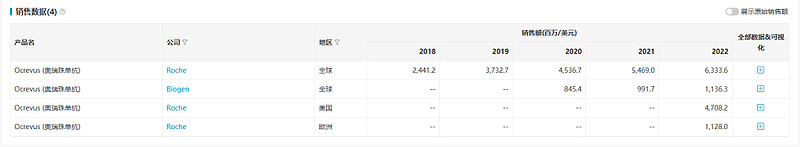
数据来源:NextPharma®数据库-销售数据
比吉利珠单抗(bimekizumab,Bimzelx)
预计批准时间:2024Q2
比吉利珠单抗是由UCB开发的一款新型人源化IgG1单抗,也是首款同时靶向IL-17A和IL-17F的抑制剂。目前国内已有3款IL-17类生物制剂获批上市,均来自外企,分别是Novartis的司库奇尤单抗、Eli Lilly的依奇珠单抗以及Kyowa Kirin的布罗利尤单抗。此外,智翔金泰抗IL-17A单抗金泰赛立奇单抗已递交上市申请。
在临床研究BE RADIANT中,比吉利珠单抗相比司库奇尤单抗显示出更优的疗效,其在第16周和第48周对中重度斑块状银屑病皮损的完全清除效果均优于司库奇尤单抗。自2021年8月以来,比吉利珠单抗已分别在欧洲、日本和美国上市,获批治疗斑块状银屑病、强直性脊柱炎、银屑病关节炎等自身免疫性疾病。
数据来源:NextPharma®数据库-研发时光轴(即将上线)
比吉利珠单抗在中国已开展针对强直性脊柱炎、非放射性中轴型脊柱关节炎、斑块状银屑病的注册性临床试验,2023年4月,比吉利珠单抗首次在中国申请上市,目前处于排队待审状态。
三、抗感染领域
2023年,全球有两款RSV疫苗获批上市,其中GSK研发的Arexvy成为全球首款上市的RSV疫苗,用于预防60岁以上人群的RSV感染;Pfizer研发的Abrysvo除用于60岁以上人群外,还可用于6个月以下婴儿的RSV预防。2024年,国内RSV感染的治疗及预防预计将迎来重要进展。
尼塞维单抗(nirsevimab,Beyfortus)
预计批准时间:2024Q2
尼塞维单抗是一款靶向RSV融合蛋白的单剂次长效抗体,用于婴幼儿RSV预防,由AstraZeneca和Sanofi开发。尼塞维单抗最早于2022年10月在欧盟获批,用于新生儿和婴幼儿在第一个RSV流行季预防RSV引发的下呼吸道疾病;2023年7月,在美国首次获批。
相对于首个上市的帕利珠单抗,尼塞维单抗的体外活性大约是帕利珠单抗的100倍,并且在Fc区域替换了三个氨基酸(YTE),这种替换可以增强对FcRn的亲和力,延长抗体在血液中的半衰期。帕利珠单抗在5个月的RSV季中需要每月注射一次,不适合健康婴儿的广泛应用,而尼塞维单抗一个RSV季只需要注射一次,因此有望用于所有婴儿预防RSV感染。
2021年1月,尼塞维单抗在中国被纳入突破性疗法,2023年5月,NMPA授予尼塞维单抗优先审评资格,预计2024Q2在中国获批。
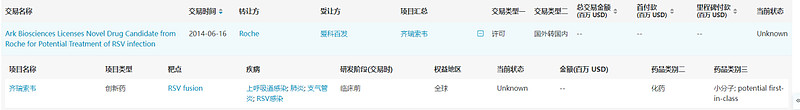
齐瑞索韦(ziresovir,爱司韦)
预计批准时间:2024Q2
齐瑞索韦是一款RSV融合蛋白的小分子抑制剂,通过与病毒的F蛋白结合从而阻止病毒侵入人体细胞。2014年,爱科百发从Roche引进这款药物的全球权益。
数据来源:NextPharma®数据库-交易&权益
截至目前,RSV感染领域已有疫苗和抗体类药物获批用于RSV感染的预防,尚无RSV特效治疗性药物获批。齐瑞索韦是全球首个成功完成三期关键临床试验的口服RSV抗病毒药物,2022年4月,爱科百发公布了多中心Ⅲ期试验(AIRFLO,NCT04231968)的积极结果,与安慰剂相比在RSV感染的婴幼儿住院患者中显著降低症状评分(p=0.002)及病毒载量(p=0.006)。
2020年9月,齐瑞索韦在中国被纳入突破性治疗品种,是首个获突破性认定的非肿瘤创新药。2022年11月,NMPA正式受理齐瑞索韦的上市许可申请,并且纳入优先审评审批程序。目前该药处于排队待审阶段,预计2024Q2在中国上市。
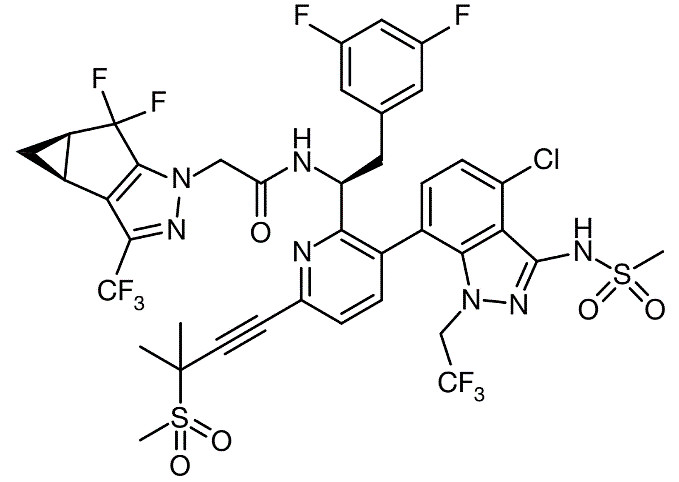
来那帕韦(lenacapavir,Sunlenca)
预计批准时间2024Q3
来那帕韦是Gilead研发的一款first in class的HIV-1衣壳抑制剂。大多数抗病毒药物只作用于病毒复制的一个阶段,而来那帕韦可通过干扰病毒生命周期的多个重要步骤抑制HIV-1的复制,包括抑制由病毒衣壳介导的HIV-1前病毒DNA的摄取、组装和释放,以及病毒衣壳核心的形成,而且对其他现有药物类型没有已知的交叉耐药性。
在药物设计上,来那帕韦除了增强活性,同时还聚焦于提高药物的代谢稳定性,包括引入吸电子基团(卤原子、磺酰基)、代谢稳定的环(环丙环、吡唑)。来那帕韦的药代动力学呈现缓慢、持续的特征,半衰期长达38天,在I期临床试验中,单剂GS-6207维持有效抗病毒血药浓度6个月以上。
数据来源:NextPharma®数据库-分子结构
2022年8月,来那帕韦在欧洲首次获批用于联合其他抗逆转录病毒药物用于无其他抗病毒治疗方案成人患者治疗多重耐药HIV感染,一年两次用药。之后在美国、日本陆续获批。2023年9月,来那帕韦注射剂及片剂均在中国申请上市,预计2024Q3上市。
四、其他领域
瑞美吉泮(rimegepant,Nurtec)
预计批准时间:2024Q1
瑞美吉泮是一款小分子CGRP受体拮抗剂,最初由Bristol-Myers Squibb研发,后授权给Biohaven,2022年5月10日,Pfizer宣布以116亿美元收购Biohaven,获得包括瑞美吉泮在内的多款CGRP疗法。
瑞美吉泮最早于2020年2月在美国上市,用于成人偏头痛的急性治疗,2021年5月,扩展用于预防成人发作性偏头痛。2022年4月,瑞美吉泮在欧洲上市,用于偏头痛的急性治疗和发作性偏头痛的预防。瑞美吉泮是第一个在偏头痛急性治疗和预防上都有效的CGRP药物。
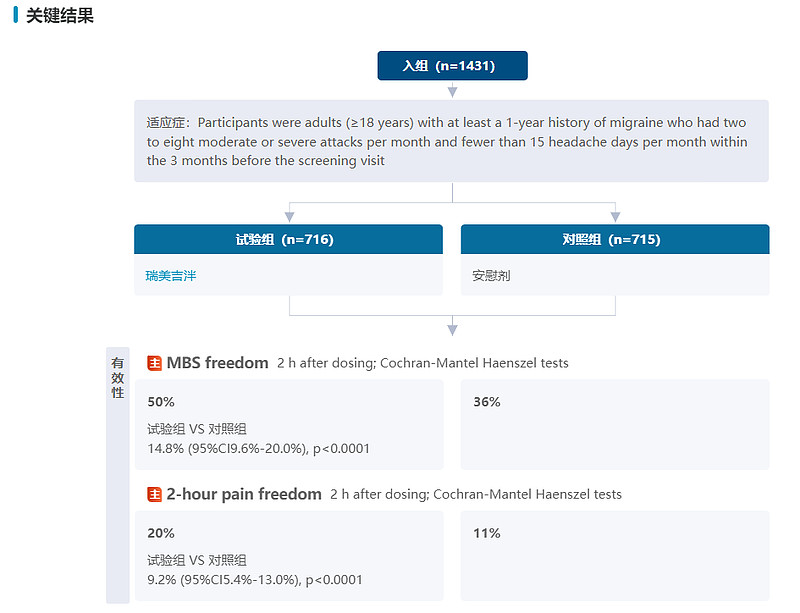
2023年5月,Pfizer在The Lancet Neurology上发表 BHV3000-310试验的完整结果,此研究首次在亚洲人群观察小分子CGRP受体拮抗剂对偏头痛急性期治疗的疗效,也是中国自2008年以来规模最大的偏头痛急性期治疗的RCT研究。单次口服瑞美吉泮75mg ODT 2小时后疼痛消除患者比例为20%,服药后2小时MBS(恶心、呕吐、畏光、畏声)消除的患者比例为50%,均显著高于安慰剂(分别为11%,36%,P<0.0001)。
数据来源:NextPharma®数据库-临床结果
Pfizer 2023年Q3财报显示,前三季度Nurtec ODT销售收入达6.46亿美元。2022年9月该药在中国首次申请上市,目前处于补充资料待审评阶段,预计2024Q1获批。
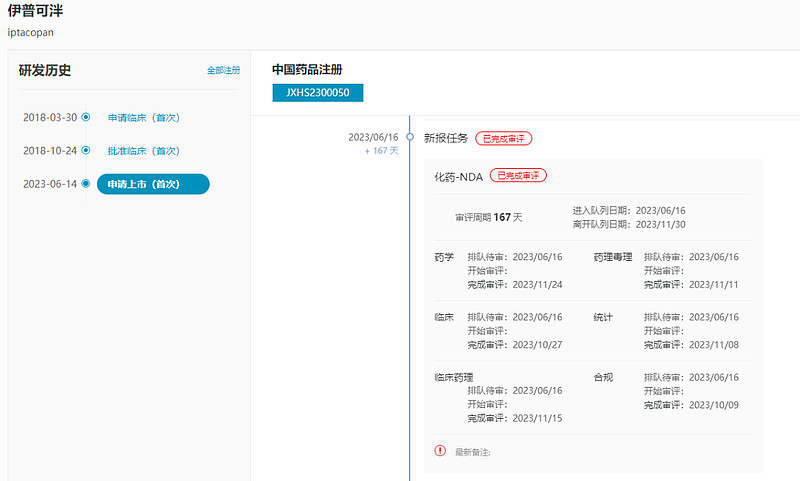
伊普可泮(iptacopan,Fabhalta)
预计批准时间:2024Q3
伊普可泮是Novartis研发的first-in-class补体因子B(complement factor B)抑制剂,作用于补体系统C5末端通路的上游,同时控制血管内溶血和血管外溶血,弥补了抗C5抗体的不足,并且为患者提供了口服单药的治疗选择。
2023年12月,基于3期APPLY-PN和APPOINT-PNH试验结果,FDA批准伊普可泮作为首个用于成人阵发性睡眠性血红蛋白尿症(PNH)的口服单药疗法,无需输血即可改善血红蛋白水平,是FDA批准的唯一一种免疫系统补体途径的B因子抑制剂。
中国进度方面,2023年3月,伊普可泮被正式纳入突破性疗法,6月在中国申请上市并以临床急需用药被纳入优先审评疗法,用于成人阵发性睡眠性血红蛋白尿症的治疗,预计2024Q2在中国获批。
数据来源:NextPharma®数据库-中国研发进度
替尔泊肽(tirzepatide,Zepbound)
预计批准时间:2024Q2
替尔泊肽是Eli Lilly研发的一款GIP和GLP-1双靶点受体激动剂,将两种肠促胰岛素的作用整合到一个新分子中,于2022年5月在美国首次获批用于治疗II型糖尿病。2023年11月,替尔泊肽获批用于肥胖和超重及伴有高血压、2型糖尿病、心血管疾病等健康问题而需要减肥并保持体重的人群。
在III期SURPASS试验中, 替尔泊肽对比各种阳性药(包括司美格鲁肽、度拉糖肽、甘精胰岛素、德谷胰岛素),都达到了更优的降低HbA1c的效果。
在SURMOUNT-1和SURMOUNT-2试验中,替尔泊肽 vs安慰剂组在72周的体重变化分别为-20.9% vs -3.1%(p<0.001),-14.7% vs -3.2% (p<0.0001)。
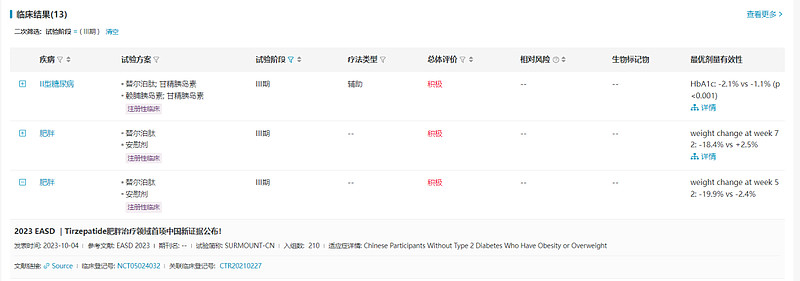
数据来源:NextPharma®数据库-临床结果
根据Eli Lilly发布的2023年前三季度财报,替尔泊肽仅第三季度销售额即高达14.09亿美元,较第二季度销售额增长43.8%。
2022年9月,基于SURPASS系列试验,替尔泊肽在中国递交II型糖尿病适应症的上市申请;2023年8月,基于SURMOUNT-CN注册临床试验在中国递交肥胖适应症的上市申请,预计2024Q2获批。
Donanemab
预计批准时间:2024Q4
Donanemab是Eli Lilly研发的一种靶向pGlu3-Aβ的抗体,pGlu3-Aβ是一种焦谷氨酸修饰的β淀粉样蛋白,存在于阿尔茨海默病淀粉样蛋白沉积物中,这种焦谷氨酰化修饰会增强多肽的疏水性,更容易形成寡聚体,且不易被肽酶降解。Donanemab通过与pGlu3-Aβ结合从而促进患者大脑中淀粉样蛋白斑块的清除,是目前pGlu3-Aβ靶点进展最快的一款新药。
2023年5月,Eli Lilly宣布Donanemab治疗早期阿尔茨海默病III期TRAILBLAZER-ALZ 2研究(NCT04437511)达到了主要终点和所有次要终点。与安慰剂相比,Donanemab治疗后临床衰退减缓了35%,日常生活能力下降减缓了40%。近半数(47% )的患者在1年内没有临床进展(定义为CDR-SB没有下降),而安慰剂组为29%。

数据来源:NextPharma®数据库-新闻热点
Eli Lilly已于2023年二季度向FDA递交Donanemab的上市申请,中国进度方面,2023年1月该药被正式纳入突破性治疗,同年10月31日在国内申请上市,用于治疗早期症状性阿尔茨海默病,11月正式纳入优先审评。目前在CDE处于排队待审评阶段,预计2024Q4获批。
$迪哲医药-U(SH688192)$ $百济神州(BGNE)$ $罗氏控股(RHHBY)$
国内生物医药产业链相关上市公司CXO:药明康德、凯莱英、泰格医药、昭衍新药、康龙化成、阳光诺和、药康生物、药石科技、数字人、诺思格、普蕊斯、药明生物、博腾股份、美迪西、南模生物、毕得医药、金斯瑞生物科技、普洛药业等;医院及诊断服务:爱尔眼科、通策医疗、金域医学、乐普生物,仁度生物,云康集团,美因基因,英诺特,奥浦迈,华大基因,乐普医疗,近岸蛋白,新芝生物,康为世纪,达安基因、新产业、万孚生物、科华生物、中源协和、基蛋生物、冠昊生物、透景生命、利德曼、迈普医学等;科学服务:诺唯赞、百普赛斯、优宁维;医美:爱美客、华东医药、ST美谷、华熙生物等;化学制药:恒瑞医药、复星医药、华东医药、新和成、人福医药、科伦药业、信立泰、丽珠集团、恩华药业、华海药业、海思科、健康元、贝达药业、健友股份、普洛药业、川宁生物、兴齐眼药、华润双鹤、亿帆医药、海普瑞、康弘药业、国药现代、新诺威、新华制药、海正药业、海翔药业、一品红、仙琚制药、宏源药业、国邦医药、东诚药业、京新药业、浙江医药、奥锐特、华邦健康、华北制药、泰恩康、翰宇药业、奥翔药业、九典制药、普利制药、拓新药业、冠福股份、天宇股份、华特达因、哈药股份、福元医药、奥赛康、亨迪药业、东北制药、金城医药、富祥药业、辰欣药业、千红制药、尔康制药、花园生物、海南海药、德展健康、津药药业、卫信康、长江健康、罗欣药业、立方制药、鲁抗医药、司太立、金石亚药、通化金马、江苏吴中、华仁药业、舒泰神、福安药业、力生制药、誉衡药业、常山药业、润都股份、中关村、复旦复华、哈三联、同和药业、诚意药业、昂利康、广生北大医药、美诺华、金陵药业、向日葵、新天地、汉商集团、山河药辅、威尔药业、神奇制药、富士莱、海欣股份等;中药:康惠制药、片仔癀、云南白药、同仁堂、华润三九、白云山、以岭药业、东阿阿胶、达仁堂、太极集团、济川药业、步长制药、天士力、吉林敖东、广誉远、红日药业、珍宝岛、康缘药业、康恩贝、众生药业、昆药集团、葵花药业、奇正藏药、江中药业、贵州百灵、马应龙、健民集团、九芝堂、桂林三金、信邦制药、仁和药业、羚锐制药、佐力药业、中恒集团、寿仙谷、精华制药、上海凯宝、华森制药、贵州三力、振东制药、葫芦娃、佛慈制药、亚宝药业、方盛制药、特一药业、千金药业、万邦德、益佰制药、青海春天、嘉应制药、盘龙药业、龙津药业、沃华医药、香雪制药、华神科技、太龙药业、康药业汉森制药、粤万年青、陇神戎发等;生物制品:智飞生物、万泰生物、长春高新、上海莱士、天坛生物、沃森生物、华兰生物、康泰生物、甘李药业、辽宁成大、通化东宝、华兰疫苗、博雅生物、我武生物、安科生物、西藏药业、派林生物、未名医药、义翘神州、双鹭药业、康华生物、卫光生物、万泽股份、百普赛斯、海特生物、康辰药业、赛升药业、优宁维、东宝生物、四环生物等;医疗设备:迈瑞医疗、联影医疗、微创医疗、澳华内镜、海泰新光、开立医疗、键凯科技、欧普康视、新产业、乐普医疗、鱼跃医疗、安图生物、美好医疗、九安医疗;医药商业:上海医药、益丰药房、大参林、九州通、国药股份、国药一致、中国医药、老百姓、一心堂、百洋医药、润达医疗、重药控股、海王生物、柳药集团、健之佳、漱玉平民、南京医药、华人健康、英特集团、瑞康医药、人民同泰、嘉事堂、鹭燕医药、合富中国、药易购、第一医药、达嘉维康、浙江震元、国发股份等;部分美股医药上市公司强生、礼来、诺和诺德、默沙东、艾伯维公司、阿斯利康、诺华制药、辉瑞、赛诺菲-安万特、福泰制药、硕腾、再生元制药、葛兰素史克、艾尔建医疗、武田制药、Genmab、阿里拉姆制药、卡地纳健康、百济神州、Royalty Pharma、拜玛林制药、传奇生物、Viatris、如瑞迪博士、Juno疗法、神经分泌生物科学、Sarepta疗法、梯瓦制药、Mylan