6月,阿斯利康旗下两款资产遭遇滑铁卢,三代EGFR抑制剂奥希替尼新辅助治疗非小细胞肺癌(NSCLC)的II期研究未达到预设50%的主要病理缓解率的主要终点,GLP-1受体激动剂AZD0186因不具备疗效差异性而面临被放弃的命运;K药和O药针对胃癌的3项III期临床结果也均令人失望;礼来偏头痛注射制剂Emgality单挑辉瑞口服疗法Nurtec ODT落败。在此,为大家筛选其中10项,以供参考。
1.一氧化氮疗法治疗纤维化间质性肺病III期研究
6月5日,Bellerophon Therapeutics宣布,其领先资产INOpulse治疗纤维化间质性肺病(fILD)III期REBUILD研究未达到主要终点。受此影响,该公司股价大跌86%。
INOpulse是一种药物-器械联合疗法,可通过输送装置和鼻插管将吸入式一氧化氮(iNO)直接送到患者的肺部,从而帮助血管(动脉)扩张,降低肺部血压,减少右心室的压力。由于吸入的一氧化氮在与血液接触后会迅速失活,因此该产品可以局部作用,全身性毒性很小。
REBUILD研究是一项随机、双盲、安慰剂对照的III期临床,旨在评估INOpulse治疗fILD患者的安全性和有效性。研究共纳入145名受试者,随机分组接受INOpulse(剂量iNO45,45μg/kg IBW/hr)和安慰剂治疗。主要终点是16周治疗后,通过活动记录仪测量的中度至剧烈体力活动(MVPA)变化。
结果显示,该试验未达到主要研究终点,iNO45表现比安慰剂每天差5.49分钟(p=0.2646)。次要终点方面,iNO45与安慰剂组差异极小,没有得到统计学意义上的改善。安全性方面,INOpulse耐受性良好,与II期研究一致,未发现新的安全性信号。
2.奥希替尼新辅助治疗EGFR突变NSCLC II期研究
2023 ASCO年会期间,阿斯利康公布了奥希替尼在可手术EGFR突变NSCLC患者中新辅助治疗的II期研究结果。
这是一项多中心II期临床研究,共纳入27例纳入I~IIIA期可手术NSCLC患者,他们接受1~2个月的奥希替尼新辅助治疗。主要终点是主要病理缓解率(预设终点:~50%),次要终点包括安全性(包括:手术并发症,不可切除率)和有效性(包括:淋巴结降期,病理缓解率,病理完全缓解率,5年DFS和OS),探索性终点是疾病持续(disease persistence)的机制。
患者基线如下,中位年龄66.5岁,81.5%为女性,IIB期和IIIA期占比最高,分别为占25.9%(n=7)和33.3%(n=9)。EGFR突变方面,ex19del和L858R的患者比例分别为11名(40.7%)和16名(59.3%)。
结果显示,中位接受奥希替尼新辅助治疗的时间为56天,主要病理缓解率15%,没有达到主要终点。病理缓解率为48%(13/27),病理完全缓解率为0%(0/27),淋巴结降期率为44%(4/9)。
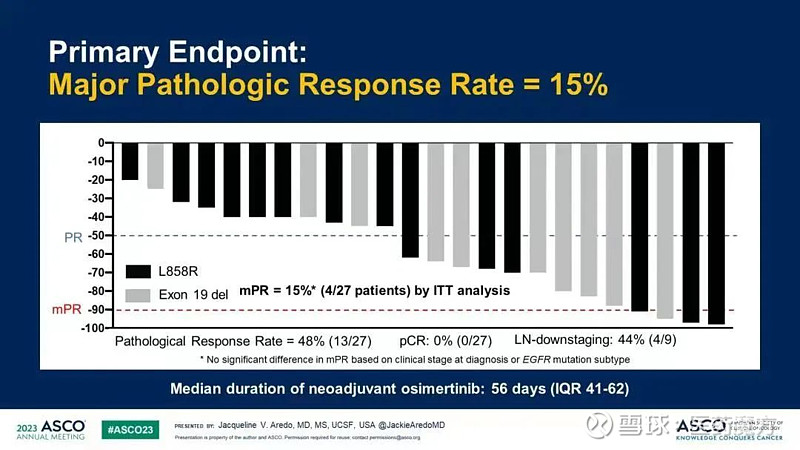
安全性方面,89%(24/27)的患者实现R0切除,3名患者(11%)不可切除转变为同步放化疗,其中1名(3.7%)是由于疾病进展。3名患者(11%)出现严重不良事件,分别是肺栓塞、房颤和呼吸困难。9名(38%)患者出现围手术期并发症中,且均为1~2级,未出现手术并发症。
3. O药+化疗辅助治疗中晚期胃癌III期研究
2023 ASCO年会期间,百时美施贵宝(BMS)公布了其PD-1药物纳武利尤单抗(Opdivo,简称O药)联合化疗作为中晚期(病理学III期,pStage III)胃或胃食管交界处(G/GEJ)腺癌辅助治疗的III期ATTRACTION-5研究结果。
在亚洲,D2根治术或更大范围胃切除术后的辅助化疗是病理学III期G/GEJ腺癌患者广泛使用的治疗标准。然而,标准辅助化疗对病理学III期G/GEJ腺癌的疗效有限。
ATTRACTION-5是一项多中心、双盲、随机研究,也是首个评估免疫检查点抑制剂与化疗联合辅助治疗病理学III期G/GEJ腺癌的III期研究,共纳入755例接受D2或更大范围胃切除术的病理学III期G/GEJ腺癌患者。
研究者为每例患者选择了合适的辅助化疗,然后将患者随机1:1分配到纳武利尤单抗联合化疗(N+C)组或安慰剂联合化疗(P+C)组。
研究的主要终点为研究中心评估的无复发生存期(RFS),次要终点包括研究者评估的RFS、OS和3年RFS率和OS率。
截止到2022年8月,即最后1例入组患者的随访时间达到36个月时,对RFS进行了最终分析。研究中心评估的主要有效终点(RFS)未能达到(HR,0.90;95.72% CI:0.69–1.18;P=0.4363),N+C组和P+C组的3年RFS率分别为68.4%(95% CI:63.0-73.2)和65.3%(95% CI:59.9-70.2)。计划的术后辅助治疗完成率为N+C组为61.5%,P+C组为71.4%。
安全性方面,N+C组3级治疗相关不良反应(TRAE)、严重TRAE和导致停药的TRAE的发生率分别为54.4%、25.3%和9.2%,P+C组分别为46.8%、10.7%和3.5%。
4. 首创CTGF单抗两项III期研究
6月7日, FibroGen公布了Pamrevlumab治疗无法步行的(non-ambulatory)杜氏肌营养不良症(DMD)患者的III期LELANTOS-1安慰剂对照试验的数据。与基线相比,在背景疗法糖皮质激素基础上接受Pamrevlumab治疗并未在第52周达到患者上肢功能2.0(PUL 2.0)评分改善的主要终点。Pamrevumab总体上安全性和耐受性良好,治疗中出现的大多数不良事件为轻度或中度。
Pamrevlumab是FibroGen开发的一款first-in-class结缔组织生长因子(CTGF)抑制剂。CTGF是纤维化和增生性疾病中重要的生物介质,研究表明,它可调控多种信号通路,造成细胞粘附和迁移、血管生成、肌成纤维细胞激活、细胞外基质沉积和重塑,共同导致组织重塑和纤维化。Pamrevlumab可通过抑制CTGF,逆转纤维化和肿瘤的增殖。
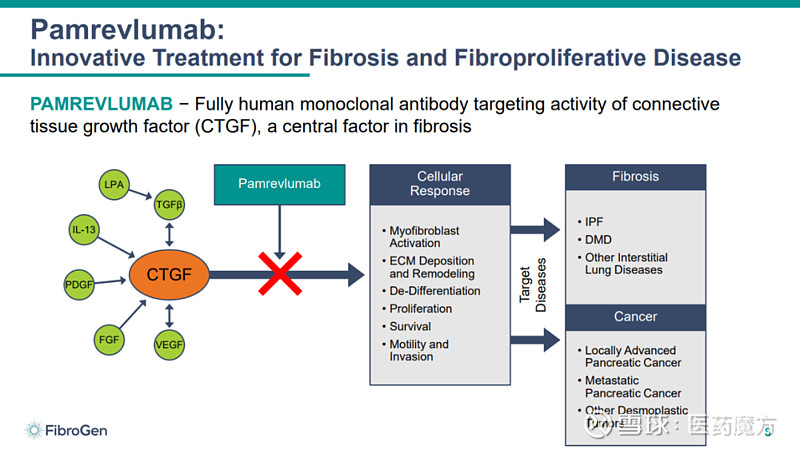
Pamrevlumab用于治疗能够步行的(ambulatory)DMD患者的另一项III期LELANTOS-2研究的数据预计将于2023年第三季度公布。
6月26日,Pamrevlumab再遭重创,治疗特发性肺纤维化的III期ZEPHYRUS-1研究没有达到用力肺活量(FVC)主要终点,同时也与次要终点疾病进展的时间擦肩而过。基于此,FibroGen将终止该药物的另一项III期ZEPHYRUS-2研究。
受此消息影响,FibroGen股价大跌83%,市值仅剩2.64亿美元。
FibroGen的2023年过得并不顺利。前不久,罗沙司他用于治疗输血依赖性低风险骨髓增生异常综合征患者贫血的III期MATTERHORN研究以失败告终。为了应对这些危机,FibroGen将采取相应措施使现金跑道延长至2026年。
5. 吸入式疗法治疗阵发性心房颤动III期研究
6月9日,ClinicalTrials.gov网站显示,InCarda Therapeutics已经终止了其吸入式InRhythm治疗阵发性心房颤动(PAF)的III期RESTORE-1研究,因为“盲法审查后发现疗效有限”。
InRhythm是一种新型的口服候选治疗药物,旨在通过肺部向心脏快速输送氟卡尼(一种成熟的抗心律失常药物),以恢复近期发病的新诊断和复发性PAF患者的窦性心律,并缓解相关症状。该疗法的开发最初是为了在有医疗监督的环境中使用,如医院、急诊室或医生办公室,随后是作为一种便携式治疗,可由患者在无医疗监督的环境中(如家里)自行使用。
RESTORE-1是一项3期、多中心、随机、双盲、安慰剂对照的临床研究,旨在评估与安慰剂相比,FlecIH-103(醋酸氟卡尼吸入液)针对近期发病、有症状的新诊断或阵发性房颤患者的疗效和安全性。原计划招募400例患者参加这项研究,实际招募了54例患者。
该研究的主要终点是开始用药后90分钟内房颤转为窦性心律的患者比例。还将评估安全性以及几个次要临床终点,包括房颤相关症状、住院、对其他房颤相关干预措施的需求以及出院时间。
此前,在II期单臂INSTANT研究中,共有98例患者通过使用呼吸驱动的雾化器进行8分钟的雾化,接受InRhythm,随后进行90分钟的连续监测。数据显示,转换率约为47%,从开始吸入到转换的中位时间不到14分钟。到第5天,几乎所有转换为窦性心律的患者(97.3%)都保持在窦性心律状态,无需进一步治疗。
6. GLP-1受体激动剂I期研究
6月15日,clinicaltrials.gov网站显示,阿斯利康决定终止GLP-1受体激动剂AZD0186的I期临床研究,原因是“基于从这项研究中获得的总体数据概况,AZD0186没有显示出足够的差异性以超过当前的护理标准。”
该项研究旨在评估健康成年受试者通过口服单次递增剂量(SAD)给药后AZD0186的安全性、耐受性和药代动力学。研究从2022年12月开始,实际招募了31例受试者。
这并不是阿斯利康第一次在GLP-1药物开发上折戟。今年4月,阿斯利康的另一款临床阶段的皮下注射GLP-1R/GCGR双重激动剂cotadutide已经从管线中消失。去年,该候选分子宣布开展针对非酒精性脂肪性肝炎的IIb/III期试验(NCT05364931),但后来纳入了54例患者后招募停止。
阿斯利康当时表示,在放弃每日1次的cotadutide后,公司将专注于开发每周1次的AZD9550(GLP-1R/GCGR双重激动剂),该项目目前已经进入I期临床(NCT05848440)。
7. Emgality预防偏头痛IV期头对头研究
6月16日,礼来宣布Emgality(galcanezumab)头对头Nurtec ODT(rimegeant口腔崩解片)预防成人发作性偏头痛CHALLENGE-MIG临床试验结果。Emgality没有达到研究的主要终点,定义为Emgality组每月偏头痛天数减少50%或以上的受试者比例在统计学上优于Nurtec ODT。这是同类试验中首个也是唯一一个比较两种降钙素基因相关肽(CGRP)拮抗剂疗法的试验。
Emgality是一种单克隆抗体(mAb),通过直接结合CGRP来抑制CGRP的作用,而Nurtec ODT则通过结合并阻断CGRP受体(CGRPR)发挥治疗作用。Emorality通过注射给药,Nurtec ODT通过口服给药。
CHALLENGE-MIG是一项为期3个月的IV期双盲临床研究,评估了Emgality与Nurtec ODT在预防成人发作性偏头痛方面的疗效和安全性。580名受试者被随机分配,分别接受注射4次Emgality 120 mg(两次负荷剂量,随后两个月每月注射1次)或口服45次Nurtec ODT 75 mg(每隔一日口服1片)治疗。此外,Emgality组的患者接受安慰剂ODT, Nurtec组的患者接受安慰剂注射。
两组患者的头痛缓解情况相似。然而,在这项为期3个月的研究中,Emgality显示出了具有临床意义的有效性和安全性,与Emgality之前为期6个月的研究一致。并且,Emgality在这项3个月试验的关键次要终点上表现更好。Emgality和Nurtec ODT的安全性与两种治疗药物之前报道的安全性一致,没有新的安全性相关发现。
CGRP/CGRPR抑制剂的出现正在逐步打开偏头痛市场,2022年,市场规模已经达到31.71亿美元。艾伯维、辉瑞、礼来是这一赛道的头号玩家。艾伯维3款产品Ubrelvy、Qulipta以及Botox已经覆盖所有偏头痛人群。辉瑞以约116亿美元收购Biohaven,获得了后者的CGRP项目,包括Rimegepant、Zavegepant以及5个临床前项目。而礼来试图通过头对头试验在这一赛道实现超越。
8.K药联合曲妥珠单抗与化疗一线治疗HER2阳性胃癌III期
6月16日,默沙东宣布,帕博利珠单抗联合曲妥珠单抗和化疗一线治疗HER2阳性晚期胃癌或胃食管交界处(GEJ)腺癌的III期KEYNOTE-811研究在中期分析时达到了无进展生存期(PFS)的主要终点。即,在意向性治疗(ITT)人群中,试验组患者的PFS相比安慰剂组显著延长。不过,该研究未达到总生存期(OS)显著延长的主要终点。
KEYNOTE-811研究共纳入732例患者,其中超过80%患者的肿瘤为PD-L1+。试验组患者需接受K药+曲妥珠单抗+化疗治疗,对照组患者则接受安慰剂+曲妥珠单抗+化疗。
在根据PD-L1表达状态划分的亚组人群中,仅PD-L1阳性患者(CPS≥1)的PFS显著延长。默沙东表示,已就上述结果与FDA进行沟通,并计划向FDA申请更新K药说明书中的适应症,即由HER2阳性胃癌或GEJ腺癌替换为HER2与PD-L1双阳性胃癌或GEJ腺癌。
9. K药围手术期治疗胃癌III期研究
6月20日,默沙东公布帕博利珠单抗对比安慰剂用于胃和胃食管连接处腺癌围手术期治疗的III期KEYNOTE-585研究的初步结果,该研究达到了病理完全缓解率的主要终点,但是错过了无事件生存期(EFS)另一主要终点。
6月20日,默沙东公布帕博利珠单抗对比安慰剂用于胃和胃食管连接处腺癌围手术期治疗的III期KEYNOTE-585研究的初步结果,该研究达到了病理完全缓解率的主要终点,但是错过了无事件生存期(EFS)另一主要终点。
KEYNOTE-585研究旨在评估帕博利珠单抗联合化疗作为局部晚期可切除性胃和胃食管连接处腺癌患者的新辅助和辅助治疗,然后再单用帕博利珠单抗加化疗进行辅助治疗。
独立数据监测委员会预先指定的中期分析显示,该研究达到了病理完全缓解率的主要终点,证明了与单独化疗相比,帕博利珠单抗联合疗法使患者的病理完全缓解率实现统计学意义的改善。主要终点包括病理完全缓解率、EFS、总生存期(OS)、经历一次或多次不良反应(AE)的患者比例以及因AE而停止治疗的患者比例。
对于EFS这一主要终点,帕博利珠单抗组具有改善的趋势;然而,根据预先指定的统计分析计划,EFS的改善无统计学意义。因此,该研究也没有正式评估OS主要终点。
10. 反义疗法治疗天使综合征I期研究
6月23日,据FirstWord报道,罗氏将终止推进反义寡核苷酸疗法rugonersen治疗天使综合征的临床开发。罗氏表示,这一决定无关安全性问题。换言之,疗效数据导致罗氏作出终止rugonersen开发的决定。
天使综合征是由于母源性泛素蛋白连接酶E3(UBE3A)基因表达异常或功能缺陷导致的神经发育障碍性疾病。
Rugonersen(RO7248824)是一种具有选择性的反义寡核苷酸疗法,它具有提高UBE3A的mRNA和蛋白表达水平的潜力。
I期TANGELO研究显示,虽然在脑电图模式(遗传性疾病的生物标志物)上观察到一些“令人鼓舞的效果”,但中期分析的临床改善水平不符合继续推进的预设标准。因此,罗氏计划寻求外部合作伙伴来负责rugonersen的开发。
停止rugonersen开发的决定并不意味着罗氏放弃天使综合征领域。罗氏补充说,正在进行的alogabat治疗天使综合征的II期研究将不受影响。该小分子是一款GABRA5正向变构调节剂。