
1月4日,Nature杂志对2021年美国FDA批准的新药做了盘点,并对销售额做了预测。此外还对2022年将获批新药做了统计。

尽管COVID-19的影响持续存在,但FDA去年的批准数量与近些年的趋势一致。FDA药物评价与研究中心 (CDER) 在2021年批准了50款新型疗法,低于2020年的53款。近5年CDER平均每年批准51款新药。十年前,则为每年24款。
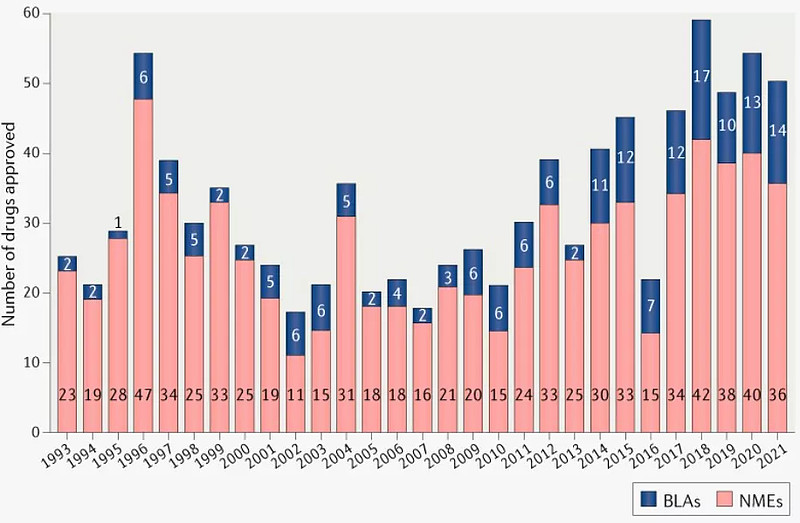
1993年以来FDA批准的新药数量
2021年CDER共批准了50款新药,包括首款治疗癌症的KRAS抑制剂和首款治疗阿尔茨海默病的抗淀粉样蛋白抗体。
2021年CDER批准的50款新药
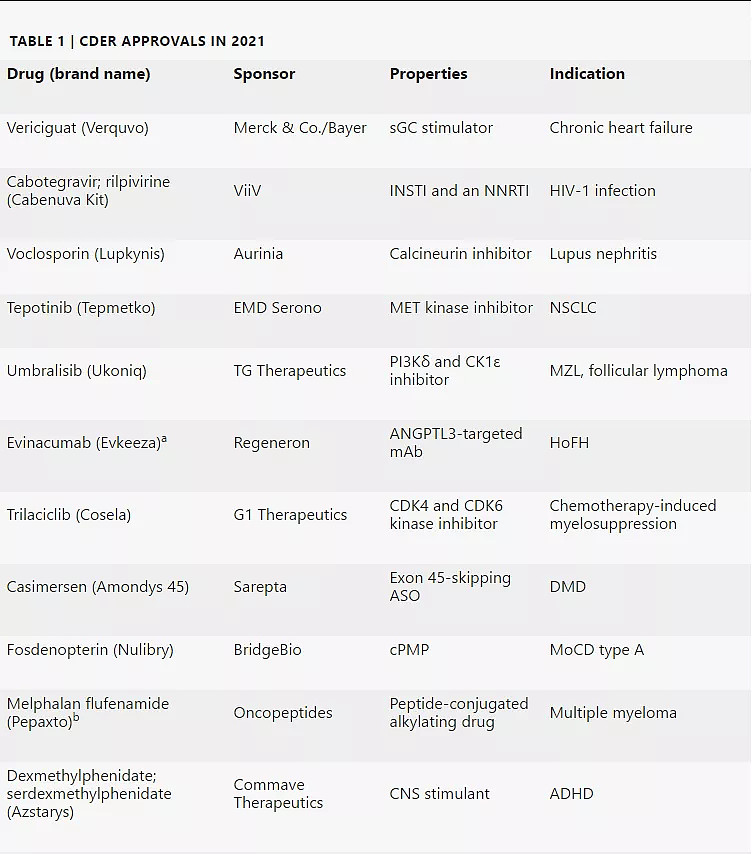
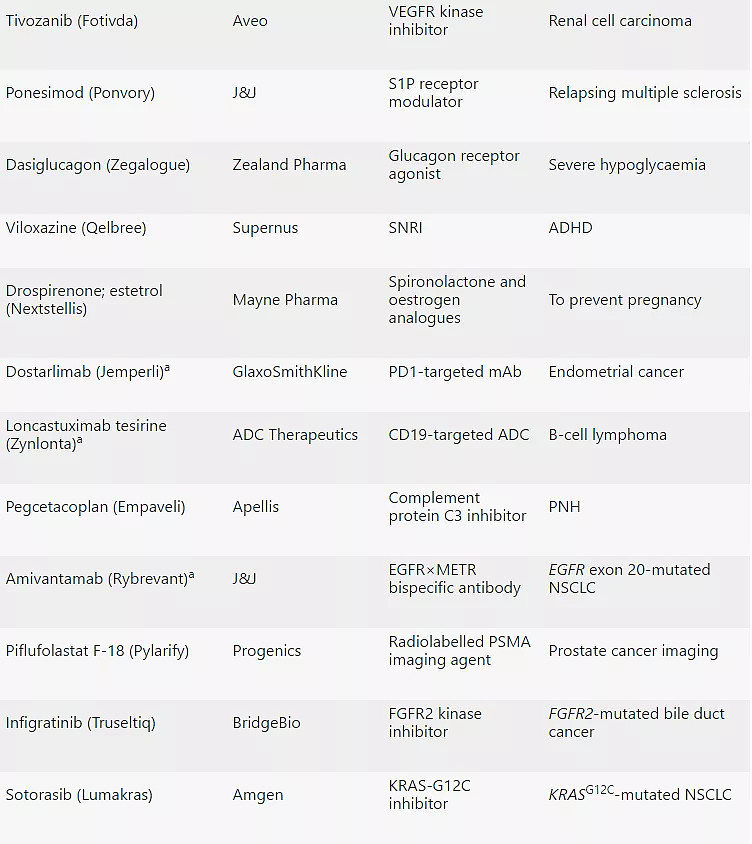

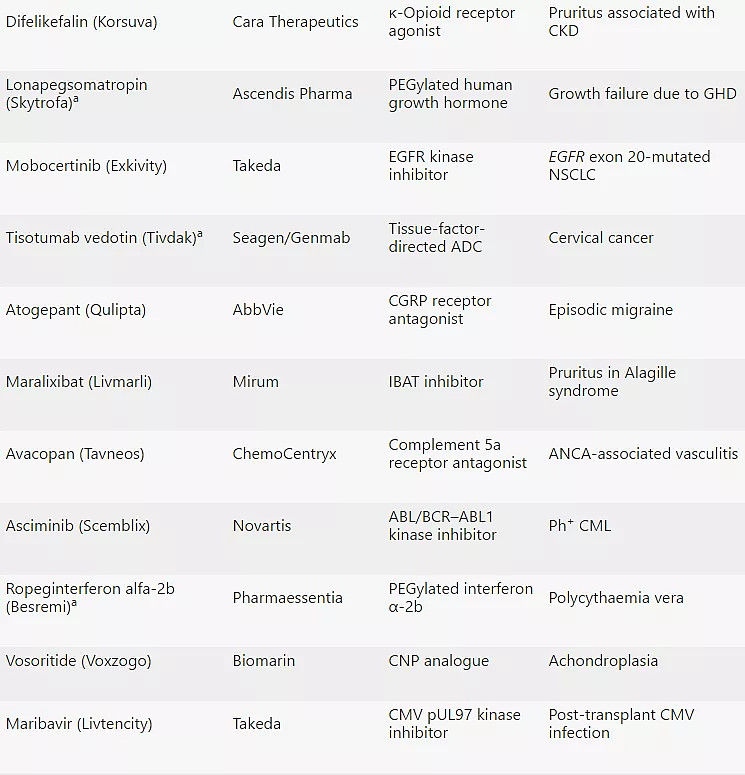
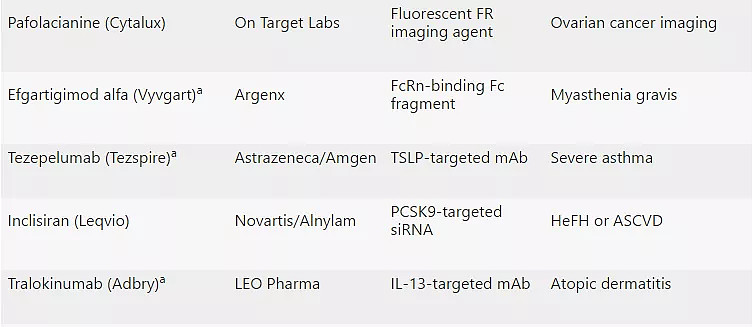
注:a:生物制品;b:撤市;
FDA生物制品评估和研究中心 (CBER) 还批准了具有里程碑意义的mRNA疫苗和CAR-T细胞产品,并授予治疗COVID-19的抗体和快速开发的口服抗病毒药物紧急使用授权 (EUA) 。不过,CBER批准和EUA未被包括在年度新药计数中。
2021年CBER批准的细胞疗法和疫苗

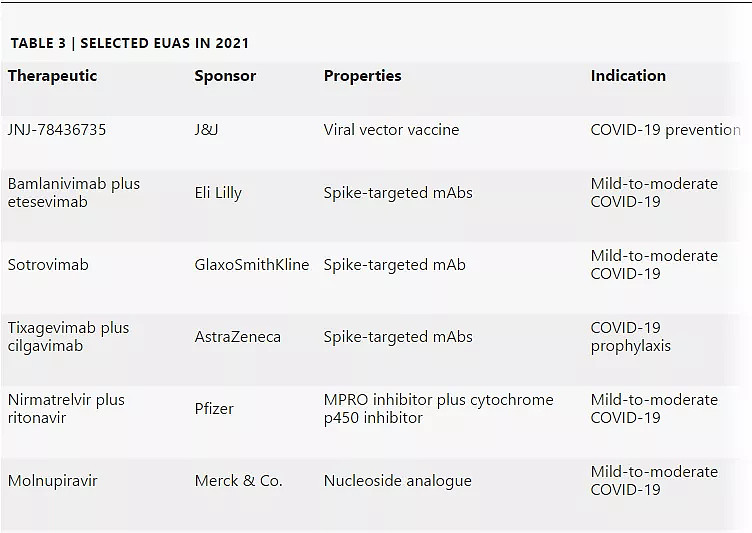
2021年FDA授予EUA的产品
2021年,抗癌药批准仍占主导地位,占获批新药数量的30%(15),抗癌药获批的5年平均占比为28%。神经科药物获得了第二多的批准,连续第三年有5个(10%)新药获批。传染病和心血管疾病新药并列第三,各有 4 (8%) 项批准。
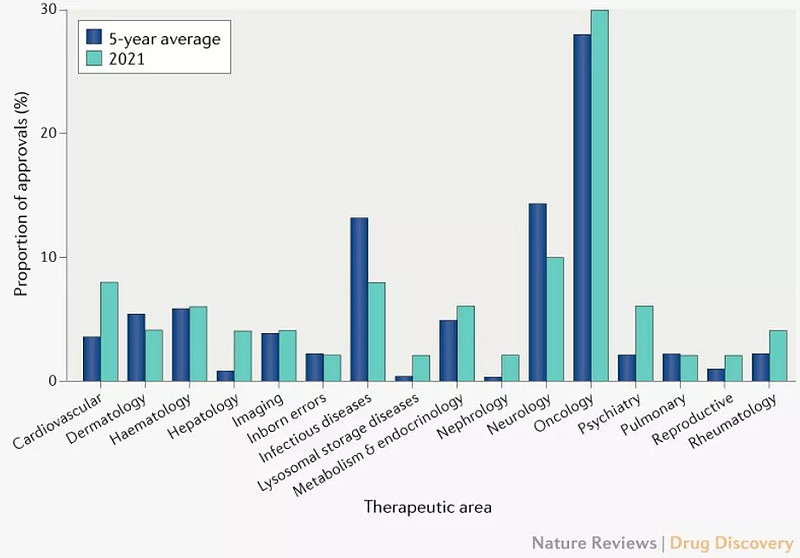
CDER批准新药所在领域
2021年CDER批准的新药中,包含第100个抗体、两款抗体-药物偶联物(ADC)、一款双特异性抗体、一款限制性肽(constrained peptide)和两款寡核苷酸药物。

CDER按药物类型的批准(“小分子”包括所有长达40个氨基酸的肽)
根据科睿唯安数据库,分析师预计CDER批准的新药中,仅有8款有潜力成为重磅炸弹。2027年,渤健(Biogen) 的aducanumab是其中唯一一个预计将突破20亿美元大关的药物,鉴于这款有争议的阿尔茨海默病药物面临的不利因素,这也是一个投机性赌注。
2021获批重磅炸弹2027年平均销售预测

注:a:2027年平均销售预测;b:2021年销售预测。c:2025年销售预测。
疫苗的胜利

CBER批准的疫苗是2021年“批准展”的明星。尤其是辉瑞/BioNTech的mRNA疫苗tozinameran (Comirnaty) ,开创了新的先例。
BioNTech于2020年1月开始研发这款COVID-19 mRNA疫苗,并于3月与辉瑞达成合作。II/III期试验于7月进行,12月便提供了EUA的安全性和有效性数据。在该计划启动仅1.5年后,于2021年8月获得FDA完全批准。一般而言,疫苗发现和开发的平均时间为10.7年。
Tozinameran也打破了商业记录。分析师预测,其2021年销售额将超过350亿美元,排名第二的将是艾伯维 (AbbVie)上市19年的TNF阻断剂阿达木单抗 (adalimumab) ,将超过210亿美元。此前上市最好的药物是吉利德的ledipasvir/sofosbuvir抗病毒组合,该组合上市的第一年就在丙肝市场赚了100多亿美元。
Moderna的elasomeran(Spikevax)在速度和盈利能力上都紧随其后。Spikevax同样于2020年12月获得EUA。预计将于2022年4月获得FDA的完全批准。分析师预测,2021年elasomeran销售额将超过170亿美元。其他有望在2022年获FDA批准的新药见下表:
2022年有望获FDA批准新药
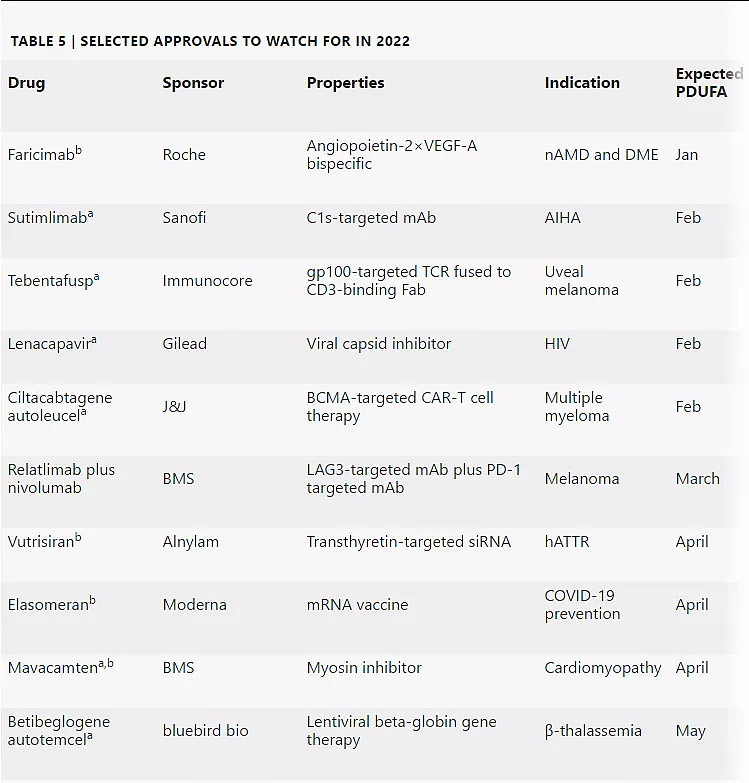
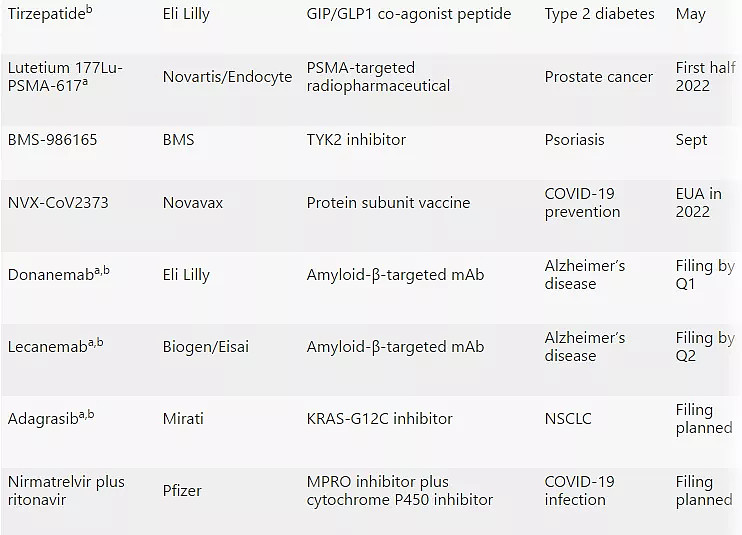
注:a:突破性疗法认定;b:根据Cortellis数据库预测,到2027年将达到惊人销售额
辉瑞的Prevnar 20是一款针对肺炎链球菌血清型的20价结合疫苗,预计到2027年销售额将达到44亿美元。Prevnar 20是Prevnar 13的下一代,Prevnar 13在tozinameran上市之前是全球最畅销的疫苗。
分析师还预测默沙东新获批的15价肺炎链球菌疫苗Vaxneuvance将会成为重磅炸弹。
癌症治疗新突破

安进公司KRAS-G12C抑制剂sotorasib的获批对癌症界来说是一个里程碑。
尽管sotorasib的疗效在KRAS-G12C突变NSCLC患者中得到认可,但还没有满足期望。Amgen正在评估sotorasib与其他药物联合治疗各种癌症的疗效。分析师预测,2027年该产品销售额将达到16亿美元。
其他靶向KRAS疗法正在研究中。Mirati预计其KRAS-G12C抑制剂adagasib将于2022年获得批准。
FDA批准了默沙东first-in-class缺氧诱导因子-2α (HIF-2α)抑制剂,用于治疗与VHL相关肿瘤,VHL是一种与血管浸润性肿瘤相关的遗传性疾病。对 VHL疾病生物学的数十年研究表明,HIF-2α是氧感应的关键驱动因素——为新型抗血管生成药物铺平了道路,Dana-Farber癌症研究所的William Kaelin等人因此而获得了诺贝尔奖。
BMS的idecabtagene viceucel获批用于多发性骨髓瘤,肿瘤医师因此而获得了首款靶向BCMA的CAR-T细胞疗法。FDA批准的其他5款CAR-T细胞疗法均靶向CD19。BCMA在B细胞表面表达,已成为抗体、双特异性药物、ADC和细胞疗法的试验场。
强生靶向BCMA的CAR-T疗法ciltacabtagene autoleucel正在接受FDA审查。
葛兰素史克PD1单抗dostarlimabshi FDA批准的第100个抗体药物。35年前,FDA于1986年批准了首款抗体。如今,FDA每年批准大约10款基于抗体的产品。
Dostarlimab是FDA批准的第7款PD1/ PDL1单抗,尽管分析师预测默沙东的帕博利珠单抗到2027年的销售额将超过300亿美元,但他们预计dostarlimumab到2025年的销售额仅为2.7亿美元。
另外4款PD1/PDL1抗体有望在2022年获FDA批准。FDA的Julia Beaver和Richard Pazdur最近写道,检查点抑制剂已经成为药物开发的蛮荒之地,其标志是“商业赞助商、临床试验和重复开发计划的蜂拥而来”。他们敦促药物开发人员更好地合作。
BMS提交了首个针对LAG 3的检查点抑制剂relatlimab的BLA申请,FDA将于2022年做出审批决定。
2021年,FDA批准了两款ADC。ADC Therapeutics的loncastuximab tesirine是一款靶向CD19的ADC,用于治疗B细胞淋巴瘤。Seagen/Genmab的tisotumab vedotin是一款靶向组织因子的宫颈癌ADC。FDA目前批准ADC 的数量达到了11个,在过去3年批准了其中的7个。阿斯利康于2019年获得FDA 批准的靶向HER2的ADC trastuzumab deruxtecan(DS-8201)的临床数据表明,与抗体和之前批准的ADC相比,新型ADC具有更好的疗效。
强生获批新药amivantamab是一款靶向EGFR和MET的双特异性抗体,用于 EGFR exon 20突变的NSCLC,这一类型癌症对小分子EGFR抑制剂具有耐药性。Amivantamab是第3款上市的双抗,双抗目前占临床阶段抗体管线的近20%。
FDA还批准了武田的小分子激酶抑制剂mobocertinib,被设计能够选择性靶向exon 20突变的EGFR。
阿尔茨海默病新药引起的争议

FDA批准Biogen和卫材的靶向β-淀粉样蛋白抗体aducanumab是今年最具争议的审批决定。
2021年6月7日美国FDA不顾专家委员会的反对意见,基于临床替代终点(患者大脑中淀粉样蛋白斑块的水平)毅然批准aducanumab上市。FDA要求Biogen在2030年之前确认该抗体的临床疗效。
分析师仍预计Biogen到2027年的销售额将达到41亿美元。但是销售开始放缓,美国的一些治疗中心拒绝对这一药物开具处方。Biogen最初将aducanumab定价为每年5.6万美元,但后来减半。欧洲监管机构拒绝批准该抗体,日本监管机构似乎也将拒绝。该产品的商业成功将取决于美国65岁及以上人群的国家医疗保险计划(Medicare)是否覆盖该产品。决定草案将于明年1月出炉。
2022年还会有两款抗淀粉样蛋白抗体问世。Biogen和合作伙伴卫材已通过加速批准通道向FDA滚动提交了抗淀粉样蛋白β (Aβ)原纤维抗体lecanemab (BAN2401)的BLA申请。礼来也正在完成donanemab的提交,并希望在2023年获得确证性试验证据。
其他重大获批事件

随着诺华/Alnylam的inclisiran获得批准,第4款基于SiRNA的药物已经问市。这款药物利用RNA干扰来减少靶标的表达。
Inclisiran通过抑制PCSK9以降低低密度脂蛋白胆固醇。FDA于2015年批准了两款靶向PCSK9的抗体——再生元/赛诺菲的alirocumab和安进的 evolocumab——用于心血管疾病风险增加的患者亚群,但这两款产品尚未达到重磅炸弹的销售预期。Inclisiran的用药的便利性可能有助于它具有更好的市场表现。单抗类每2-4 周给药一次,而inclisiran仅需每年给药两次。
如果FDA在2022年批准Anlyam的vutrisiran,这将是多年来RNAi的第5项批准。
凭借first in class ANGPTL3单抗evinacumab,再生元在心血管领域再创第一。再生元于2017年在动脉粥样硬化性心血管疾病中对该靶点进行了基因验证。evinacumab目前已获批治疗纯合子家族性高胆固醇血症 (HoFH) ,HoFH是一种以极高水平LDL胆固醇为特征的遗传性疾病。evinacumab预防急性胰腺炎的III期试验正在进行中。
AstraZeneca/Amgen的tezepelumab是一款治疗重度哮喘的first in class TSLP单抗。TSLP是一种IL-7样细胞因子,可调节多种炎症级联反应,并可引发与肺部疾病相关的过敏性、嗜酸性粒细胞和其他形式的炎症。Tezepelumab是唯一被批准用于治疗重度哮喘的生物制剂,其标签上没有任何表型或生物标志物限制。分析师预测,到2027年tezepelumab的销售额将达到14亿美元。
阿斯利康的anfrolumab是10年来首个获批治疗系统性红斑狼疮(SLE)的新药。许多SLE患者I型干扰素水平升高,Anifrolumab通过与I型干扰素受体结合来阻断这些细胞因子的活性。
Apellis的pegcetacoplan是首个获得批准的补体蛋白C3抑制剂,pegcetacoplan是一种合成的限制性环肽,用于阵发性夜间血红蛋白尿症,这是一种罕见且可能致命的血液疾病。
ChemoCentryx的avacopan于2021年获FDA批准用于ANCA相关血管炎,是首个获得批准的补体5a受体拮抗剂。
尽管COVID-19 疫苗、抗体和抗病毒药物的批准,证实了药品开发商在压力下的快速行动速度。但武田的maribavir提供了一个反例。该抗病毒药物的 I 期数据于1996年首次公布。从经历取消优先资格、对外转让、失败的III期试验以及两次公司收购中幸存下来后,这款抗病毒药物终于在今年被批准用于治疗巨细胞病毒 (CMV) 感染。
首次递交遭到FDA拒绝批准的新药

FDA去年也拒绝了多项上市申请。其中一些可能很快就会重新提交给FDA审查。例如,Provention Bio正在努力重新提交其CD3单抗teplizumab,用于延迟高危人群的1型糖尿病。Teplizumab于1997年首次用于移植排斥的临床试验,并引领了一系列针对自身免疫性疾病的T细胞调节疗法。
上市申请首次遭FDA拒绝的新药
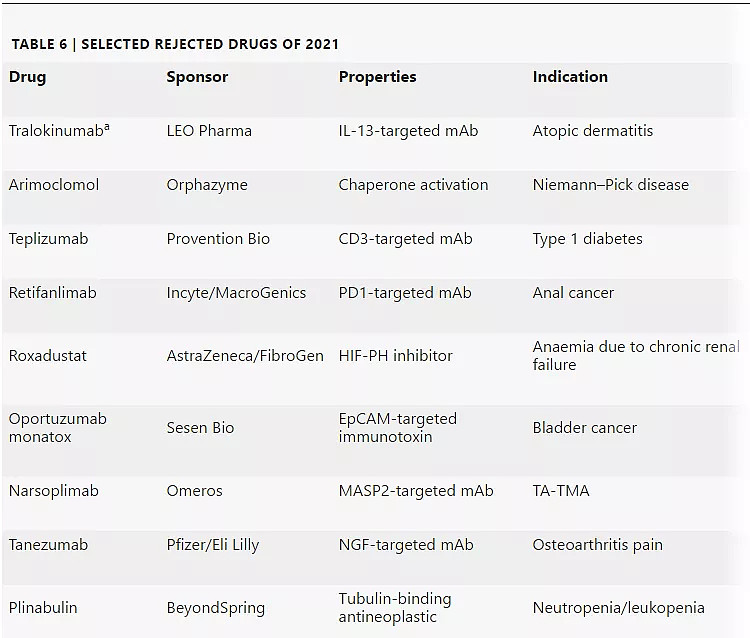
a:2021年年底获批
有些被FDA拒绝的新药已经终止开发。在FDA发布了tanezumab用于治疗骨关节炎疼痛的完整回复函后,辉瑞/礼来终止了这款靶向NGF单抗的开发。在III期研究数据显示这些止痛药可能导致关节破坏后,FDA曾在2010年将一度有希望的抗NGF类药物搁置临床。