基于医药魔方网站行业快讯板块、NextPharma数据库以及公开信息,2021年6月的《临床研究月报》共筛选出10项值得关注的未达临床主要终点的研究,供您参考。
1. Venglustat治疗常染色体显性多囊肾病的II/III期研究
6月1日,赛诺菲更新Venglustat临床研究计划,称Venglustat治疗常染色体显性多囊肾病(ADPKD)的关键II/III期研究未达到目标(futility criteria),将停止ADPKD临床研究。
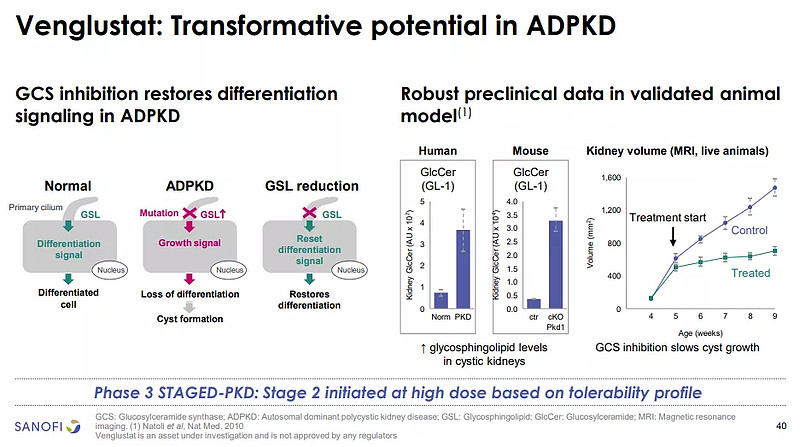
Venglustat治疗ADPKD的潜在机制(来源:赛诺菲)
鞘糖脂(GSL)的异常积累与几种罕见疾病有关,导致细胞功能障碍和疾病进展。Venglustat是一种新型的口服研究性疗法,可能通过抑制异常GSL积累来减缓某些疾病的进展。迄今为止,所有的500多名患者在长达4年的时间内接受了治疗,对Venglustat试验组与安慰剂组患者的总肾体积(TKV) 年变化率进行独立分析后,STAGED-PKD 研究因无效而停止。venglustat 的安全性与之前报告的结果一致。该中期分析也表明,GSL的减少可能不会在预防肾囊肿生长方面发挥重要作用,因此,可能不是与ADPKD进展相关的主要途径。
常染色体显性多囊肾病(ADPKD)是最常见的遗传性肾病,临床特点为肾囊肿进行性扩大。肾囊肿的体积大小和数量随着个体年龄增加而缓慢增加,严重干扰肾脏过滤血液的能力。约45%-70%的ADPKD患者在65岁前进展至终末期肾病(ESRD),甚至导致肾衰竭。除了肾囊肿,囊肿也可能在其他器官发展,特别是肝脏。
2. VX-864治疗胰蛋白酶缺乏症的II期研究
6月10日,Vertex宣布其候选产品VX-864在PiZZ基因型α-1抗胰蛋白酶缺乏症(AATD)患者中开展的II期概念验证研究达到主要终点,虽然提供了作用机制验证(proof-of-mechanism),但是在研究中观察到的治疗效果不太可能转化为实质性的临床效益。因此,表示将停止VX-864后期研发。
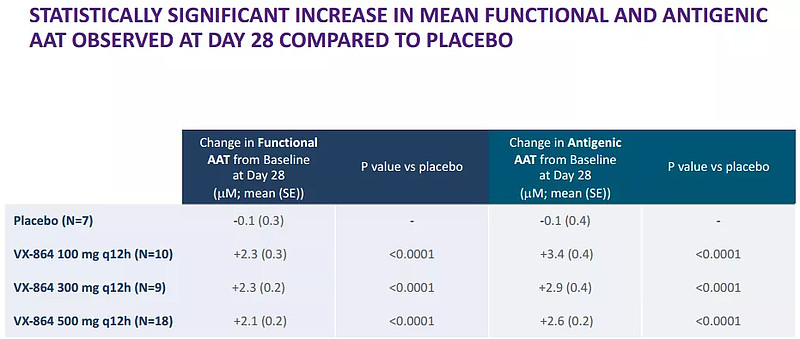
VX-864临床研究关键结果(来源:Vertex)
AATD是一种罕见的遗传性疾病,由编码AAT蛋白的SERPINA1基因改变引起。病理现象包括血液和肺部的α1-胰蛋白酶降低,以及肝细胞中(生成AAT蛋白主要场所)非正常α1-胰蛋白酶的过度累积。血液中AAT蛋白水平的降低可导致不受控制的炎症发展,并损害肺部;肝脏中缺陷AAT的积累也会导致肝脏疾病。PiZZ基因型患者SERPINA1基因突变是AATD最常见类型,目前还没有针对导致该疾病的潜在疗法,也没有治愈的手段。
这也不是Vertex在该领域的首次折戟。去年10月,Vertex就曾因安全性问题终止了VX-814针对AATD的临床研究。AATD患者接受VX-814治疗时,部分患者的肝酶(AST/ALT)异常升高,甚至高达正常上限的8倍以上。
反观VX-864,耐受性普遍良好,肝功能测试(LFT)结果与安慰剂组相似,仅1名受试者未完成治疗;未发生因不良事件而停药或治疗相关严重不良事件,大多数不良事件为轻中度,最常见不良事件为腹泻和恶心。
3. BIIB111治疗无脉络膜症的III期研究
6月14日,渤健(Biogen)宣布,基因疗法Timrepigene emparvovec(BIIB111/AAV2-REP1)治疗无脉络膜症的III期研究(STAR)未达到主要或关键次要终点。这是继5月14日,cotoretigenetoliparvovec(BIIB112)治疗x-连锁视网膜色素变性(XLRP)未达到研究主要终点后,渤健在两个月内第二项失败的基因疗法。并且,这两款药物均是渤健以8.77亿美元收购的Nightstar Therapeutics公司产品,也预示渤健目前在眼科领域的两款基因治疗产品全部以失败告终。
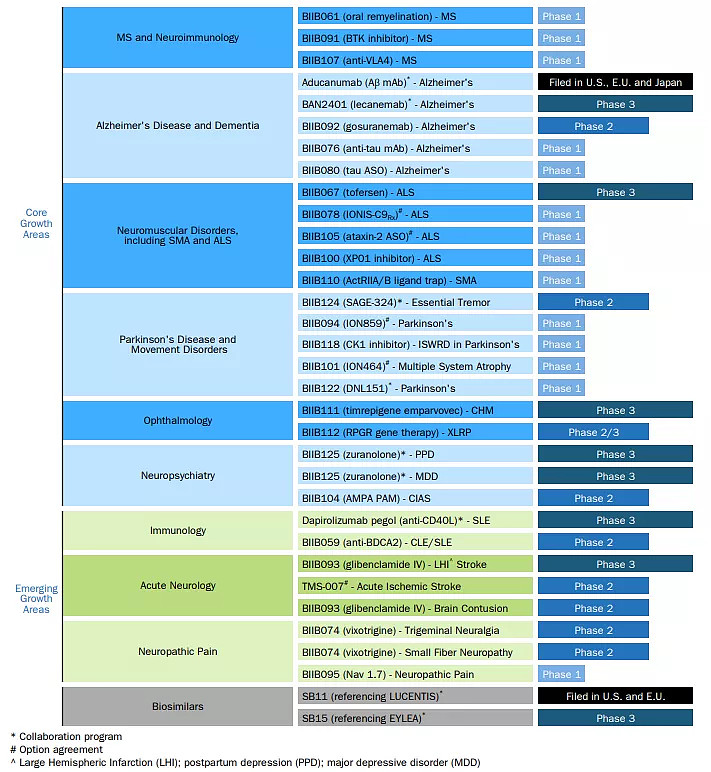
Biogen产品管线(来源:Biogen)
无脉络膜症(CHM)是一种罕见的X连锁隐性遗传视网膜眼病,以进行性光感受器细胞、视网膜色素上皮及脉络膜毛细血管萎缩为特征,可导致进行性视力丧失,最终导致失明。通常认为,是由于基因功能缺失突变导致 Rab护送蛋白-1(REP-1)表达降低,从而导致视网膜色素上皮、光感受器和脉络膜退化。2018年,FDA曾授予NSR-REP1(BIIB111)无脉络膜症“再生医药先进疗法”(RMAT)认定,成为首个针对遗传性眼病获得RMAT认定的基因疗法。
4. AZD7442预防COVID-19暴露的III期研究
6月15日,阿斯利康宣布了AZD7442在既往接触过SARS-CoV-2病毒的受试者中预防症状性COVID-19的安全性和有效性研究(STORM CHASER)结果。与安慰剂相比,AZD7442 未达到对COVID-19暴露后预防的主要终点。
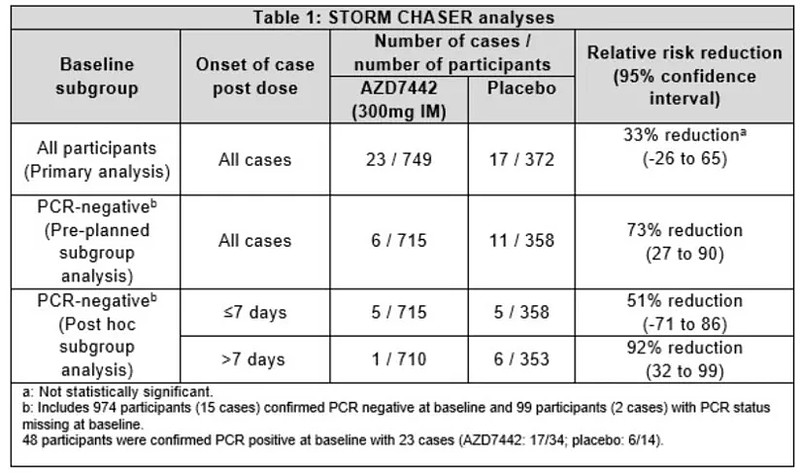
STORM CHASER研究的有效性数据(来源:AZ)
AZD7442是tixagevimab (AZD8895)和cilgavimab(AZD1061)两种 LAAB 的组合物,由范德比尔特大学医学中心发现并于2020年6月授权给阿斯利康。抗体可以与 SARS-CoV-2 刺突蛋白上的不同位点结合,阿斯利康进行了优化以延长半衰期并减少 Fc 受体结合。
5. BIIB092治疗阿尔茨海默病(AD)的II期研究
6月16日,Biogen宣布靶向Tau蛋白单抗gosuranemab(BIIB092)治疗阿尔茨海默病(AD)的II期TANGO研究失败。与安慰剂组相比,轻度认知障碍(MCI)患者接受BIIB092治疗的第78周,临床痴呆评分总和(CDR-SB)较基线的变化值无显著差异,未达到主要终点。不过,此时的Biogen仍沉浸在阿杜卡尼单抗(aducanumab)获批AD适应症阿尔茨海默病的喜悦之中,股价也未发生较大波动,收盘跌幅低于2%。

BIIB092是一种靶向tau蛋白N-末端的单抗,与先前研究一致,脑脊液(CSF)中N端tau蛋白的降低证实了BIIB092与tau蛋白的结合。然而,在TANGO研究中,在第78周时,BIIB092任何剂量组的tau-PET(正电子扫描)成像结果在试验组和对照组之间均无统计学意义。
此外,探索性疗效终点包括ADAS-Cog13(认知分量表)、ADCS-ADL(日常生活活动量表)、MMSE(简易精神状态检查表)和FAQ(功能评估问卷)等均未见显著差异。BIIB092总体耐受性良好,安全性结果与既往一致。Biogen将在即将举行的医学大会上展示TANGO研究结果。
基于上述结果,Biogen已终止TANGO研究,并将停止BIIB092的临床开发。
6. CVnCoV预防COVID-19暴露的IIb/III期研究
6月16日,CureVac公布其新冠mRNA疫苗的IIb/III期临床最新数据。CVnCoV保护率仅47%,未达到预设的统计学显著界值。受此消息影响,CureVac股价当天跌幅接近40%,几乎腰斩。这也令等待无需超低温就能相对长期冷藏保存的mRNA疫苗的国家,特别是中低收入国家的希望落空。
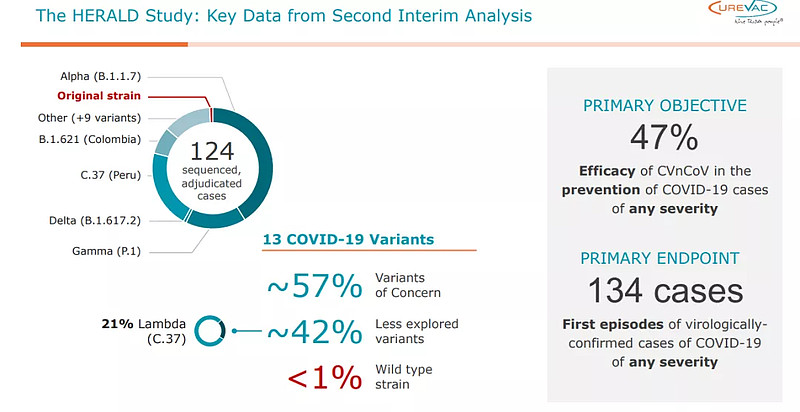
HERALD研究二次期中分析的关键数据(来源:CureVac)
CureVac于2020年1月开始开发基于mRNA的 COVID-19候选疫苗,CVnCoV 是一种优化的、非化学修饰的mRNA,编码 SARS-的融合前稳定的全长刺突蛋白。HERALD研究是一项在10个国家、至少存在29种COVID-19变异株人群中开展的关键研究。数据显示,CVnCoV在所有测试剂量中普遍具有良好的耐受性,除了T细胞激活的第一个迹象外,还诱导了强烈的抗体反应。
7. Nezulcitinib治疗急性肺损伤的II期研究
6月21日,TheravanceBiopharma宣布了Nezulcitinib治疗确诊COVID-19患者急性肺损伤的II期临床研究的顶线结果,在意向治疗人群(ITT)中,未达到从随机化到第28天无呼吸衰竭天数(RFD)的显著性差异,错失研究主要终点。
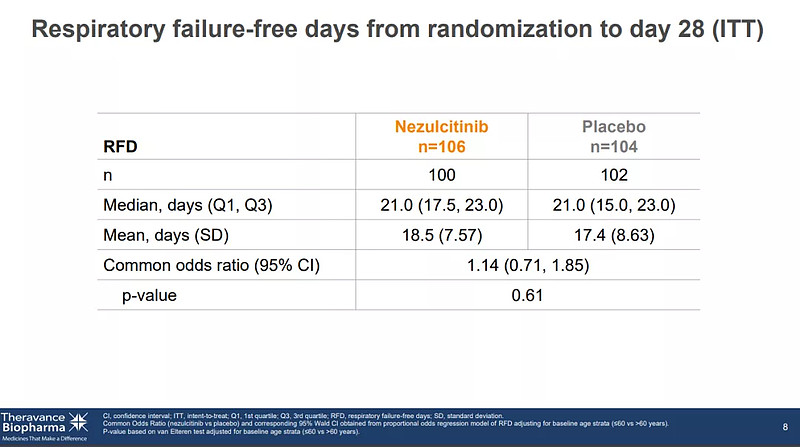
Nezulcitinib临床研究主要终点数据(来源:Theravance Biopharma)
Nezulcitinib是一种在研的吸入性、肺选择性、泛Janus激酶(JAK)抑制剂,是Theravance为应对COVID-19全球大流行,决定从临床前加速推进至临床研究的一款药物。在15个月内,Nezulcitinib完成了健康志愿者中的Ⅰ期试验、Ⅱ期剂量探索试验,并完成涉及200多名COVID-19重症患者的随机、双盲、安慰剂对照的多中心II期研究。
尽管该研究没有达到主要终点,但数据分析显示,Nezulcitinib耐受性良好,血浆暴露量低;在意向治疗人群(ITT)的28天全因死亡率呈现获益趋势;此外,事后分析显示,在基线C反应蛋白 (CRP)水平<150 mg/L 的治疗组中,患者死亡率和恢复时间也呈现出一定的获益趋势。
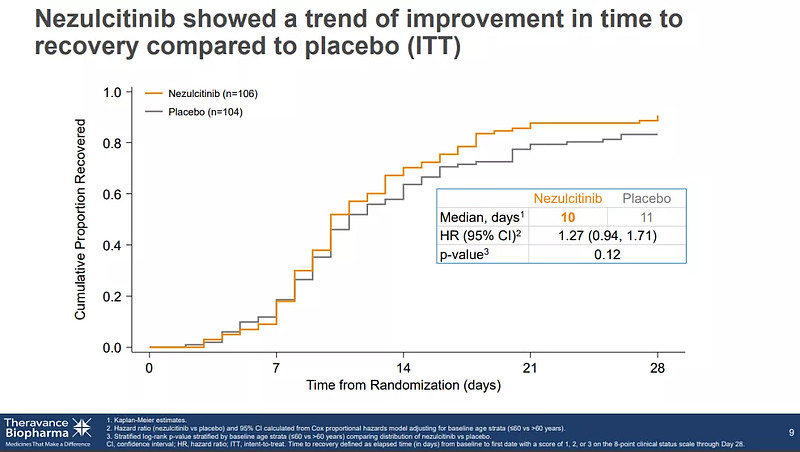
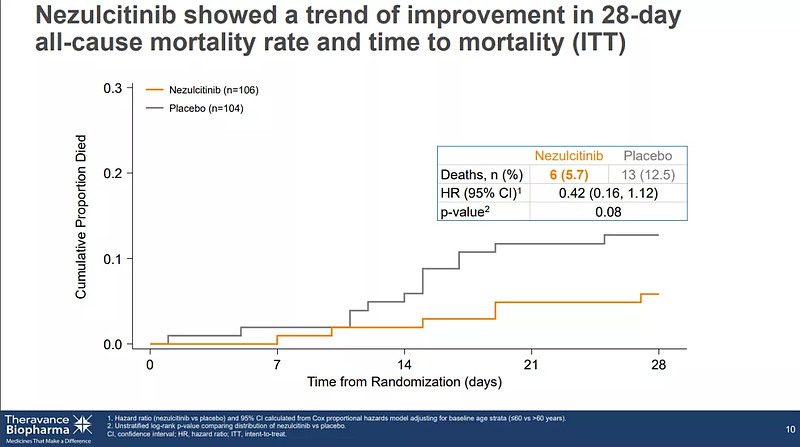
Nezulcitinib疗效数据(来源:Theravance)
8. Lenabasum治疗皮肌炎的III期研究
7月24日,Corbus Pharmaceuticals公布了Lenabasum在患有罕见、异质性、自身免疫性疾病皮肌炎成人患者中开展的III期研究(DETERMINE)顶线结果。数据显示,在第28周,lenabasum(20 mg,BID)组的平均总改善评分(TIS)为28.3,而对照组的平均TIS为26.7(p=0.1965),未达到主要终点。
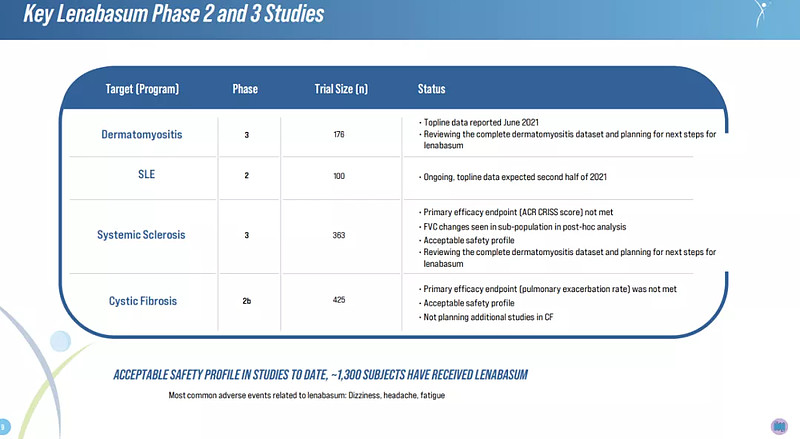
Lenabasum主要临床在研适应症(来源:Corbus)
Lenabasum是一种新型口服小分子,结合并激活在免疫细胞上优先表达的2型大麻素受体(CB2),以解决炎症并限制纤维化。除皮肌炎适应症外,Lenabasum还在评估治疗系统性红斑狼疮、硬化症和囊性纤维化等疾病的临床有效性和安全性。
9. Losmapimod治疗面肩肱型肌营养不良的IIb期研究
6月24日,Fulcrum Therapeutics公布了Losmapimod治疗面肩肱型肌营养不良症 (FSHD)患者的临床IIb期研究(ReDUX4)结果,与中期分析一致,未达到DUX4 驱动基因表达变化的主要终点。

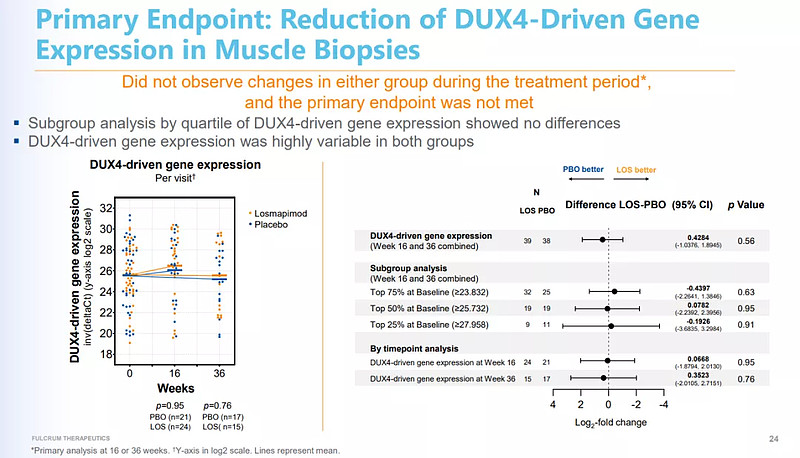
ReDUX4研究的主要终点选择及关键结果(来源:FulcrumTherapeutics)
ReDUX4 是一项随机、双盲、安慰剂对照的国际多中心IIb期临床试验,共招募80名FSHD 患者,旨在评估口服 Losmapimod(15 mg, BID)的有效性和安全性。虽然未达到主要终点,不过,与安慰剂相比,在结构性和功能性FSHD疾病进展和48周患者报告结果等多项指标上,Losmapimod表现出临床和统计学意义的益处。
2021年5月,Losmapimod治疗FSHD曾获得FDA授予的快速通道认定。据悉,Fulcrum计划下半年与FDA等监管机构会面,以确定losmapimod的监管路径。
10. Balixafortide治疗乳腺癌的III期研究
6月28日,PolyphorAG宣布Balixafortide (POL6326)与艾日布林联合治疗 HER2 阴性、局部复发或转移性乳腺癌的全球 III 期研究(FORTRESS),未达到共同主要终点。董事会正在进行战略评估,将考虑有关公司未来的全方位选择。据悉,复星医药曾以1,500万美元首付款获得该药物治疗转移性乳腺癌的中国临床开发及商业化独家权利。
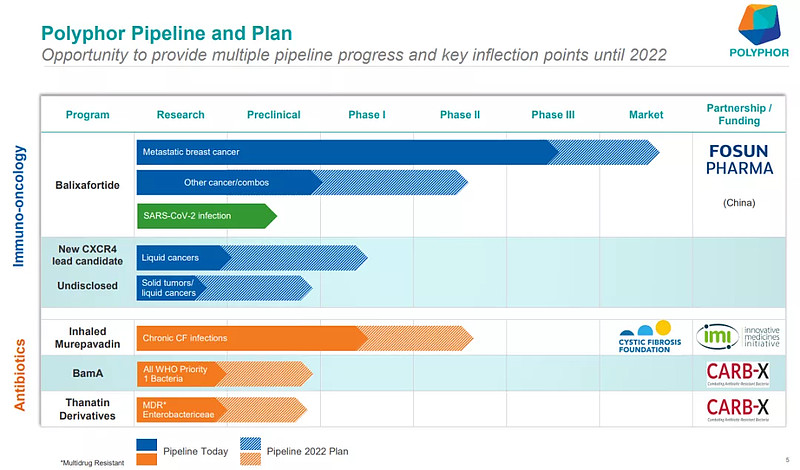
Polyphor产品管线(来源:Polyphor AG)
Balixafortide是基于Polyphor AG大环技术平台开发的一种高效和高选择性CXCR4 抑制剂。CXCR4属于G偶联蛋白受体(GPCR)跨膜受体,在多种癌症和肿瘤微环境免疫细胞中均有表达。
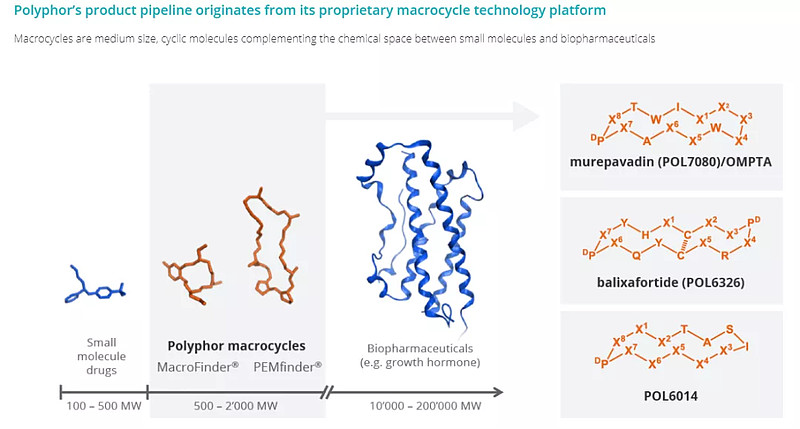
Polyphor 大环技术平台(来源:Polyphor AG)
FORTRESS研究(POL6326-009)是一项随机、开放标签、阳性对照、国际多中心的III期研究,旨在评估静脉注射balixafortide联用艾日布林对比艾日布林单药治疗HER2 阴性的局部复发性或转移性乳腺癌的疗效、安全性和耐受性。研究共招募432例HER2阴性MBC患者,分析显示,在三线及以上人群(n=330)中,与艾日布林单药治疗相比,balixafortide联合艾日布林治疗的客观缓解率(ORR)没有改善(13.0% vs 13.7%;p=1.00)。
参考资料:
1.网页链接
2.网页链接
3.网页链接
4.网页链接
5.网页链接
6.网页链接
7.网页链接
8.网页链接
9.网页链接
10.网页链接
