基于医药魔方NexntPharma、NextMed数据库以及公开信息,2020年9月的《临床研究月报》共筛选出10项值得关注的临床研究,包括5项获得阳性积极结果的临床研究,5项获得阴性失利结果的临床研究,供您参考。
注:9月份CSCO/ESMO大会上的多项重磅临床数据未一一列举,可参见医药魔方Med公众号此前报道。
成功的临床研究
1. BIO89-100治疗非酒精性脂肪性肝炎Ib/IIa期研究
9月14日,89bio公司宣布其FGF21类似物BIO89-100在非酒精性脂肪性肝炎(NASH)患者中的Ib/IIa期研究中取得阳性结果。
BIO89-100是89bio使用专有的糖聚乙二醇化技术开发用于治疗NASH的FGF21糖聚乙二醇化类似物。Ib/IIa期期数据显示,每周或每两周1次给药,BIO89-100表现出良好的安全性和耐受性特征,并且肝脂肪和关键脂质标记物明显降低。磁共振成像-质子密度脂肪含量(MRI-PDFF)测定,所有剂量组在第13周均显示肝脂肪显着减少,相对于基线,相对减少高达60%,相对于安慰剂,相对减少高达70%。相当大比例的受试者对治疗有反应,与基线相比,分别有高达88%和71%的受试者肝脏脂肪减少≥30%或≥50%。MRI-PDFF详细结果如下:
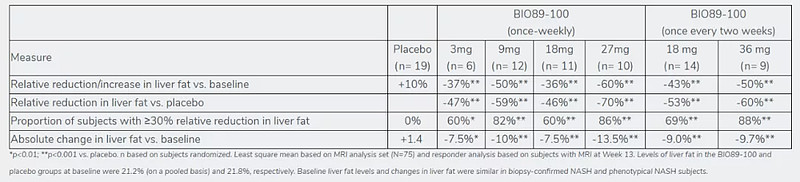
来源:89bio 官网
BIO89-100具有良好的安全性和耐受性,无死亡或与治疗相关的严重不良事件。发生率≥5%的胃肠道事件包括腹泻(BIO89-100 vs 安慰剂: 12.7% vs 22.2%)和恶心(BIO89-100 vs 安慰剂:7.9% vs 16.7%),较安慰剂更低。发生率≥10%的治疗相关不良事件是轻微的食欲增加(15.9%),与其他研究性FGF21类似物一致,没有观察到对心率或血压的不利影响。
2. 奥拉帕利 vs 恩扎鲁胺或阿比特龙治疗转移去势抵抗前列腺癌的III期PROfound研究
9月20日,阿斯利康和默沙东宣布了III期PROfound研究的最终结果,显示在已经接受恩杂鲁胺和/或阿比特龙治疗的具有BRCA1/2或ATM基因突变的转移性去势抵抗性前列腺癌(mCRPC)男性患者中,奥拉帕利与恩扎鲁胺或阿比特龙相比在延长总生存期(OS)上具有统计学意义和临床意义的改善(19.1 vs 14.7个月),可使死亡风险降低31%(HR=0.69,95%CI: 0.50~0.97,p = 0.0175 )。
最常见(≥15%)的不良反应是贫血(50%)、恶心(43%)、疲劳/乏力(42%)、食欲下降(31%)、腹泻(21%)、呕吐(20%)和便秘(19%)。3级或以上的ARs为贫血(23%)、恶心(2%)、疲劳或乏力(3%)、食欲下降(2%)和腹泻(1%)。有20%的患者因ARs而终止治疗,而23%的患者因ARs降低了剂量。
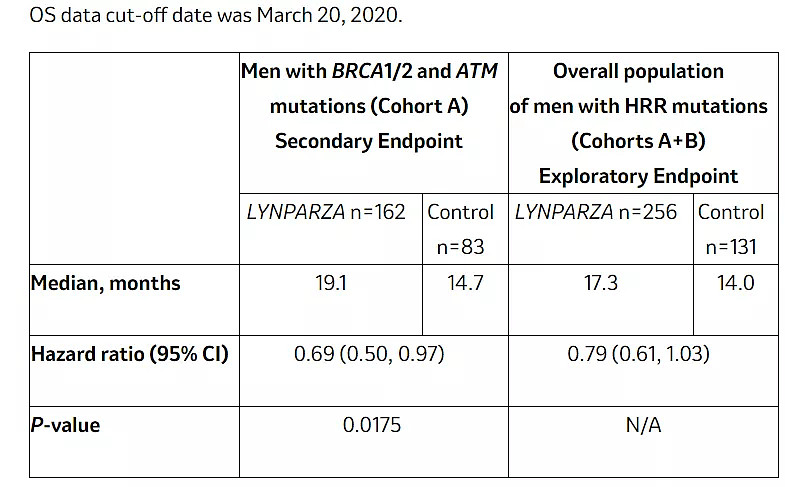
来源:公司官网
前列腺癌是男性中第二大最常见的癌症类型,2018年全球诊断出约130万新患者。大约20%至30%的mCRPC男性具有同源重组修复(HRR)基因突变,其中BRCA1/2 ATM突变是一个亚群。这项试验证明,奥拉帕利是目前唯一一种与恩杂鲁胺或阿比特龙相比具有总生存率优势的PARP抑制剂。
3. 信迪利单抗+贝伐珠单抗类似药一线治疗晚期肝癌ORIENT-32研究
9月28日,信达生物宣布达伯舒(信迪利单抗注射液)联合达攸同(贝伐珠单抗生物类似物)对比索拉非尼在一线治疗晚期肝癌的III期ORIENT-32研究中显著延长PFS和OS,达到预设优效性标准,安全性数据与既往达伯舒(信迪利单抗注射液)联合达攸同(贝伐珠单抗生物类似物)的研究结果一致,相关研究结果将在近期学术会议上公布。
信达生物近期将向国家药品监督管理局提交达伯舒(信迪利单抗注射液)联合达攸同(贝伐珠单抗生物类似物)用于晚期肝癌一线治疗的新适应症申请。
信迪利单抗注射液是一种人类免疫球蛋白G4(IgG4)单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的PD -1/PD-L1通路,重新启动T细胞杀死肿瘤细胞。2018年12月24日,信迪利单抗获批用于治疗至少经过二线系统化疗的复发/难治性经典型霍奇金淋巴瘤。
4. risdiplam治疗婴儿1型脊髓性肌萎缩症最新2年数据
9月28日,罗氏公布了Evrysdi(risdiplam)治疗2-7个月婴儿1型脊髓性肌萎缩症(SMA)的FIREFISH研究最新2年数据。探索性分析表明,在接受治疗两年之后,有88%的婴儿活着,并且不需要接受永久通气。此外,59%(10/17)的婴儿能够在没有支撑的情况下坐起来至少5秒钟,与接受治疗1年后(7/17)相比这一比例有所提高。
在两年内存活的婴儿中(n=14),100%保持吞咽能力,93%(13/14)能够口服喂养。FIREFISH研究中Evrysdi的安全性与其先前报道的安全性一致,未发现新的安全性信号。最常见的不良事件(n=21)包括发烧(发热,71%)、上呼吸道感染(52%)、咳嗽(33%)、呕吐(33%)、腹泻(29%)和呼吸道感染( 29%)。在24%的婴儿中发生的最严重的不良事件是肺炎。
2020年8月,FDA批准Evrysdi用于治疗2个月以上的成人和儿童的SMA,也是FDA批准治疗该症的首个口服小分子药物。SMA是由于SMN1基因突变导致SMN蛋白缺乏所致,属于一种严重的、进行性、可能致命的神经肌肉疾病,影响大约万分之一的婴儿,是婴儿死亡的主要遗传原因。
5. 特瑞普利单抗+化疗治疗复发或转移性鼻咽癌JUPITER-02研究
9月28日,君实生物宣布了特瑞普利单抗联合化疗治疗复发性或转移性鼻咽癌的随机、双盲、安慰剂对照、国际多中心的III期临床研究(JUPITER-02研究)的期中分析结果。由独立数据监督委员会(IDMC)判定研究达到预定的主要研究终点,研究结果表明,特瑞普利单抗注射液联合吉西他滨/顺铂一线治疗复发性或转移性鼻咽癌患者,较吉西他滨/顺铂的标准一线治疗,可显著延长患者的无进展生存期。
特瑞普利单抗注射液是君实开发的中国首个批准上市国产PD-1单抗药物,于2018年12月获得国家药监局有条件批准上市,用于治疗治疗既往标准治疗失败后的局部进展或转移性黑色素瘤;2020年4月和5月,君实生物向国家药品监督管理局分别提交特瑞普利单抗注射液治疗既往接受过二线及以上系统治疗失败的复发/转移鼻喉癌和既往接受过系统治疗的局部进展或转移性尿路上皮癌的新适应症并获受理;2020年9月,特瑞普利单抗注射液用于治疗鼻咽癌获得美国食品药品监督管理局突破性疗法认定,并将于近期向中国国家药品监督管理局提交一线治疗复发性或转移性鼻咽癌上市申请。
失败的临床研究
1. STS101紧急治疗偏头痛的III期EMERGE研究
9月10日,Satsuma宣布了其STS101(鼻用二氢麦角胺(DHE))作为紧急治疗偏头痛的III期EMERGE研究的主要结果,显示STS101和安慰剂在主要终点上的未显示出统计学差显著差异。
尽管顶线数据显示,在服用后两小时的无疼痛和无严重症状的预先指定的共同主要终点上,STS101(3.9 mg和5.2 mg)与安慰剂存在数值差异,但这些差异并未达到统计学上的显著性。不过,STS101的两种剂量强度的确在给药后三个小时及以后的时间点对减轻疼痛和最令人不适的症状显示出显著效果。在EMERGE试验中,两种STS101剂量强度均具有良好的耐受性,不良事件发生率低,且未报告严重不良事件。
2. 伊沙佐米治疗新诊断多发性骨髓瘤III期TOURMALINE-MM2研究
9月10日,武田宣布伊沙佐米(ixazomib)治疗新诊断多发性骨髓瘤的III期TOURMALINE-MM2研究的评估结果,该研究旨在评估伊沙佐米联用来那度胺和地塞米松对新诊断的不符合自体干细胞移植条件的多发性骨髓瘤患者治疗作用。
研究发现,在来那度胺和地塞米松中添加伊沙佐米可使中位无进展生存期(PFS)增加13.5个月(35.3 vs 21.8个月;HR=0.830;p = 0.073),但该试验未达到统计学显著性阈值,并且未达到PFS的主要终点。
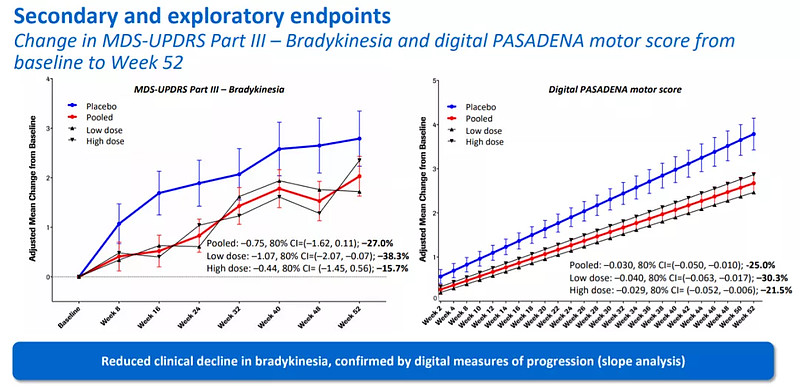
3. Prasinezumab治疗帕金森病II期研究
9月15日,罗氏在国际帕金森和运动失调协会的虚拟大会(MDS Congress)上,对Prasinezumab的II期PASADENA研究结果进行了口头陈述,结果不尽如人意。
Prasinezumab是一款靶向α-突触核蛋白的人源化单克隆抗体,可在帕金森氏病早期患者的多个预先指定的二级和探索性临床终点上显示出有效信号。本次披露的数据如先前报道,未达到主要终点,但与安慰剂相比,在两个prasinezumab组中均观察到显示疾病进展减少的功效信号。
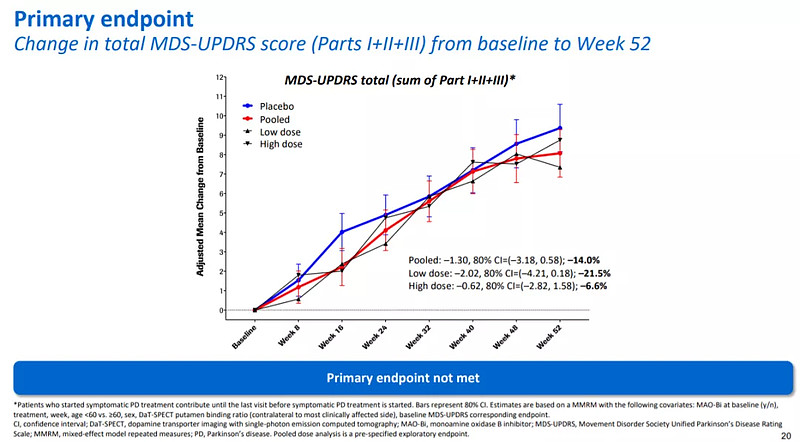
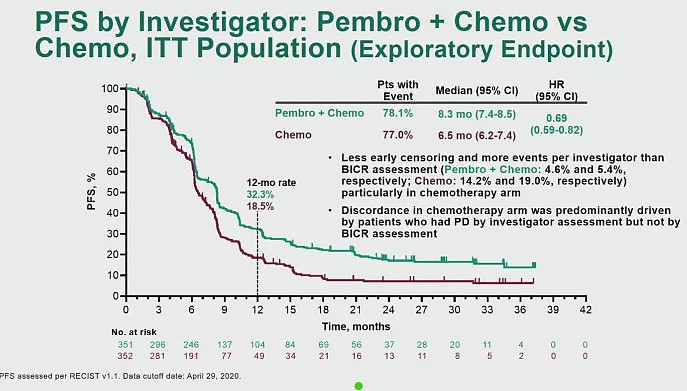
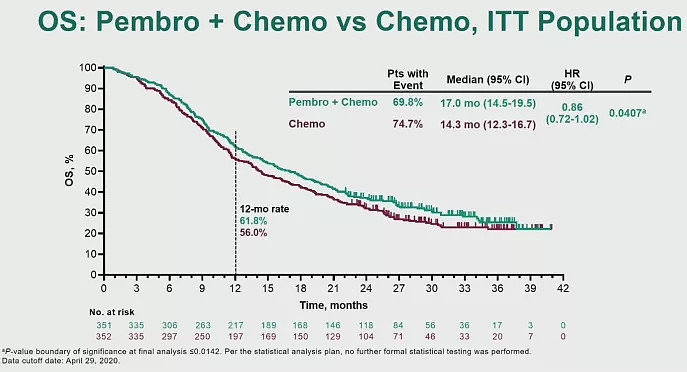
4. 帕博利珠单抗单药或联合铂类一线治疗晚期尿路上皮癌KEYNOTE-361研究
铂类药物化疗是晚期尿路上皮癌的标准一线治疗。目前,PD-(L)1疗法包括pembrolizumab都已经获得FDA批准用于二线治疗晚期尿路上皮癌(UC)。本月ESMO会议上,公布了pembrolizumab单药或联合铂类化疗(KEYNOTE-361)用于一线治疗晚期UC的疗效和安全性。
数据截止至2020年4月29日,中位随访时间为31.7个月。研究结果显示,pembrolizumab+化疗相比单独使用化疗改善了PFS(8.3 vs 7.1个月,HR 0.69,p=0.0033)和OS(17.0 vs 14.3,HR 0.86,p=0.0407),但均无统计学差异,未到达主要终点。
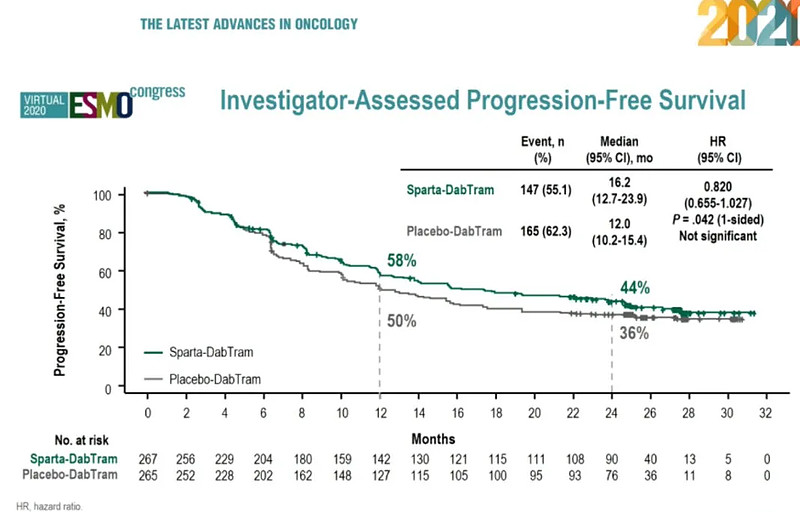
5. spartalizumab+达拉非尼+曲美替尼治疗未经治疗的晚期BRAF V600突变阳性皮肤黑色素瘤
9月19日,诺华宣布了III期COMBI-i试验的详细结果,该试验评估了研究性PD-1免疫疗法spartalizumab (PDR001)联合靶向治疗药物达拉非尼(dabrafenib)和曲美替尼(trametinib)在未经治疗的晚期BRAF V600突变阳性皮肤黑色素瘤患者中的治疗效果,并在ESMO上做口头报告。
基于前所未有的无进展生存结果,达拉非尼和曲美替尼被确认为晚期BRAF突变黑色素瘤标准靶向治疗。这项来自随机、双盲、安慰剂对照研究的结果表明,接受三联疗法(n=267)的患者中位PFS时间为16.2个月,而接受单独Tafinlar +Mekinist联合治疗的患者中位PFS时间为12.0个月(n = 265;危险比[HR] 0.82;95%CI 0.655-1.027;p = 0.042);接受三联疗法的整体缓解率为68.5%(95%CI,62.6-74.1%),而单独使用Tafinlar + Mekinist的总体缓解率为64.2%(95%CI,58.1-69.9%)。尽管研究未达到三联疗法的主要研究终点,但在COMBI-i临床试验的比较组中,使用Tafinlar+ Mekinist治疗的患者再次证明了积极的持久反应和无进展生存获益。