
近期中国对抗新冠病毒疫情的战斗可谓是取得了阶段性胜利,连续多日以来,除境外输入性病例,国内无新增确诊病例。然而,全球疫情在中国之外愈演愈烈。根据美国霍普金斯大学(John Hopkins University)的统计数据,截至北京时间3月27日9时31分,全球累计确诊新冠病毒感染病例超过53万,其中值得注意的是美国以85505例超越中国81782例,意大利以80589例逼近中国。除特别突出的美、意两国,多个欧洲国家的累计确诊病例都在数万。
在这种局面下,对于医药行业,特别是创新药研发,一个问题日益凸显,那就是:新冠病毒疫情对于临床试验的影响究竟有多大?
图表1. 全球新冠病毒感染累计确诊病例top10国家(3月27日9时31分)
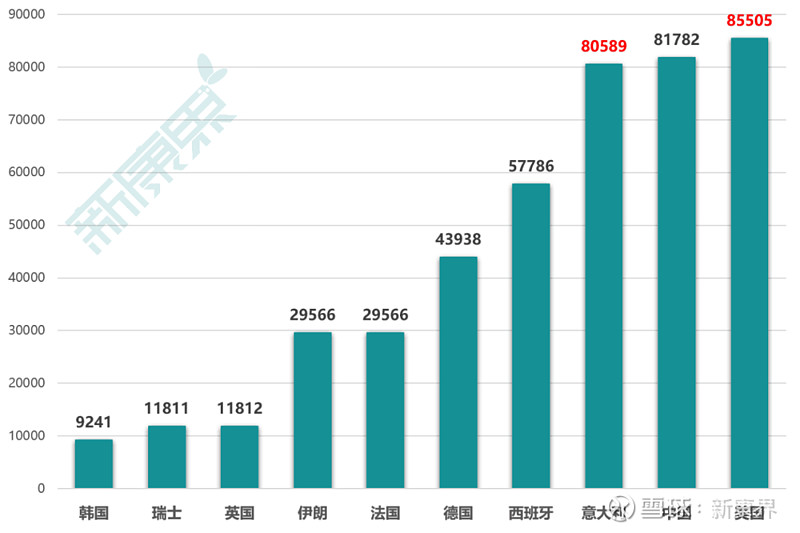
来源:John Hopkins University,中康产业资本研究中心
01
临床试验集中于新冠病毒重点疫区
在WHO总干事谭德赛博士于3月11日宣布新冠病毒疫情进入“全球大流行”之前,对于中国之外的区域,业界虽然意识到疫情可能会影响临床试验,但是感觉比较有限。进入“全球大流行”之后,局面便有所不同了。大部分国家借鉴了中国抗击疫情的经验,采取了减少或限制外出、聚集等措施,而这些显然会影响到临床试验的开展和进行。
根据美国网页链接临床试验网站的统计,其收录全球范围内的临床试验一共334271项,其中开展场所包括美国的有130048项,包括欧洲国家的有95565项,而包括中国大陆的为19128项。可见,处于全球创新药研发第一梯队的美国、第二梯队的欧洲占据了全球临床试验总量的67%,而根据上文介绍,这些国家恰好也是疫情最为严重的区域。由此可见,全球临床试验的主要开展地区与新冠病毒的主要疫区高度重合。
图表2. 全球临床试验数量区域分布
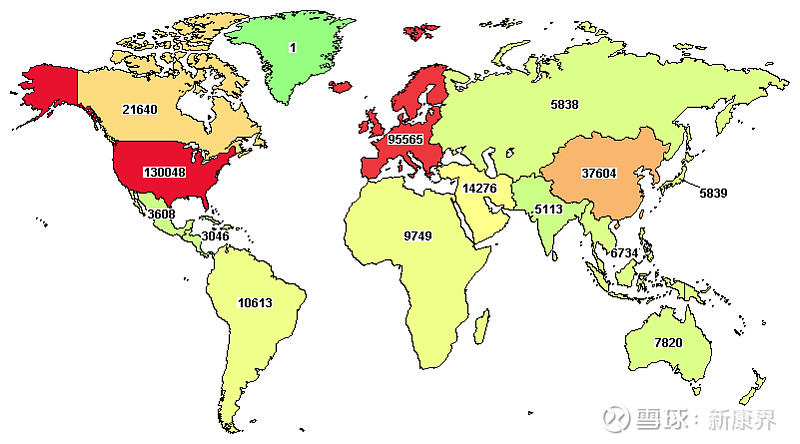
来源:clinicaltrials.gov,中康产业资本研究中心
02
新冠病毒疫情导致临床试验推迟、暂停或终止
在新的形势下,创新药研发企业及投资机构必须考虑进行中的临床试验可能被推迟甚至放弃的风险。3月16日(美国当地时间),Prevention Bio在其官网宣布暂停将新诊断的1型糖尿病(T1D)患者随机分组进入PRV-031(teplizumab)的全球III临床研究PROTECT (NCT03875729)。公司声称这一暂停是为了在日益严峻的公共卫生危机之下,保护患者、护理人员、临床现场工作人员、公司员工和CRO员工,但是正在接受研究治疗的患者将继续完成疗程。Prevention Bio称仍有望在2020年第四季度向美FDA滚动提交teplizumab的生物制品许可申请(BLA),用于预防或延迟高危人群的T1D。
3月18日(美国当地时间),IVERIC bio宣布因为新冠病毒全球大流行的威胁,出于对老年患者、相关医护人员及公司员工健康的谨慎考虑,决定推迟关于Zimura(avacincaptad pegol)的第二项关键临床试验ISEE2008的患者入选。Zimura为一款新型补体C5抑制剂,正在开发用于治疗干性年龄相关性黄斑变性(AMD)继发的地图状萎缩(geographic atrophy)。ISEE2008试验为一项包括400名患者的国际、多中心、双盲、假对照临床试验,原计划于3月开始。此前的一项关键临床试验为OPH2003(NCT02686658),于2019年10月28日达到预定主要疗效终点并且具有统计学意义。
Prevention Bio和IVERIC bio只是在疫情下暂停或推迟临床试验的两家公司,而Lexicon Pharmaceuticals则甚至提前终止了两项临床试验。3月19日(美国当地时间),Lexicon公司将提前结束Zynquista(sotagliflozin)的两项长期结果研究SCORED和SOLOIST。Zynquista是一款SGLT-1和SGLT-2双靶点抑制剂,已于2019年5月被EMA(欧洲药品管理局)批准作为胰岛素辅助疗法用于改善T1D患者的血糖控制。这两项研究旨在证明sotagliflozin对于心衰和慢性肾病的益处,以拓展适应症。Lexicon做出这个决定一方面是新冠病毒大流行对试验的不确定影响,其实更主要的是和赛诺菲(Sanofi)的合作终止,而短期内将找不到资助试验直至完成的合作伙伴。疫情对会议和人员流动的限制是部分原因,更多的可能是药物的前景不能吸引投资者。Lexicon认为终止这两项研究有助于保存财源,优先用于管线组合中的初期项目,如用于胆道癌的telotristat ethyl和用于神经痛的LX9211。从某种意义上说,疫情给了Lexicon一个及时止损、优化管线的契机。
除了这些小型生物技术公司,大型跨国药企也纷纷推迟、暂停或取消临床试验。3月23日(美国当地时间),礼来(Eli Lilly)宣布将在全球范围内,推迟大多数新研究的启动,暂停大多数进行中研究的患者入组,对已经入组进行临床试验的患者继续治疗。礼来希望以此减轻相关试验机构的负担,帮助医生将更多的精力放在抗击疫情上,但同时表示新冠病毒大流行预计不会影响其药物供应,也不会影响2020年的市场业绩。礼来预计除了新型抗炎药mirikizumab治疗克罗恩病的III期全球临床研究以外,不会调整先前已通报的后期临床试验的时间表。
03
新冠病毒疫情对药企市值的潜在影响
2020年第一季度即将结束,又到了国外上市药企发布季度报告的时间,但是疫情导致临床项目进度受到影响,特别是晚期临床试验或者关键临床试验不能及时读出结果(readout)。结果读出是临床试验过程中的一个重要里程碑,通常包括有效性(主要终点和关键次要终点)和安全性数据。对这些数据可以判断该试验成败,进而判断能否支持注册申请、能否获得监管批准的关键。美股医药板块作为比较理性的市场,如果药企公布良好甚至卓越的临床试验结果,股价往往应声上涨,反之则直接下跌。如果不能及时公布临床试验结果,对于某些药企来说则不能实现市值的腾飞,但对于另一些药企来说则延缓了市值的缩水。
图表3. 美股药企2020上半年待报告临床研究(单位百万美元)
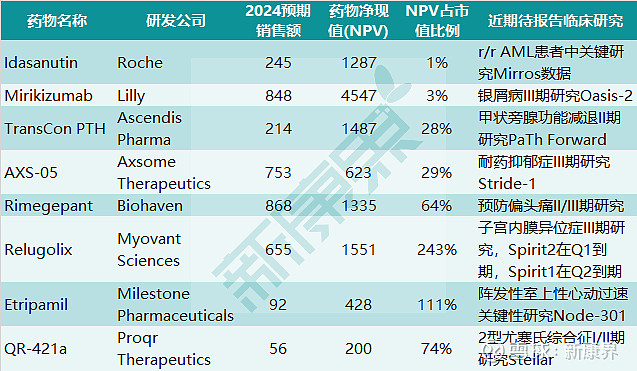
来源:公开数据,EvaluatePharma,中康产业资本研究中心
对于大盘股来说,待汇报的临床结果包括罗氏(Roche)的关键研究Mirros,该研究旨在证明在AML(急性髓系白血病)患者总体生存方面,MDM2拮抗剂idasanutin与化疗联用优于阿糖胞苷单药疗法。礼来(Eli Lilly)的抗IL-23单抗mirikizumab的首个III期试验Oasis-2的结果也在等待读出,该试验是mirikizumab和诺华(Novartis)的IL-17A抑制剂Cosentyx(可善挺,司库奇尤单抗,俗称“苏金单抗”)的头对头对比。如果礼来胜出,则该产品前途一片光明,反之则前路黯淡。
再将视线投向较小的药企,Biohaven正在进行口服rimegepant预防偏头痛的II/III期临床试验,希望该药定位于注射型CGRP抑制剂的一个更加方便的替代品。至于市值规模更小的公司,如Akero正在进行成纤维细胞生长因子AKR-001治疗NASH(非酒精性脂肪肝)的II期临床试验。非侵入性的核磁共振影响结果原先预计于2020年第一季度公布,活检数据于第二季度公布。Proqr公司的外显子跳读(exon-skipping)寡核苷酸QR-421a应该在第一季度报告在罕见遗传病尤塞氏综合症(Usher syndrome)中的早期数据。美股中更多受到影响的创新药临床项目参见上面的图表3。
04
受到疫情影响的关键临床研究成本
新冠病毒疫情确实影响到大量临床试验工作的进程,本文02部分提到根据clinicaltrials.gov网站数据,其收录了全球范围内超过33万项临床试验。面对如此巨量的试验,哪些会受到疫情影响,受到影响的程度又如何,这些难以定量,因此受到疫情影响的总体研发成本是很难估算的。然而,如果我们将范围缩小到关键临床研究(pivotal clinical research),其数据用来支持新药上市申请,一般情况下为III期临床试验。关键临床研究是药企投入资金最多的研发阶段,根据数据公司Informa的统计,III期临床研究成本平均达到一款获批上市的新药总体研发成本的59%。不仅如此,关键临床研究的成败基本决定了一款新药能否获批上市,从而影响创新药研发企业未来业绩的增长潜力。因此,可以认为关键临床研究是创新药研发企业除上市在售产品外的核心资产类型之一,对于还没有商业化产品的小型公司,更是其绝对核心资产。
如果只寻找关键临床研究,范围将大大缩小,但仍然很多,需要进一步简化以提高可操作性。那么,受疫情影响最为直接、强烈的应该是试验方案中规定的首要完成日期(primary completion date)在2020年之内的关键临床研究。按照这个思路,我们可以将clinicaltrials.gov网站中收录的、根据公布方案于2020年内完成的关键临床研究筛选出来。结果共包括315项关键临床研究,其中147项已经完成受试者入组但仍在进行中,168项仍在招募受试者,这两类分别涉及107248名已入组受试者和64856名方案计划入组受试者(图表4)。
图表4. 美国clinicaltrials网站中原定于2020年内完成的关键临床
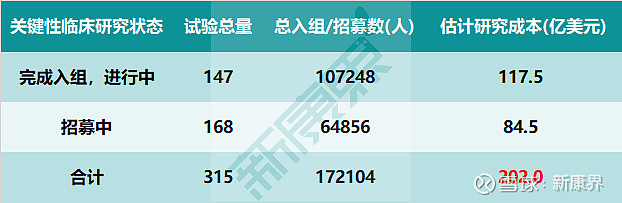
来源:clinicaltrials.gov,EvaluatePharma,中康产业资本研究中心
关于关键临床研究成本如何计算,其指导思想为使用真实世界数据(RWD)估算个别临床项目。结合公司透露的产品水平的支出和临床试验患者数量,根据技术和治疗类型创建每个患者的成本基准。随后建立算法,根据一定参数将成本基准与待估算的单项临床试验匹配,以估算其成本,再将全部临床试验的成本汇总即得到总体成本规模。对于clinicaltrials.gov网站收录的原定于2020年内完成的315项关键临床研究,其中147项已完成入组仍在进行的临床研究的成本为117.5亿美元,168项仍在招募中的临床研究的成本为84.5亿美元,总体研究成本为202亿美元。
05
受到疫情影响的未来重磅新药
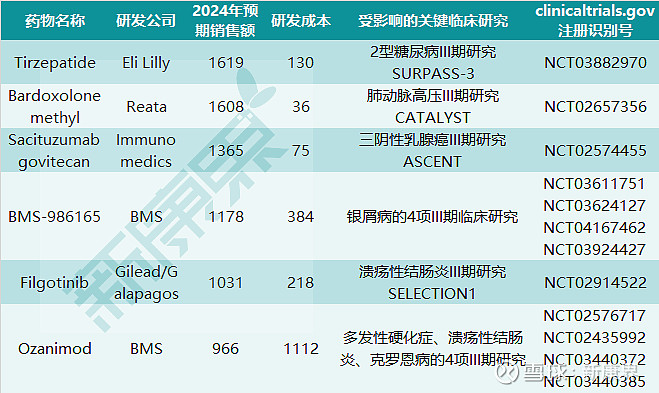
美国clinicaltrials.gov网站收录的首要完成日期在2020年内的315项关键临床研究涉及至少5款未来的重磅新药,包括礼来的GIP/GLP-1受体激动剂tirzepatide,Reata公司的Nrf2通路活化剂和NF-κB通路抑制剂bardoxolone methyl,Immunomedics公司的TROP-2靶向ADC药物sacituzumabgovitecan,BMS(百时美施贵宝)的Tyk2抑制剂BMS-986165,以及Galapagos公司的选择性JAK1抑制剂filgotinib。这些潜在重磅炸弹药物的预期销售额、受到疫情影响的关键临床研究,以及临床研究成本参见下表。
图表5. 关键临床受到疫情影响的潜在重磅新药
来源:clinicaltrials.gov,EvaluatePharma,中康产业资本研究中心
在关键性临床研究受到疫情影响的潜在重磅新药中BMS的两款药物尤其引人瞩目,Tyk2抑制剂BMS-986165、S1P1/5 受体激动剂ozanimod分别有4项III期临床试验可能会受到疫情影响,具体临床试验可根据图表5中的注册识别号在clinicaltrials.gov网站中查看。
06
结语
新冠病毒全球大流行的防控应对要求限制出行及人员聚集,通常造成临床试验的推迟或暂停,导致研究时间延长。加长的临床研究时间通常意味着更多费用,而且导致获批上市的时间顺延。上市推迟一方面影响企业的成本回收速度和周期,另一方面在创新药竞争迭代日益加快的情况下,晚上市甚至有可能打击一款新药的未来盈利能力。
