截至目前传奇生物/金斯瑞生物科技的 西达基奥仑赛(Cilta-cel) 共开展了 6 项主要临床试验。 Legend 2 与 CARTIFAN 1 于国内开展,CARTITUDE-1 、 CARTITUDE-2 、 CARTITUDE-4 、 CARTITUDE-5 全球多中心开展。本文主要分析讨论 西达基奥仑赛(Cilta-cel)的全球多中心的临床设计方案。
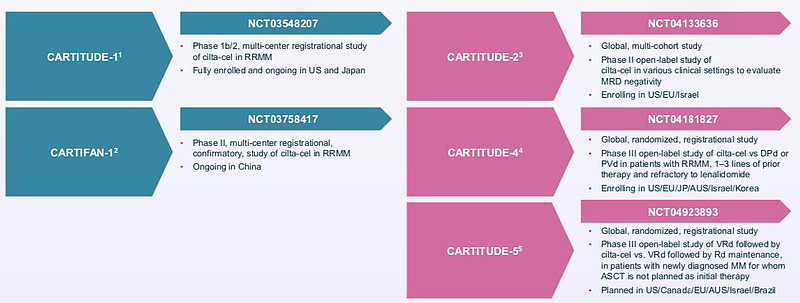
1. CARTITUDE-1是一项1b/2期临床,评估的是既往接受≥3种治疗方案的MM患者的治疗数据,为本次递交上市关键试验数据;
既往接受≥3种治疗方案(或蛋白酶体抑制剂和免疫调节药物双重难治)、并接受抗CD38抗体治疗的患者符合入组条件。入组97名患者,中位随访时间12.4个月最新疗效数据显示:ORR达97%,67%达到sCR。57名可评估MRD的患者中,93%达到微小残留病灶阴性(MRD—negative)。中位首次缓解时间为1个月(1-9),达到CR/sCR的中位时间为2个月(1-15)。77%患者达到12个月PFS,89%患者达到12月总生存。总体而言副作用好,安全性可控,中国之光,毫无疑问的“Best in Class”。
我们知道如果一个药物瞄准了“unmet medical need”并且初期临床数据优秀,FDA就容易授予“突破性疗法”或者“快速审批”。这时候药物用代替终点就可以快速上市,如果这适应症没有标准疗法,那么单臂临床都可以获得FDA的“有条件审批”。这也就是为什么CARTITUDE-1仅是个关键二期临床数据就可以在FDA和EMA申请上市的原因。再次证明我一贯的观点,“突破性疗法”很重要,往往能节省3-5年的上市时间,后续的跟随者将付出巨大的时间成本和临床成本(CAR-T因为成本贵,所以三期国际多中心临床费用巨贵无比)。
2. CARTITUDE-2是一项多队列2期临床研究。评估在不同环境下治疗 MM患者的安全性和有效性,探索前线用药和门诊用药的可能性;
评估的是之前接受过1~3线治疗的MM患者,入组20名患者,随访5.8个月。2021年ASCO大会上公布的疗效数据显示:ORR为95%,75%达到sCR/CR,85%达到VGPR。这个临床就是一个评估二线+治疗的二期临床数据,需要等三期临床数据出炉才能申请二线治疗的上市批准(BLA)。
3. CARTITUDE-4是比较Cilta-cel 疗法与标准疗法的疗效,是个临床 3 期的头对头试验,评估 CAR-T 2+ 线疗法疗效;
比较Cilta-cel与标准疗法( PI/IMID/单抗/地塞米松)的疗效,头对头,入组419名患者,针对接受过1-3线治疗并对来那度胺耐药RR MM患者的3期开放标签研究。预计2026年上市,如果成功将让Cilta-cel直接升级为二线标准疗法!
我们可以看出CAR-T三期头对头临床试验巨贵无比,因为首先CAR-T因为工艺的原因成本就接近百万,再加上海外临床费用和头对头药物费用,毛估估CARTITUDE-4临床费用在20亿人民币左右。这个临床费用对国内一众跟随者来说是无法承担的成本,更何况没有“突破性疗法”的加持,跟随者还需要完整三期的头对头(对照Cilta-cel)试验才能上市,8年时间+30亿的临床费用就是传奇生物Cilta-cel的宽大无比的护城河。很多人只是没有看懂而已,随便看看靶点跟随者很多就认为Cilta-cel也内卷,可笑。

4. CARTITUDE-5是首个一线治疗的关键头对头 3 期临床试验
三期全球头对头PK一线药物的CAR-T大临床,入组病人650人。如果成功将是一线MM适应症的标准疗法。毛估估CARTITUDE-5临床费用在25亿+人民币!一般的国内Biotech完全没有实力和勇气去做的大三期临床。

#伊斯科的创新药研究笔记# $金斯瑞生物科技(01548)$ $传奇生物(LEGN)$ $信达生物(01801)$ @今日话题