1.MNC做不成的biotech能行?
宜明昂科在港股主板上市前就经历投资人和交易所的种种质疑,原因无外乎是连吉利德的magrolimab(从forty seven 公司49亿美元bd来的)、艾伯维的lemzoparlimab(从天境生物bd)都失败了,为何一个名不见经传的biotech能成功?
先不谈药物机制上的问题,但从mnc做不成biotech就做不成这一点来说,其实失败的两款药并不是吉利德和艾伯维原研,追根溯源也都是biotech的产品。所以但凡是以这个观点否定宜明昂科的就犯了一个非常低级的错误。
2.曾经名噪一时的CD47靶点
在这里先介绍一下CD47靶点的成药机制吧。
2009年,斯坦福大学医学院癌症干细胞领域著名专家Irving L. Weissman教授在同一期Cell上发表了两篇论文,详细阐述了细胞表面CD47的作用,揭示了“Don't eat me(别吃我)”信号通路。Weissman教授团队发现,正常细胞表面的CD47通过与巨噬细胞表面的信号调节蛋白α(SIRPα)结合,释放一种“别吃我”信号,从而保护它们不被巨噬细胞“吃掉”。然而,狡猾的肿瘤细胞表面会高表达CD47,从而防止它们被巨噬细胞吞噬。
至此之后,开发靶向CD47-SIRPα信号通路,解除肿瘤细胞表面CD47“别吃我”信号的治疗药物成为了众多药企竞相追逐的热门赛道。
3.CD47靶点沉舟侧畔的原因
那么为何CD47靶点如此的难成药呢?
CD47在红细胞上高度表达,并且参与红细胞的正常更替,“年轻”的红细胞会高表达CD47以防止巨噬细胞吞噬,而“衰老”的红细胞上的CD47表达水平则会降低或构象改变,“主动求吞噬”。这也导致CD47抗体极易脱靶,促使巨噬细胞攻击功能正常的红细胞,引起贫血、溶血等严重不良反应,血液毒性成为了CD47抗体迈不过去的一道槛。
无论是吉利德的magrolimab还是艾伯维的lemzoparlimab都是倒在了严重的血液毒性上,但他们的二期临床数据都挺好,所以要想CD47成药,最重要的就是如何控制药物不与正常的红细胞结合。
4.宜明昂科的药有何不同
这里直接引用宜明昂科官网的介绍:替达派西普是宜明昂科研发的新一代CD47靶向分子,其具有双重机制,能够同时阻断来自肿瘤的“别吃我”信号,并通过IgG1激活患者免疫系统的“吃我”信号。替达派西普通过激活巨噬细胞,可以让“冷肿瘤”变成“热肿瘤”,并可以通过递呈肿瘤抗原给T淋巴细胞,诱导更多的肿瘤特异性T细胞反应。
最为关键的是替达派西普具有与CD47结合的一个工程化的人类SIRPα结构域,在体外研究中,并不与人体红细胞结合,并对该结构域采取了去糖基化的修饰,降低了该分子的免疫原性,减少血液毒性,避免抗原沉默,并具有更好的药代动力学特征。
这里简单介绍一下各大药企针对CD47的血液毒性采取的改造策略主要有两类,一类是针对Fc结构域的改造(选择效应器功能弱的IgG4或者是Fc域灭活),另一类则是针对CD47亲和力的改造,让其只结合肿瘤细胞的CD47,不结合红细胞等正常组织的CD47,实现方式有两种:要么利用特殊的SIRPα结合CD47的结构域,要么筛选只针对肿瘤CD47的特殊偏向性抗体。宜明昂科采取的是后者。
而吉利德CD47抗体药物还是陷入筛选最高亲和力抗体的陷阱。对CD47靶点来说,一旦抗体亲和力高,它进入人体后,会与外周的正常细胞结合、被包裹,以至于没能进入到肿瘤组织里面,形成‘抗原沉默’。为了确保有足够的抗体量进入到肿瘤组织,只有提高剂量,让药物越过正常细胞饱和以后,把剩余的量进入到肿瘤细胞中。这也是吉利德的magrolimab用量达到30mg/kg的原因,而用融合蛋白路径的替达派西普rp2d的剂量是2mg/kg/周,这也从侧面印证了替达派西普不与人体红细胞结合。
5.效果怎么样数据来说话
从2024asco会议上公布的最新数据看,替达派西普并没有让人失望。
(1)替达派西普联合阿扎胞苷治疗初治较高危的骨髓增生异常综合征(HR-MDS)适应症方面
在整体51个可评估患者中,完全缓解率(CR)达到33.3%,总体反应率达到64.7%;在治疗超过4个月的34名患者中,CR达到50.0%, ORR达到85.3%;而在治疗超过6个月的29名患者中,CR达到58.6%, ORR达到89.7%;反应随着治疗时间的延长,疗效持续提升。中位观察时间为15.9个月,中位无进展生存期(mPFS)和中位总生存期(mOS)未达到,12个月OS为71.1%。
血液毒性方面,有38.8%的患者血红蛋白较基线水平明显提高,45.2%的患者血小板较基线水平明显提高,21.9%的患者中性粒细胞较基线水平明显提高,同时显著降低了红细胞和血小板的输注需要。随着治疗时间的延长,并没有发现会增加血液学毒性。
这是asco摘要中的数据,在这里我再贴一张宜明昂科asco数据解读会上的数据图,这张图更能说明替达派西普对于血液毒性控制的效果。
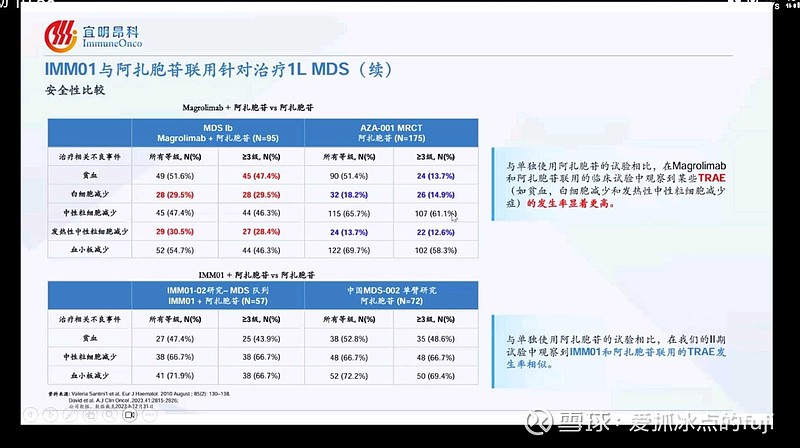
这是宜明昂科的IMM01也就是替达派西普和吉利德的magrolimab针对治疗MDS的血液毒性对比。从图中可以看出阿扎胞苷单药治疗就会有血液毒性的问题,而在和替达派西普联用时,并没有产生更多更严重的血液毒性。而吉利德的magrolimab联用阿扎胞苷却造成了更严重的血液毒性。
(2)IMM01联合替雷利珠单抗治疗既往PD-1抗体治疗失败后的经典霍奇金淋巴瘤(cHL)
在33例可评估患者中(此前接受的平均治疗线数为4线),ORR达到66.7%, CR 率达到 24.2%。在29例(87.9%)患者中观察到靶病灶大小的减小。中位观察时间为6.87个月,中位至缓解时间为1.6个月,中位无进展生存期和中位持续缓解时间未达到。
安全性方面,绝大多数药物相关不良反应(TRAE)为1-2级的血液学的不良反应。其中3-4级的白细胞降低、血小板降低、中性粒细胞降低和贫血分别为12.1%、12.1%、12.1%和6.1%,在经过对症治疗后可完全恢复或者恢复至1级/基线水平。无溶血案例发生。无患者因TRAE导致永久停用研究药物或死亡。显示该治疗方案安全性优异。
6.后记
个人觉得虽然现在说替达派西普能最终成药还为时过早,但是从公布的二期临床数据以及和吉利德magrolimab对比的血液毒性数据来看,我可以说替达派西普目前是全球在CD47靶点上最有希望“破冰”的,也期待宜明昂科能在大样本的临床三期控制住替达派西普的血液毒性。
而至于成药之后,那又是另外一个故事,现在讲述还为时过早,毕竟现在的宜明昂科仍旧是一块无人问津的璞玉。