2023年被普遍认为是RSV商业化元年,毕竟$葛兰素史克(GSK)$ 和$辉瑞(PFE)$ 两大厂的PDUFA都安排在今年5月,近期他们先后发布了针对中老年的三期临床数据,而另一家巨头$强生(JNJ)$ 则在原本领先的状态下忍痛宣布放弃争夺,我们不妨细看一下这个被公认为百亿以上规模领域的众生相,体会在疫苗这个诱人又苛刻的市场中,一着不慎满盘皆输,即便是顶级巨头但凡失却优势,体面离场就成了最合理的选择。
1. 疾病负担
RSV是一种常见的呼吸道病毒,感染气道上皮细胞并在细胞内进行复制,引起气道上皮细胞坏死、脱落以及粘膜腐脱,伴随大量的炎症介质释放,启动免疫和病理反应,使气道上皮结构遭到破坏和功能发生缺陷,成为引起相关疾病的始动环节。对多数青年人而言,RSV只引起轻微症状,而对5岁以下幼儿和60岁以上老人已被认为是严重的致死因素之一。
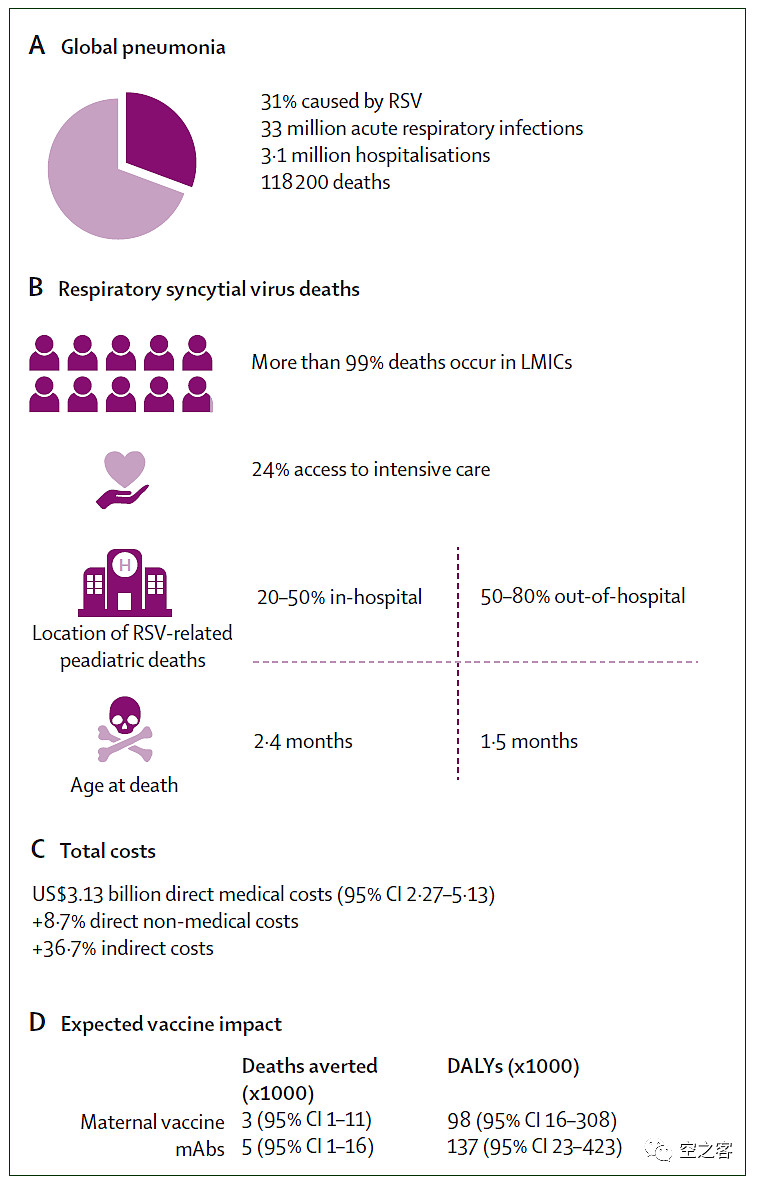
对于儿童来说,RSV是新生儿期之后的第二大致死因素,全球每年约3,000-6,000万儿童感染RSV、其中3-10%需要住院治疗,在中低收入国家就直接造成医疗支出超过30亿美元;仅在美国,每年感染RSV人数高达210万,其中6-8万人住院、100-300人死亡。
网页链接(22)00291-2/
对于老年人来说,因RSV导致的急性呼吸道感染发生率高达1.62%,仅在高收入国家每年就会有超过500万人,其中47万人需要住院、而在院内死亡人数超过3万人。

并且RSV感染呈明显的季节性,即使在美国每年秋冬季也会带来巨大的医疗负担,对儿童和老年人的预防性疫苗市场存在巨大的未满足需求。
2. 开发方向
RSV病毒包膜中的融合蛋白(Fusion Protein),可以促进病毒进入细胞并导致合胞体形成,使F蛋白成为疫苗开发的主要抗原。F蛋白有两种形态pre-F和post-F,最初研发者多选用更稳定的post-F、而多款疫苗的结果不利,在掌握了稳定pre-F蛋白的方法后,目前pre-F抗原位点已成为最有力的中和抗体诱导剂。
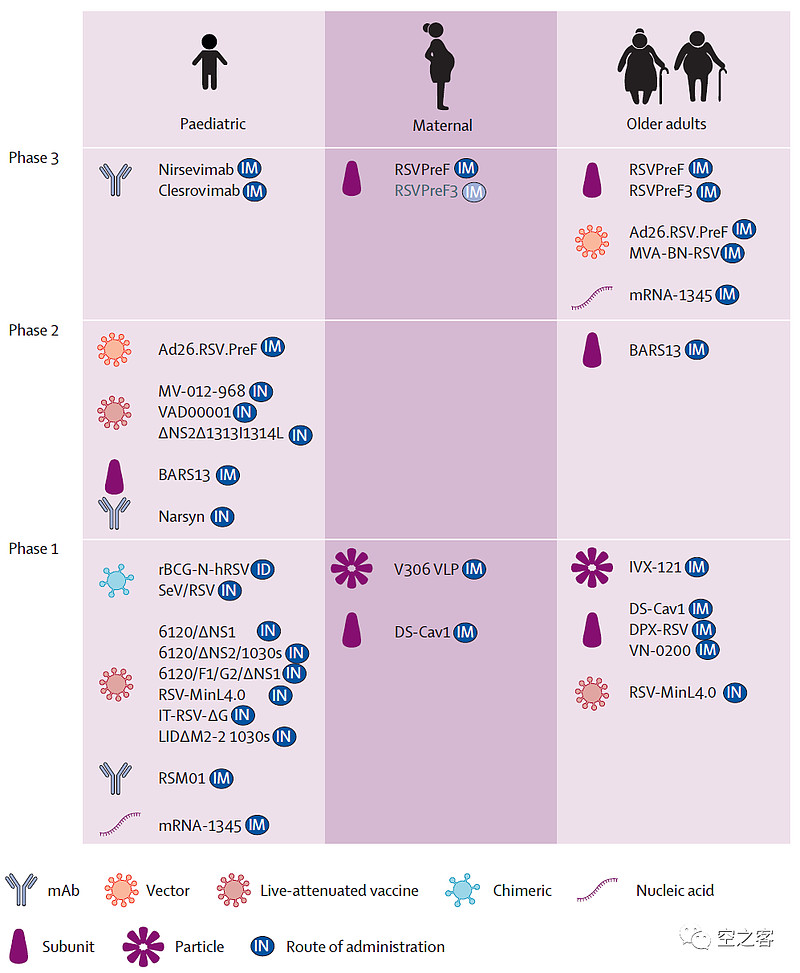
目前针对RSV感染,仅获批了抗体药物,包括AZ/Sanofi合作的Nirsevimab和Abbvie的Palivizumab,而疫苗尚无获批品种。在临床开发阶段的疫苗管线,包括了减毒活疫苗(主要是滴鼻免疫)、载体疫苗(代表性的是J&J的腺病毒载体疫苗)、亚单位疫苗(GSK和Pfizer都采取此类)、颗粒疫苗(代表性的是Novavax的VLP疫苗)和核酸疫苗(主要就是Moderna的mRNA疫苗)。
对于儿童群体,6个月以下幼儿多采取抗体药物的被动免疫,6个月以上幼儿多采取减毒活疫苗;对于孕妇群体,可以通过抗体转移对婴儿实现免疫,多个pre-F抗原的亚单位疫苗正在开发;对于老年人群体,包括亚单位、载体、核酸等多种路径都在争夺。
3. 核心品种
在最重头的成年RSV疫苗市场的争夺中,进入过三期的主要玩家包括Pfizer、GSK、J&J、Moderna,我们重点对比这几个品种针对老年人群体的临床数据。
3.1 GSK:RSVPreF OA
GSK作为老牌疫苗霸主,近几年在其他疾病领域又连遭厄运,在这最后一块阵地上的表现还是可圈可点,在RSV这个有望借以翻身的方向上,依旧是这套“重组蛋白+新佐剂”的组合,看似正在复制带疱的辉煌。
3.1.1 针对老年人群体
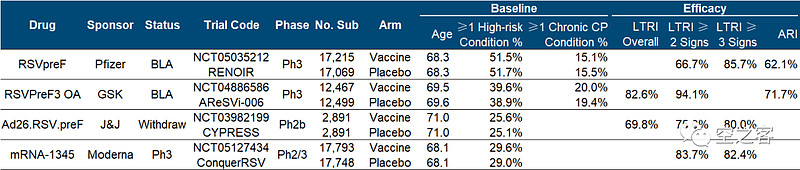
GSK的RSVPreF疫苗使用AS01佐剂,已经提交针对老年人群体的BLA,并在VRBPAC委员会投票中获得12:0支持有效性和10:2支持安全性,三期临床AReSVi-006试验结果在今年2月发表在NEJM上。
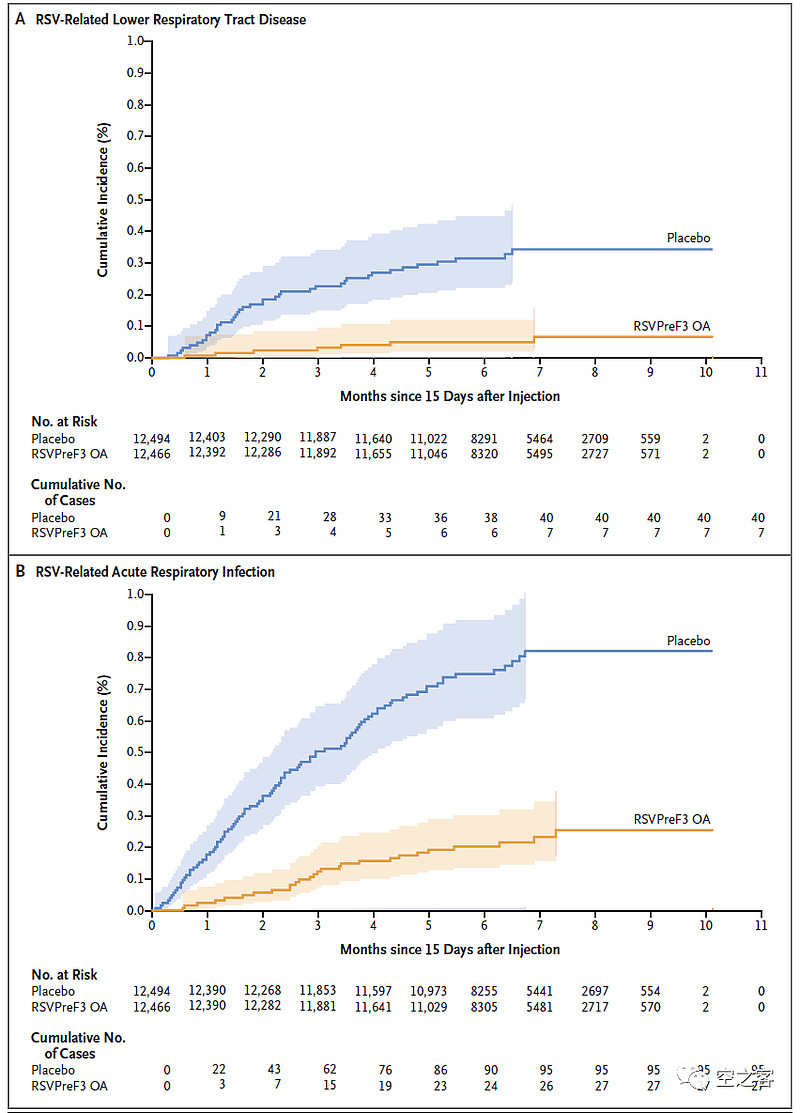
有效性方面,出现下呼吸道疾病临床终点的保护效力为82.6%,出现严重小呼吸道疾病(2种症状以上)临床终点的保护效力为94.1%,出现急性呼吸道感染临床终点的保护效力为71.7%。
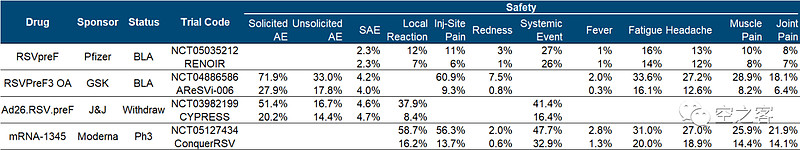
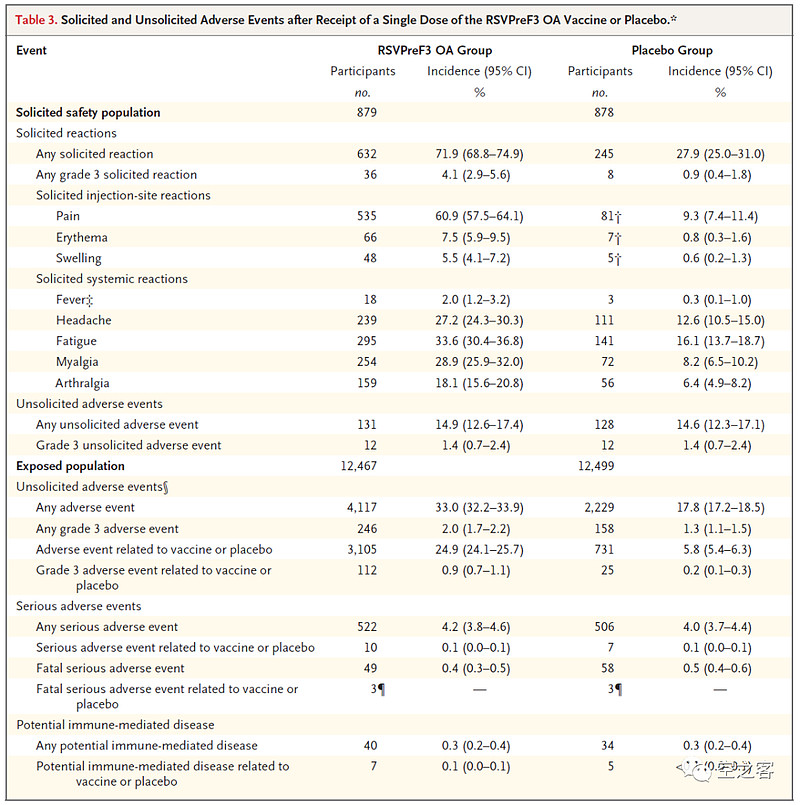
安全性方面,不良反应发生率说实话相当高了,注射后4天内要求报告的反应比例疫苗组与安慰剂组相比为71.9% vs 27.9%,其中局部疼痛60.9% vs 9.3%、疲倦33.6% vs 16.1%、头疼27.2% vs 12.6%,所幸发烧比例较低,SAE发生率4.2% vs 4.0%。
3.1.2 针对孕妇群体
在孕妇群体上GSK已早早退出竞争,只留下Pfizer一家的疫苗在三期。

3.2 Pfizer:RSVPreF
曾经的宇宙第一大厂不仅能靠新冠火,在疫苗领域的底蕴也还雄风犹在,RSV和肺炎这些大品种都有不俗表现。
3.2.1 针对老年人群体
Pfizer的二价pre-F疫苗,已经提交针对老年人群体BLA,并在VRBPAC委员会投票中分别获得7:4支持其有效性和安全性,三期临床RENOIR试验结果上周刚在NEJM上发表。

有效性方面,出现至少2种下呼吸道疾病症状的临床终点保护效力为66.7%,出现至少3种下呼吸道疾病症状的临床终点保护效力为85.7%,出现急性呼吸道疾病的临床终点保护效力为62.1%,从纸面数据看似乎较GSK保护效力偏低,不知道是否与Pfizer的基线高风险人群比例更高有关。
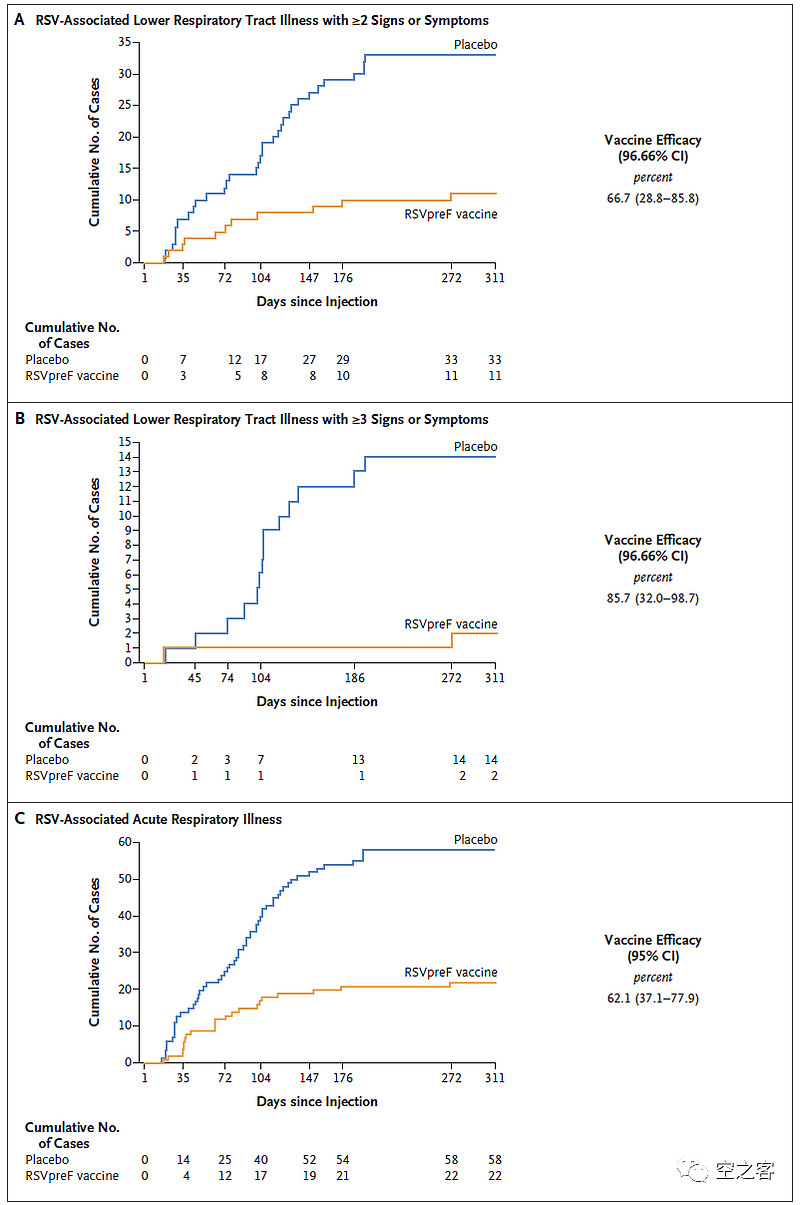
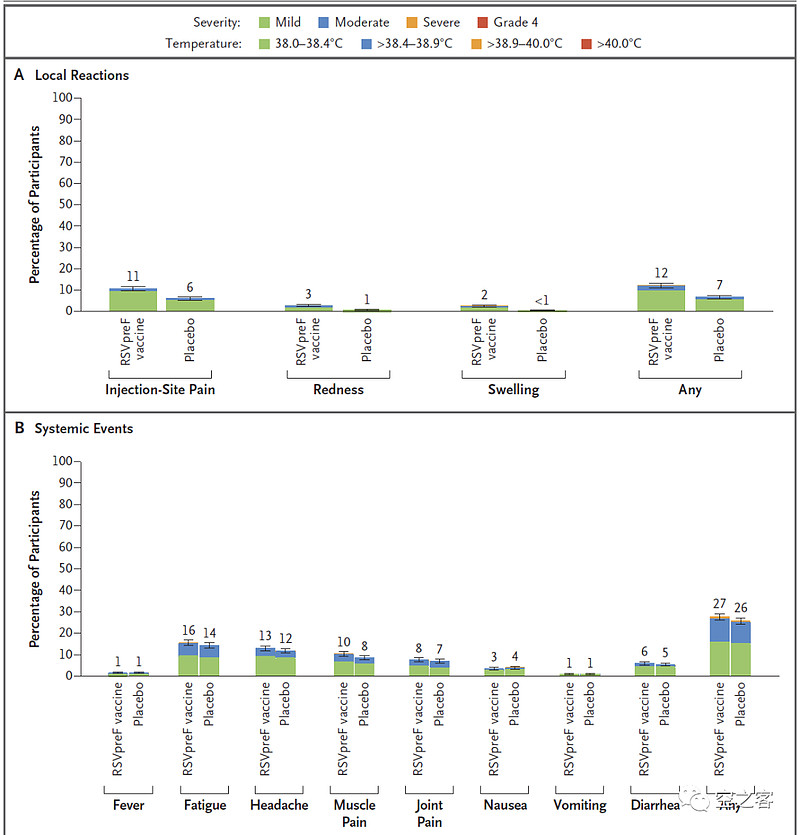
安全性方面,纸面数据比GSK要干净不少,注射7天内,局部不良反应发生率为12% vs 7%,全身不良反应发生率为27% vs 26%,且基本都是自限性和轻中度的,严重反应发生率仅不到0.7%,局部疼痛、疲倦、头疼等比例都相对更低,SAE发生率2.3% vs 2.3%。
3.2.2 针对孕妇群体
RSVpreF也已经提交针对孕妇群体BLA,并获得BTD认证,三期临床MATISSE试验结果同样上周在NEJM上发表。

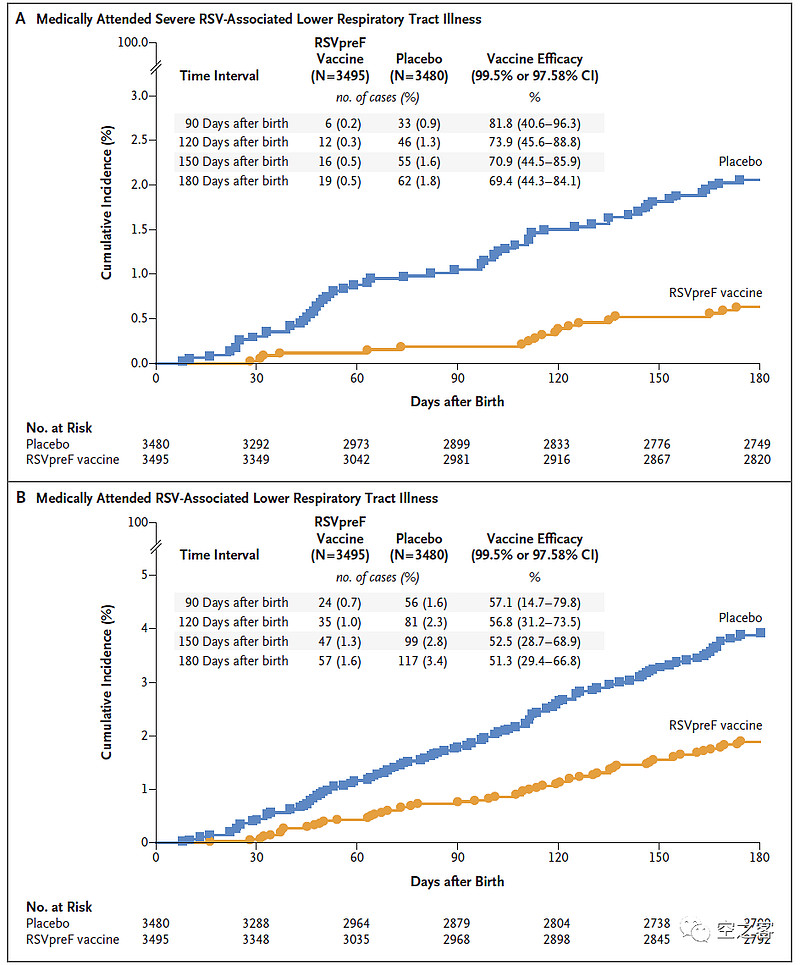
有效性方面,从出生后90-180天,严重下呼吸道疾病临床终点的保护效力为69.4% - 81.8%,下呼吸道疾病临床终点的保护效力为51.3% - 57.1%,因下呼吸道疾病而住院临床终点的保护效力为56.8% - 67.7%。
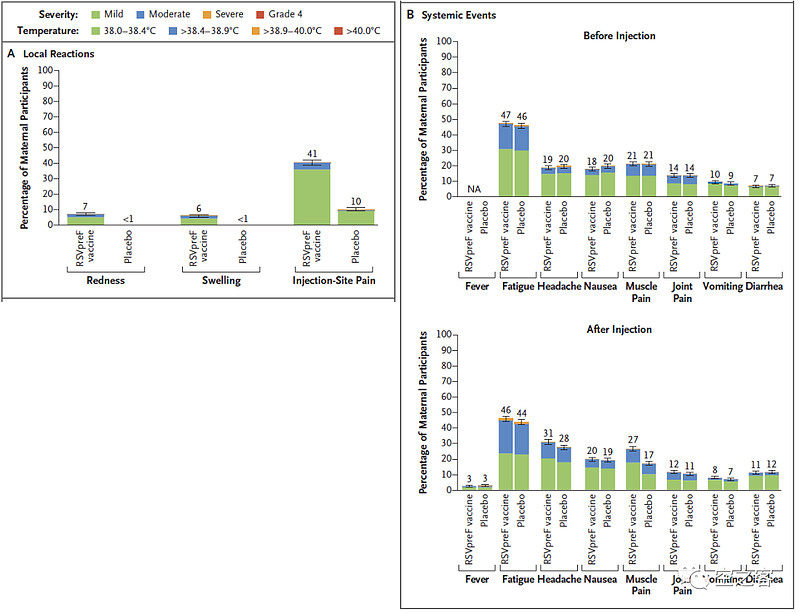
安全性方面,也还基本说得过去,注射后7天内,局部不良反应主要是疼痛41% vs 10%,全身不良反应里仅头疼31% vs 28%、肌肉疼痛27% vs 17%,考虑到孕妇的特殊体质,也可以理解;注射后1个月孕妇AE发生率13.8% vs 13.1%、SAE发生率4.2% vs 3.7%,出生后1个月婴儿AE发生率37.1% vs 34.5%、SAE发生率15.5% vs 15.2%。
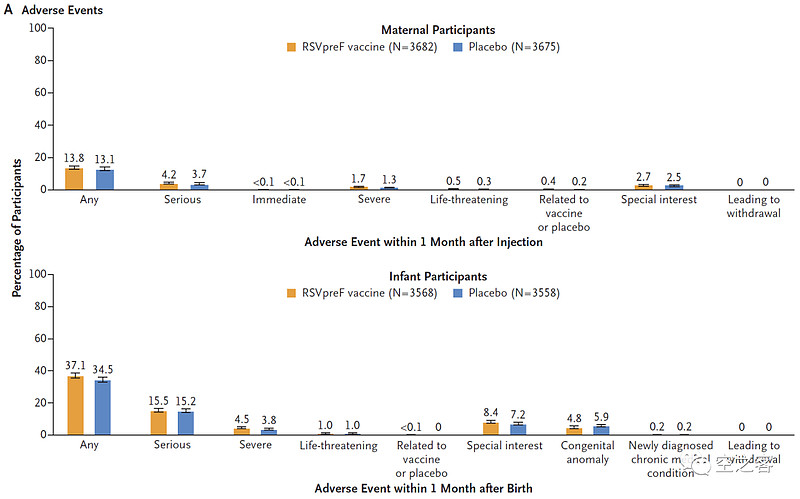
3.3 J&J:Ad26.RSV.preF
曾经与GSK/Pfizer并驾齐驱的J&J,在上个月黯然官宣退出RSV成人疫苗的竞争行列,虽然载体疫苗在激发T细胞免疫方面一直表现平平,但仅从现有临床结果来看似乎并未到山穷水尽的地步,如果不是J&J自己看到了什么我们尚不知晓的信号,那只能解释为被竞争对手堵死了所有竞争出路。

今年初,2b期临床CYPRESS试验的结果也在NEJM上发表过。

有效性方面,纸面数据其实挺说得过去,出现至少1种、2种、3种下呼吸道疾病症状的临床终点保护效力分别为69.8%、75.0%、80.0%;如果只看到这些数据,J&J放弃的理由那就只能是与G/P两家的进度差距所导致竞争力无望了。
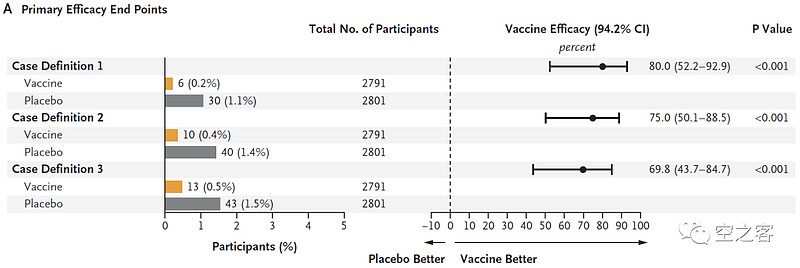
安全性方面,虽说也存在不良反应比较高,但好像并不比GSK更差,除非是在三期临床过程中发现了什么明显更恶劣的安全性问题,否则这似乎并不能作为J&J如此决绝割肉的理由。
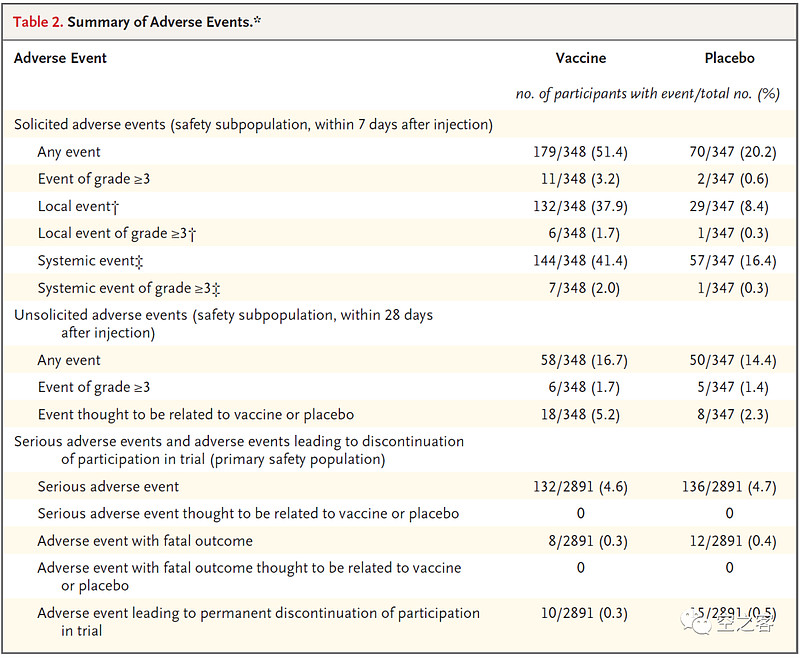
3.4 Moderna:mRNA-1345
Moderna的mRNA路径RSV疫苗,在年初公布了部分2/3期临床ConquerRSV试验数据,并预计今年上半年提交BLA。

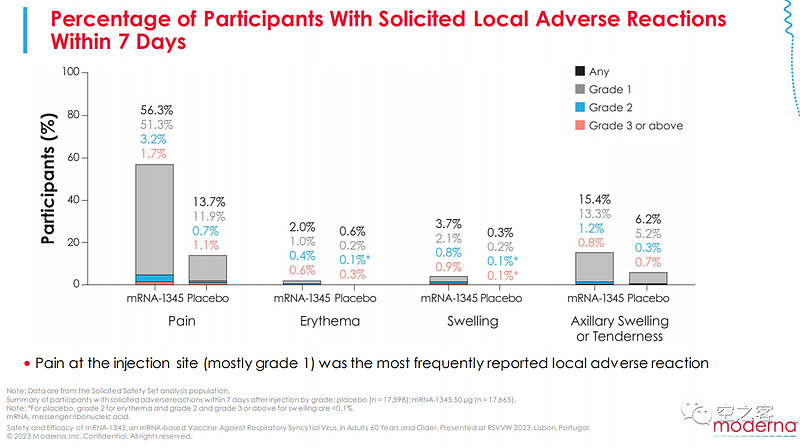
有效性方面,出现至少2种下呼吸道疾病症状的临床终点保护效力为83.7%,出现至少3种下呼吸道疾病症状的临床终点保护效力为82.4%,纸面数据来看基本与GSK在一个水平、甚至优于Pfizer。

安全性方面,与此前mRNA疫苗类似也多少有点隐忧,局部不良反应发生率58.7% vs 16.2%,全身不良反应发生率47.7% vs 32.9%,包括局部疼痛、疲倦、头疼等比例都不低,纸面上看跟GSK在相近水平。
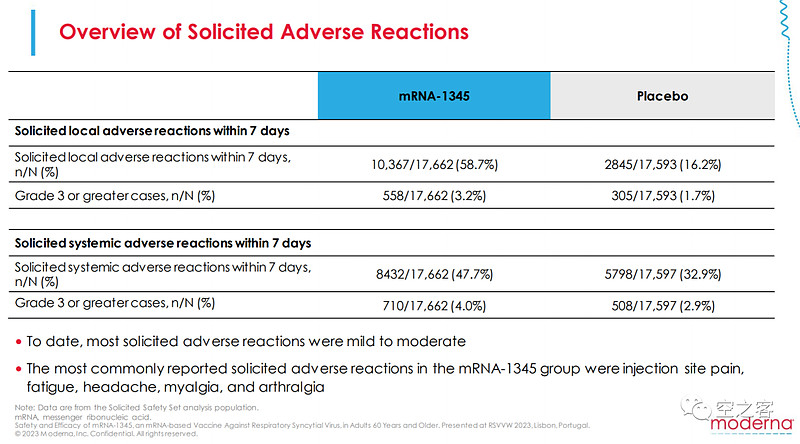
3.5 AZ/Sanofi:Nirsevimab
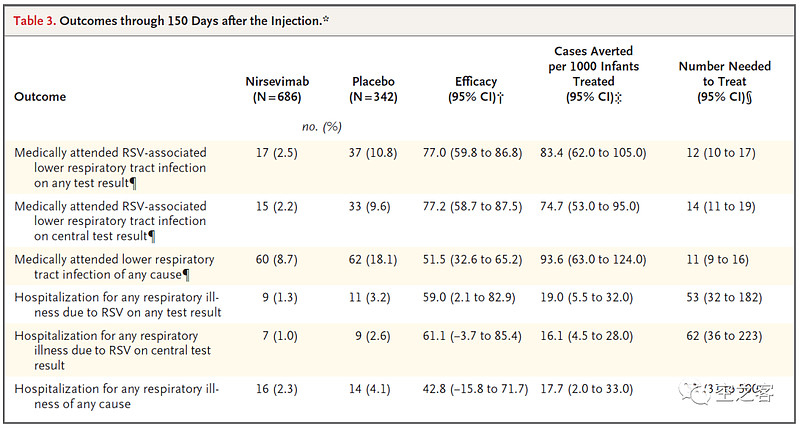
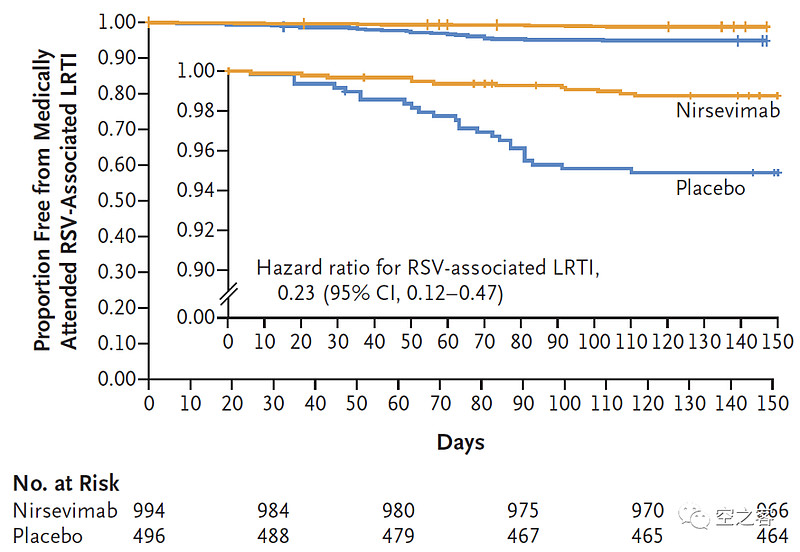
AZ与Sanofi合作开发的Nirsevimab是一款靶向F1和F2亚单位的IgG1κ单抗,与preF蛋白的高度保守表位结合,从而抑制病毒进入过程中的膜融合。目前Nirsevimab已经获得欧盟批准用于向婴儿注射而提供对RSV感染的保护,并已向FDA提交BLA,其三期临床MELODY试验结果于去年3月在NEJM上发表。

有效性方面,在注射150天后,下呼吸道感染临床终点的保护效力为74.5%,因下呼吸道感染而住院临床终点的保护效力为62.1%,纸面上看至少不弱于Pfizer疫苗针对孕妇注射而对婴儿出生后提供的保护效力;并且有观点认为,给婴儿注射疫苗的依从度反而要比给孕妇注射更高(毕竟听起来孕妇的抗体转移确实有点间接、起码需要费口舌去教育),因而在保护效力相当的情况下,Nirsevimab比Pfizer疫苗更占优势。
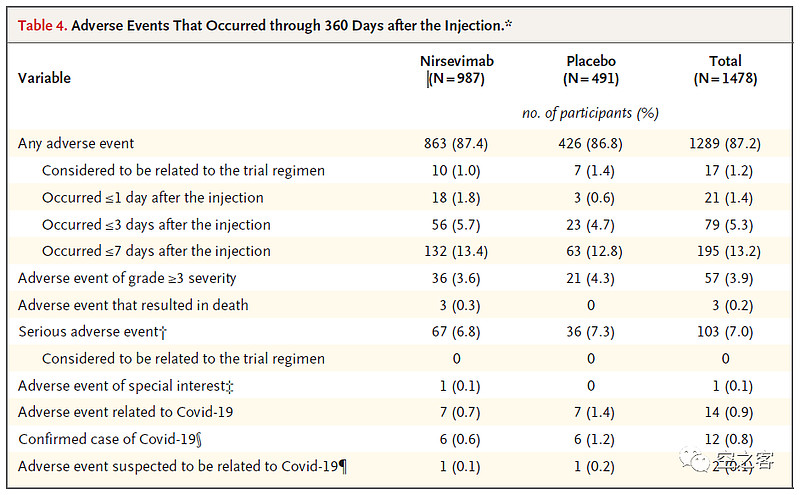
安全性方面,在注射后7天内,AE发生率13.4% vs 12.8%,SAE发生率6.8% vs 7.3%。
4. 监管考虑
今年2月,美国CDC召开ACIP会议,讨论对于这几个核心RSV疫苗和抗体药物的意见,摘要整理如下(说实话只看懂了部分、同时要感叹仅从药物监管信息披露水平上看我国都还有挺长距离要走)。
4.1 针对老年人群体
ACIP对GSK和Pfizer两款疫苗对老年人群体的保护总体认可,但同时指出两个疫苗在临床中均未能显示出对RSV住院率的降低以及对更严重RSV疾病最高风险人群的保护情况,以及对少数炎性神经毒性的关注。

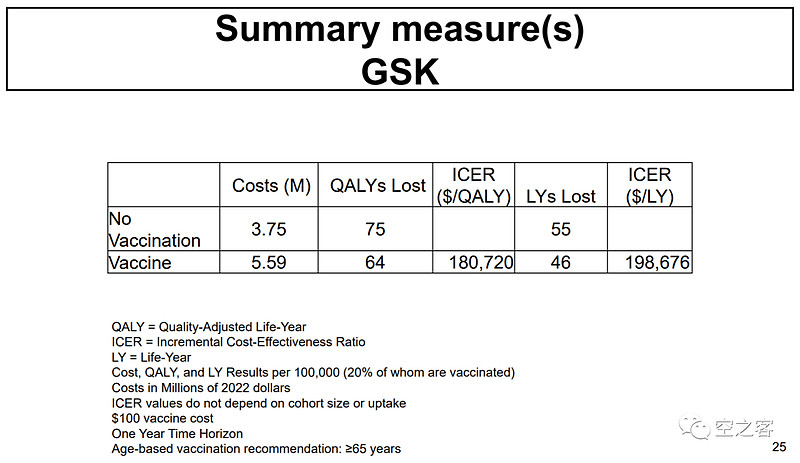
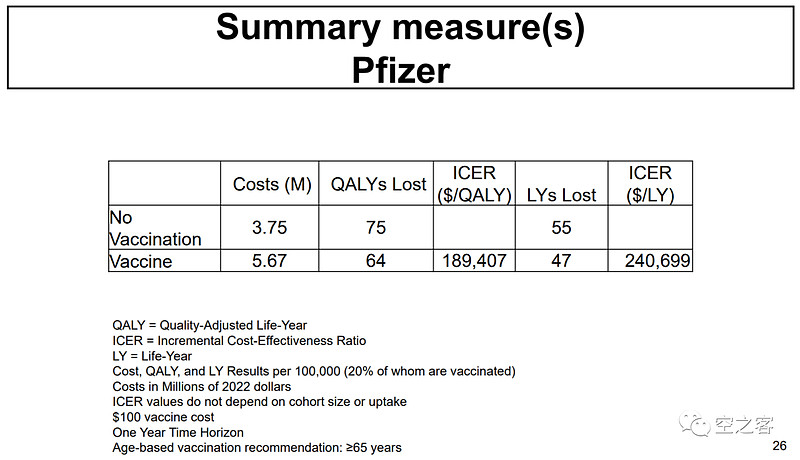
U-Mich与CDC的专家还对两款疫苗的性价比进行了测算,认为GSK和Pfizer为挽回1个QALY(Quality-Adjusted Life-Year)分别需花费$180,720和$189,407。
4.2 针对婴儿群体
对于第一个RSV流行季,ACIP对Nirsevimab态度较为积极,推荐所有出生于10月到次年3月的婴儿、以及出生于4月到9月且在8个月龄以内进入RSV流行季的婴儿,都可以使用,不过对成本问题也表达了顾虑;对于第二个RSV流行季,则认为目前的有效性和安全性数据,还不足以支撑Nirsevimab对哪些婴幼儿具有高性价比。


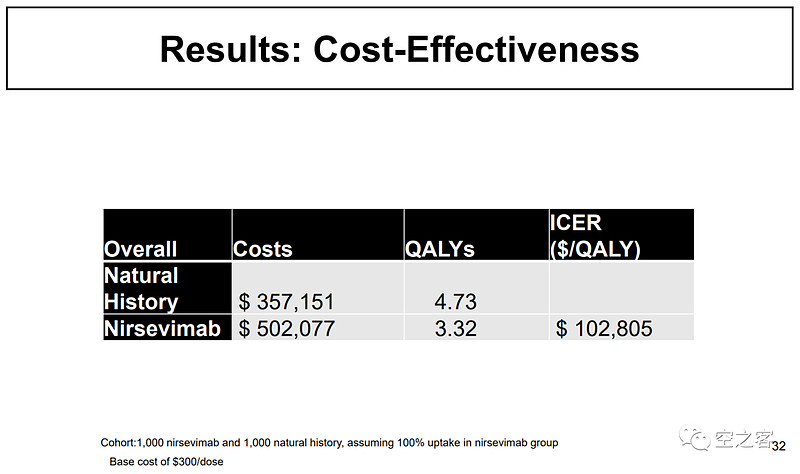
同样,U-Mich和CDC专家对Nirsevimab的性价比进行了测算,认为它为挽回1个QALY需花费$102,805。
5. 中国玩家
5.1 优锐医药
优锐医药于2022年3月从Bavarian Nordic公司引进一款痘病毒载体疫苗MVA-BN RSV的大中华区权利,原研药企已推进至三期临床、并获得FDA的BTD,优锐于2022年11月获得CDE批准启动临床。

5.2 爱科百发
爱科百发旗下小分子药物齐瑞索韦已于去年底向CDE提交NDA,在三期临床中展现出一定有效性和安全性。

5.3 艾棣维欣
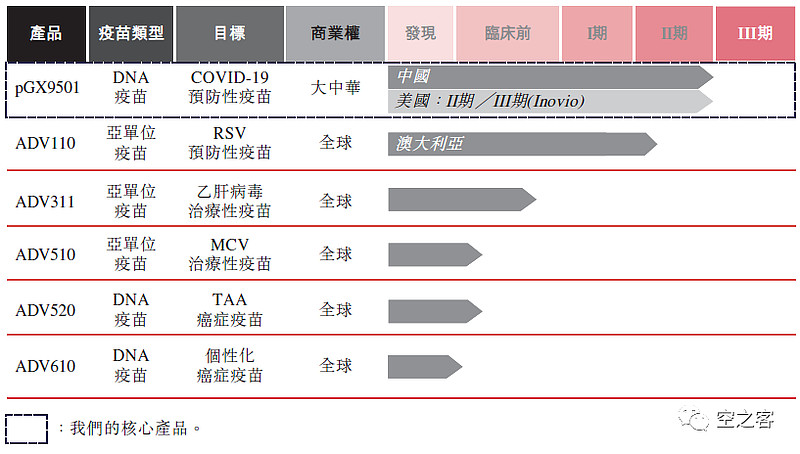
艾棣维欣旗下有一款亚单位疫苗ADV-110,至2021年港股招股书披露时正在澳洲开展二期临床。
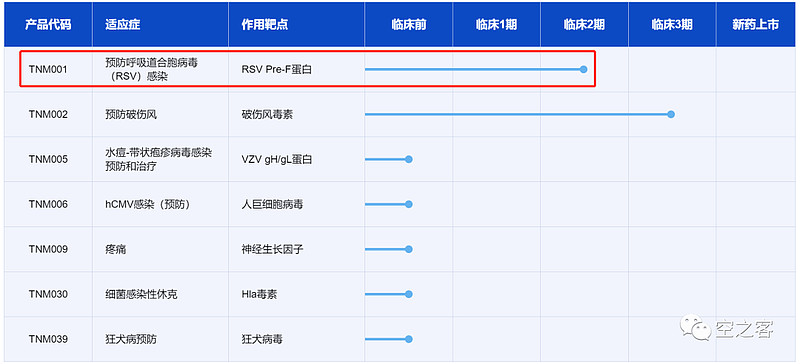
5.4 泰诺麦博
泰诺麦博旗下一款靶向preF的单抗药物TNM001,正在开展二期临床。
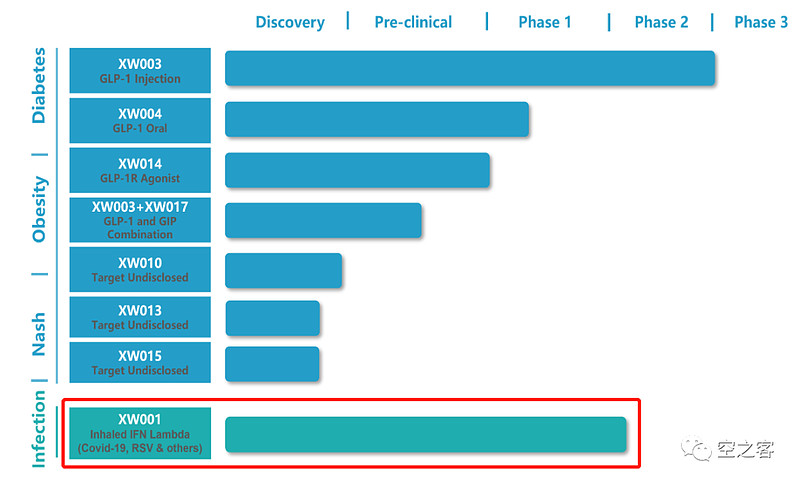
5.5 先为达
先为达旗下一款IFN-λ1吸入剂,目前用于治疗RSV感染的一期临床已接近尾声,同时也在开展治疗新冠的二期临床。
仅从研究成果的字面上也已经肉眼可辨,RSV的领跑者与后来者之间所拉开的差距,J&J用辛酸而决绝的断舍离,反过来印证了GSK和Pfizer在这未来百亿江湖中的地位。