(一)君实生物目前为止估值偏低。
$君实生物-U(SH688180)$ 已经中国🇨🇳上市的PD-1单抗(特瑞普利单抗)2021年销售额可以达到20亿元RMB,已经美国🇺🇸上市的JS016(新冠中和抗体)2021年‘净销售额分成+里程碑款’可以达到30亿元RMB(虽然算作营收,其实是利润)。
君实生物50亿元营收,只有750亿市值,在中国内地A股上市生物制药公司中意味着什么地位呢?
沃森生物20亿元营收,市值620亿元。
康泰生物20亿元营收,市值850亿元。
长春高新78亿元制药业营收,市值1680亿元。
恒瑞医药250亿元营收,市值4800亿元。
是的,小伙伴们都懂啦,君实生物被低估了。
(二)君实生物的抗体药物产能。
君实生物拥有33000升抗体药物已认证产能,位居国内TOP3,另外PD-1抗体产能超过了恒瑞医药36500升、信达生物22000升、百济神州8000升。
$药明生物(02269)$ 已经拥有52000升的认证产能,也因为新冠项目达到了100%的利用率。随着更多项目商业化,药明生物2021年计划投产规模为12.5万升,2023年总产能达到23万升。
回顾君实生物,公司计划在三年时间之内,在中国🇨🇳上海临港再建设8*15000升抗体药物产能,意味着股价即将大幅上涨(可能需要在A股定增或者H股配股40亿元)。
药明生物2023年产能将达到23万升,市值现在就有3700亿元,君实生物三年时间内产能达到15万升,机构们打算怎么估值?
(三)PD-1海内外适应症注册进度可能超预期。
(1)中国🇨🇳进度
2021年,君实生物PD-1(特瑞普利单抗)EGFR耐药非小细胞肺癌治疗、非小细胞肺癌新辅助治疗、食管鳞癌一线治疗三阴乳腺癌一线治疗的3期临床数据出炉,2022年以上适应症全部批准上市。
中国内地后续PD-1研发企业可能将全部失败。
道理很简单,一年费用仅仅只有3万元的PD-1,后续PD-1研发企业临床试验根本无法招募患者。
君实生物和阿斯利康在国内联合推广PD-1,一个缺团队,一个缺产品,相互结合各取所需比较成功。相比君实生物和阿斯利康,康方生物和正大天晴AK105(PD-1)今年下半年上市带来的竞争影响很小,因为AK105还没有进入医保,速度已经非常慢了。
相比恒瑞医药PD-1销售团队2000人,阿斯利康拥有4000人的销售团队,推广君实生物特瑞普利单抗应该非常给力。其实不能只比较销售员数量,阿斯利康的进院渠道也是优势。
(2)美国🇺🇸进度
君实生物PD-1(特瑞普利单抗)已经完成了鼻咽癌一线治疗和三线治疗临床试验,达到了临床试验终点。公司的PD-1鼻咽癌适应症已经获得美国FDA批准BTD(突破性疗法认定)资格。
虽然康方生物PD-1(AK105)也获得了美国FDA批准的鼻咽癌三线治疗适应症Fast Tract(快速通道)。但是,快速通道没有临床数据也可以申请。有了BTD后,快速通道的重要性大大降低,经常聊胜于无。
Priority Review(优先审评):对90%的NDA(报产)申请,从10-12个月加快到6-8个月。
其实,得到优先审评后也不是一定就有优先,还要看FDA当时的忙碌程度。
近年,多数获得BTD认证的药物,均能够得到优先审评,这也使得FDA以前奖励给创新药物的优先审评券(priority review voucher)的价值大跌。
因为,优先审评不是强制性的,而BTD(突破性疗法)认定和优先审评券是强制性加快上市进度。
另外,BTD认证最多的就是PD-1抗体免疫疗法,百时美施贵宝的Opdivo(O药)迄今为止获得了10项BTD认定,默沙东的Keytruda(K药)则获得了9项BTD认定。
君实生物PD-1的黏膜型黑色素瘤、软组织肉瘤、神经内分泌瘤都有可能再次申请BTD。
君实生物与Coherus的合作在美国🇺🇸销售,是第10家上市的PD-1,竞争非常激烈。Coherus的CEO在电话会上说希望未来能够占到10%的份额,也就是30亿美元(PD-1的全球市场2/3份额在美国)。
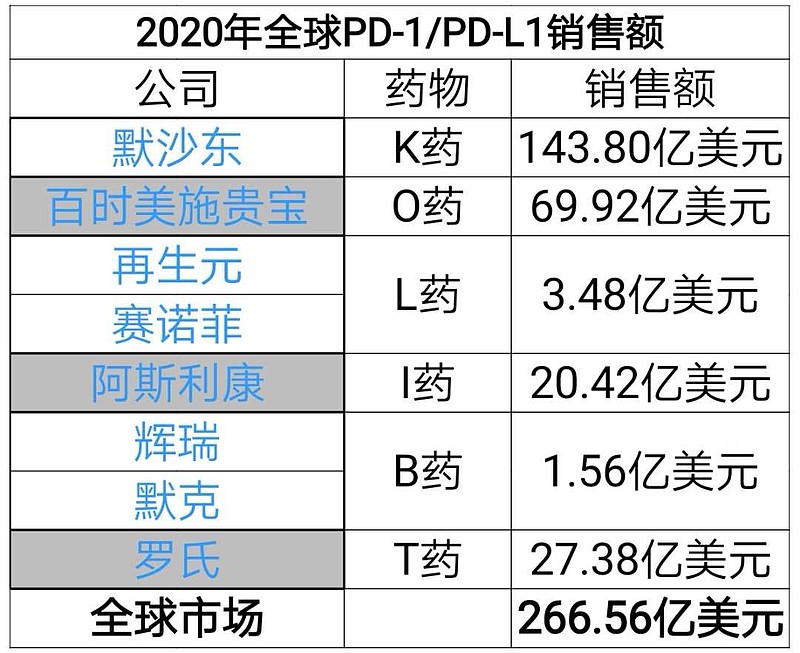
其实,预期悲观一点,君实生物PD-1即使在美国仅仅销售15亿美元(5%市场份额),也是100亿元RMB,秒杀国内一众土鳖头部药企。
(四)君实生物PD-1在美国临床试验费用远远低于预期。
中国已经加入欧美ICH体系,在中国的临床试验数据已经被美国FDA认可。
目前临床试验一名中国患者预计花费50万元RMB,一名美国患者花费20万美元,更多使用中国内地临床数据可以节约研发经费,加快上市速度。
PD-1在美国上市,FDA只要求有足够量的海外数据就可以,$恒瑞医药(SH600276)$ 卡瑞利珠单抗+阿帕替尼肝细胞癌一线治疗美国3期临床研究,只要求有15%的西方人数据,所以PD-1海外上市研发成本是可控的。
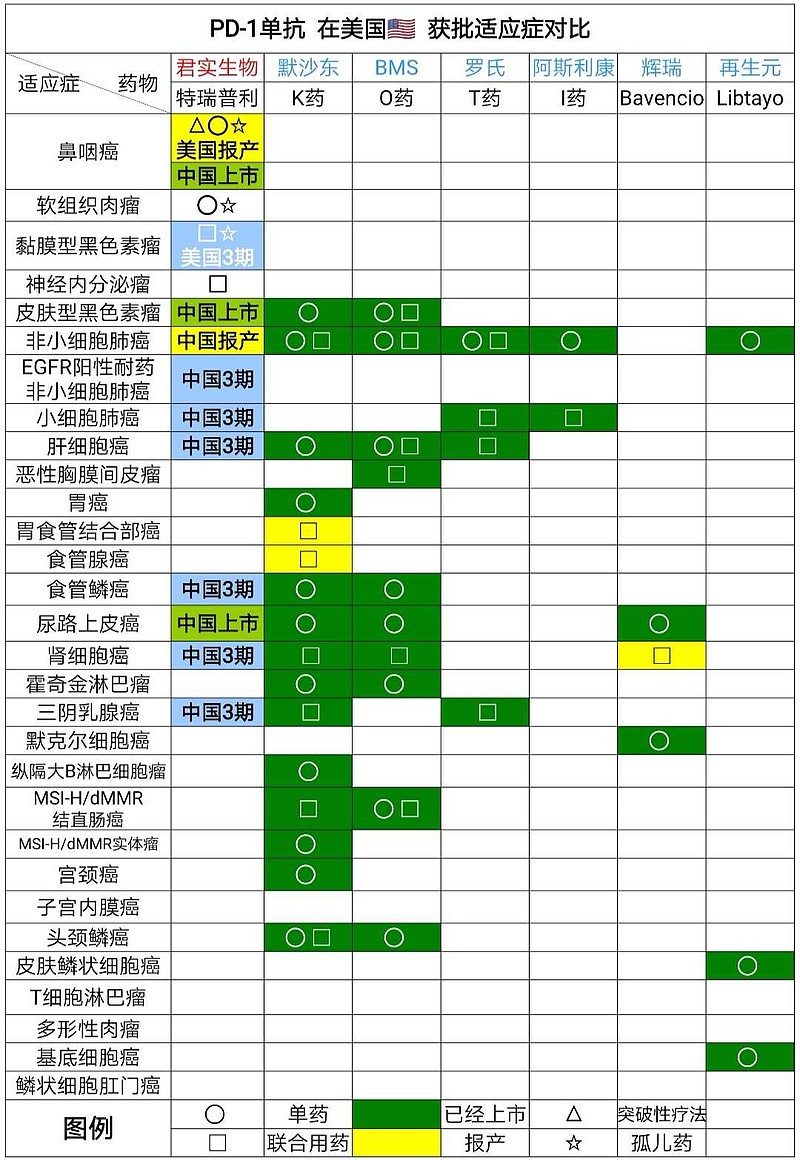
PD-1在欧美国家最大的适应症是黑色素瘤和肺癌。
君实生物是中国本土药企中,唯一完成黑色素瘤3期临床试验的。
君实生物和信达生物2021年将向美国FDA申请PD-1肺癌适应症注册(BLA)。
除了黑色素瘤和肺癌,君实生物还将在一年时间内向美国FDA申请注册尿路上皮癌、三阴乳腺癌、肝癌辅助治疗。
尿路上皮癌这个适应症最近非常火爆,
罗氏T药尿路上皮癌一线治疗适应症可能撤销,T药尿路上皮癌二线治疗已经撤销。
阿斯利康I药尿路上皮癌二线治疗适应症已经撤销。
默沙东 K药尿路上皮癌一线治疗适应症可能撤销。
君实生物凭借鼻咽癌、尿路上皮癌、黏膜型黑色素瘤几个适应症,预计在欧美市场推广进度会很快。