美国FDA批准首款用于治疗实体瘤的BiTE疗法
海思科“糖痛”新药获批上市
多个肺癌1类新药在国内获批上市
100个新药在国内获得临床试验默示许可
2024年5月,美国FDA 仅批准了1个新药上市,为安进公司的双特异性T细胞结合器(BiTE)Imdelltra;NMPA批准了3个国产新药和2个进口新药上市,包括肺癌新药依沃西单抗、甲磺酸瑞齐替尼、瑞普替尼,用于糖尿病性周围神经病理性疼痛的苯磺酸克利加巴林,以及抗感染新药注射用舒巴坦钠/注射用度洛巴坦钠组合包装。此外,5月还有100个1类新药在中国获批临床,获批数量同比过去两年略有增长。
一款新药
FDA批准上市
2024年5月,美国FDA药品审评和研究中心(CDER)批准了1个新药、3个生物类似药上市。下面简要介绍获批的这款新药。
表1. 2024年5月美国FDA批准的新药
药物类型
商品名
活性成分
适应症
企业名称
批准日期
生物新药
IMDELLTRA
TARLATAMAB-DLLE
非小细胞肺癌
2024/5/16
数据来源:FDA官网
IMDELLTRA
申报企业:安进
适应症:非小细胞肺癌
2024年5月16日,美国FDA批准安进(Amgen)公司的双特异性T细胞结合器(BiTE)Imdelltra(tarlatamab)上市,用于治疗在接受化疗时或之后出现疾病进展的广泛期小细胞肺癌(ES-SCLC)成人患者。安进的新闻稿指出,Imdelltra是首款用于治疗实体瘤的获批BiTE疗法。
小细胞肺癌(SCLC)约占所有肺癌的15%,与非小细胞肺癌相比,SCLC具有肿瘤倍增速度快,恶性程度高,较早发生广泛转移等特点,预后效果较差。
Tarlatamab是安进公司开发的一种双特异性T细胞结合器(BiTE),通过同时结合T细胞上的CD3和SCLC细胞上的DLL3,使患者自身的T细胞与SCLC细胞非常接近,从而导致免疫突触的形成和癌细胞的裂解。Tarlatamab的获批为SCLC患者带来了新的治疗希望。安进还计划启动两项3期临床试验,探索tarlatamab一线治疗ES-SCLC和局限期小细胞肺癌(LS-SCLC)的效果。
5款新药
NMPA批准上市
2024年5月,中国国家药品监督管理局(NMPA)批准了3个国产1类新药和2个进口1类新药,适应症包括非小细胞肺癌、糖尿病周围神经病、不动杆菌感染等,详情见表2。
表2. 2024年5月NMPA批准的新药
药品类型
药品名称
企业名称
适应症
批准日期
生物药
依沃西单抗注射液
联合培美曲塞和卡铂,用于经EGFR-TKI治疗后进展的EGFR基因突变阳性的局部晚期或转移性非鳞状非小细胞肺癌
2024/5/21
化药
甲磺酸瑞齐替尼胶囊
倍而达药业
既往经EGFR-TKI治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M 突变阳性的局部晚期或转移性非小细胞肺癌
2024/5/15
苯磺酸克利加巴林胶囊
糖尿病性周围神经病理性疼痛
2024/5/15
化药(进口)
注射用舒巴坦钠/注射用度洛巴坦钠组合包装
Entasis Therapeutics/再鼎医药
18 岁及以上患者由鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎(HABP)、呼吸机相关性细菌性肺炎(VABP)
2024/5/15
瑞普替尼胶囊
BMS
ROS1阳性的局部晚期或转移性非小细胞肺癌
2024/5/8
数据来源:国家药监局官网、药智数据
1. 依沃西单抗注射液
申报企业:康方生物
适应症:非小细胞肺癌
2024年5月21日,NMPA通过优先审评审批程序批准了康方生物的依沃西单抗注射液(商品名:依达方)上市,联合培美曲塞和卡铂,用于治疗EGFR -TKI进展的EGFR基因突变阳性的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的治疗,成为全球首个获批的PD-1/VEGF双特异性抗体。
肺癌是世界范围内高发病率和高死亡率的常见恶性肿瘤。其中EGFR突变的非鳞状非小细胞肺癌(nsq-NSCLC)是肺癌的主要类型之一。
依沃西单抗(AK112)是一种靶向结合人血管内皮生长因子-A(VEGF-A)和程序性死亡蛋白-1(PD-1)的IgG1亚型人源化双特异性抗体,可同时与VEGF-A、PD-1结合,竞争性阻断VEGF-A、PD-1与其配体的相互作用,发挥抗肿瘤活性。
AK112-301/HARMONi-A研究显示,依沃西单抗联合化疗能显著延长EGFR-TKI治疗进展的EGFR突变nsq-NSCLC患者的无进展生存期,降低患者疾病进展或死亡风险达54%,并呈现了明显的总生存期(OS)获益趋势,安全性良好。依沃西单抗该品种的上市为患者提供了新的治疗选择。
此外,5月31日,康方生物还宣布依沃西单抗单药对比帕博利珠单抗单药一线治疗PD-L1表达阳性的NSCLC的Ⅲ期头对头研究达到无进展生存期(PFS)的主要研究终点,取得决定性胜出阳性结果,成为全球首个且唯一在Ⅲ期单药头对头临床研究中证明疗效显著优于帕博利珠单抗的药物。
2. 甲磺酸瑞齐替尼胶囊
申报企业:倍而达药业
适应症:非小细胞肺癌
2024年5月15日,NMPA批准上海倍而达药业申报的1类创新药甲磺酸瑞齐替尼胶囊(商品名:瑞必达)上市,适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M 突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
甲磺酸瑞齐替尼是表皮生长因子受体(EGFR)激酶抑制剂,对EGFR突变体(如EGFR T790M、L858R)具有不可逆抑制作用。该药品上市为非小细胞肺癌成人患者提供了新的治疗选择。
3. 苯磺酸克利加巴林胶囊
申报企业:海思科
适应症:糖尿病性周围神经病理性疼痛
2024年5月15日,NMPA批准海思科申报的1类创新药苯磺酸克利加巴林胶囊(商品名称:思美宁)上市,用于治疗成人糖尿病性周围神经病理性疼痛。
苯磺酸克利加巴林为抑制性神经递质γ-氨基丁酸(GABA)的结构衍生物。该药品上市为糖尿病性周围神经病理性疼痛成人患者提供了新的治疗手段。
4. 注射用舒巴坦钠/注射用度洛巴坦钠组合包装
申报企业:再鼎医药
适应症:鲍曼-醋酸钙不动杆菌复合体敏感分离株引起的HABP/VABP
2024年5月15日,NMPA通过优先审评审批程序批准Entasis Therapeutics/再鼎医药申报的1类创新药注射用舒巴坦钠/注射用度洛巴坦钠组合包装(商品名:鼎优乐/XACDURO)上市。该药品用于治疗 18 岁及以上患者由鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎(HABP)、呼吸机相关性细菌性肺炎(VABP)。
该药是含注射用舒巴坦钠和注射用度洛巴坦钠的组合包装产品。舒巴坦是一种β-内酰胺类抗菌药物和 Ambler A 类丝氨酸β-内酰胺酶抑制剂,度洛巴坦是一种二氮杂二环辛烷、非 β-内酰胺类的 β-内酰胺酶抑制剂,可保护舒巴坦不被 β-内酰胺酶降解。
该药品上市为鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎、呼吸机相关性细菌性肺炎患者提供了新的治疗手段。
5. 瑞普替尼胶囊
申报企业:BMS
适应症:非小细胞肺癌
2024年5月8日,NMPA通过优先审评审批程序批准百时美施贵宝(BMS)申报的1类创新药瑞普替尼胶囊(商品名:奥凯乐/AUGTYRO)上市,适用于ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
瑞普替尼是一种酪氨酸蛋白激酶原癌基因ROS1和原肌球蛋白受体酪氨酸激酶(TRKs)TRKA、TRKB及TRKC的抑制剂。该药品的上市为ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者提供了新的治疗选择。
100款新药
国内获批临床
2024年5月,有100个1类新药在中国获得临床试验默示许可,包括78个国产新药和22个进口新药,获批数量同比去年略有增长。
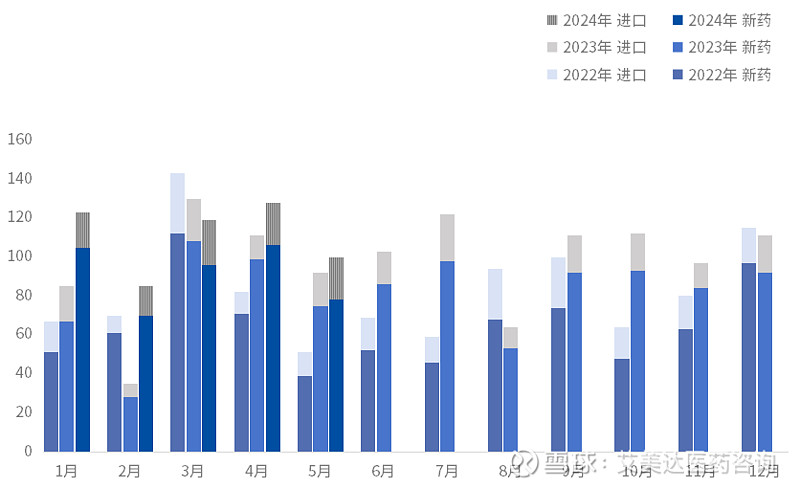
图1. 2022-2024年获批临床的1类新药数量
数据来源:国家药监局官网、药智数据
从药物类型看,小分子、多肽、小核酸、放射性疗法、单抗、ADC、细胞疗法和基因疗法都有涉及。
从适应症看,除了肿瘤这一热门领域,免疫性疾病、感染、肌萎缩侧索硬化症(ALS)等疾病也迎来了不少新药,涉及英矽智能、嘉越医药、上海医药、倍特药业、祥根生物、恒瑞医药、科笛生物、康蒂尼药业等国内药企,以及、施维雅、诺华、艾伯维等跨国药企,部分首次获批临床试验许可的新药见表3和表4。
表3. 2024年5月国内获批临床的国产新药(部分)
药物类型
药品名称
企业名称
适应症
临床试验默示许可日期
小分子
ISM3412胶囊
英矽智能
局部晚期/转移性实体瘤
2024/5/6
JYP0066乳膏
嘉越医药
白癜风、轻中度特应性皮炎
2024/5/7
SPH7485片
晚期实体瘤
2024/5/10
吸入用XQ-001
倍特药业
特发性肺纤维化
2024/5/15
SG1001片
祥根生物
侵袭性真菌病
2024/5/15
HRS-5346片
脂蛋白紊乱
2024/5/16
CU-10101软膏
科笛生物
轻度至中度特应性皮炎
2024/5/17
SPH7450片
抑郁症
2024/5/21
INNA1605软膏
亿诺药业
银屑病
2024/5/22
F230片
康蒂尼药业
肺动脉高压
2024/5/22
替古索司他片
痛风
2024/5/27
多肽
注射用LYSC98
由革兰阳性菌引起的细菌性皮肤和软组织感染(ABSSSIs)
2024/5/23
HRS9531片
超重或肥胖、2型糖尿病
2024/5/24
小核酸
RAG-17注射液
中美瑞康
SOD1突变引起的肌萎缩侧索硬化症(ALS)
2024/5/15
放射性药物
INR101注射液
云核医药
PSMA阳性病灶的正电子发射断层扫描(PET)成像
2024/5/9
177Lu-LNC1010注射液
蓝纳成生物
SSTR2阳性胃肠胰神经内分泌瘤(GEP-NETs)
2024/5/23
造影剂
DGPR1008注射液
新斗生物
前列腺癌
2024/5/21
融合蛋白
GB08注射液
科兴药业
儿童生长激素缺乏症
2024/5/23
单抗
CM383注射液
阿尔茨海默病
2024/5/6
QX013N注射液
慢性自发性荨麻疹
2024/5/9
JMT202注射液
津曼特生物
降低高甘油三酯血症患者的甘油三酯(TG)水平
2024/5/16
ADC
注射用ILB-3101
英诺湖医药
晚期恶性肿瘤
2024/5/14
注射用YL205
宜联生物
晚期实体瘤
2024/5/21
注射用YL211
宜联生物
晚期实体瘤
2024/5/23
双抗ADC
注射用BL-B16D1
实体瘤
2024/5/9
细胞疗法
混合活化杀伤(MAK)免疫细胞注射液
拓华生物
晚期恶性实体瘤
2024/5/10
SCM-181注射液
舜喜再生医学
特发性肺纤维化
2024/5/21
NK042细胞注射液
恩凯赛药
晚期实体瘤
2024/5/22
基因疗法
RJK002注射液
瑞吉康生物
肌萎缩侧索硬化症(ALS)
2024/5/9
数据来源:国家药监局官网、药智数据
表4. 2024年5月国内获批临床的进口新药(部分)
药物类型
药品名称
企业名称
适应症
临床试验默示许可日期
小分子
Lu AF28996 胶囊
灵北制药
帕金森
2024/5/17
Vorasidenib片
施维雅
星形细胞瘤或少突胶质细胞瘤
2024/5/23
放射性药物
镥[177Lu]Lu-NeoB注射液
诺华
胃泌素释放肽受体阳性、雌激素受体阳性、人表皮生长因子受体-2阴性、转移性乳腺癌
2024/5/6
PDC
注射用JR8603
JiaRay Pharmaceuticals
晚期实体肿瘤
2024/5/9
ADC
ABBV-400注射用粉末
艾伯维
结直肠癌
2024/5/23
单抗
Vixarelimab 注射液
基因泰克
溃疡性结肠炎
2024/5/22
Budigalimab
艾伯维
局部晚期或转移性Child-Pugh A级肝细胞癌(HCC)
2024/5/31
融合蛋白
Lerodalcibep
LIB Therapeutic
降低低密度脂蛋白胆固醇(LDL-C)水平
2024/5/16
数据来源:国家药监局官网、药智数据
5月,全球非小细胞肺癌市场迎来了多个创新药。在美国,FDA批准了安进(Amgen)公司的双特异性T细胞结合器(BiTE)Imdelltra(tarlatamab);在中国,NMPA批准了康方生物的VEGF/PD-1双抗依沃西单抗(AK112)、倍而达药业的第三代EGFR-TKI甲磺酸瑞齐替尼,以及进口的瑞普替尼,为非小细胞肺癌患者带来了新的治疗选择。
此外,NMPA还批准了再鼎医药引进的注射用舒巴坦钠/注射用度洛巴坦钠组合包装,用于治疗鲍曼-醋酸钙不动杆菌复合体敏感分离株所致HABP/VABP;海思科的苯磺酸克利加巴林胶囊,用于治疗尿病性周围神经病理性疼痛,进一步丰富了国内患者的用药选择。
在临床研究方面,5月份国内有100个1类新药获得了临床试验默示许可,其中40余款是首次获批临床,除了肿瘤等热门领域,国产创新药将适应症更多地拓展到免疫性疾病、代谢性疾病、阿尔茨海默病,以及肌萎缩侧索硬化症(ALS)等罕见病,这些进展展现了国内创新药市场的活力与潜力,未来如果顺利获批,将为患者带来更多样化、个性化的治疗选择。
本文转载自博药
免责声明
本文系转载,仅做分享之用,不代表平台观点。图片、文章、字体等版权均属于原作者所有,如有侵权请告知,我们会及时处理。
------------------------------
「长按」二维码添加小达「进群」
与更多行业伙伴共探市场前沿资讯
艾美达医药咨询
艾美达(北京)医药信息咨询有限公司,成立于2014年4月,是一家专业的医药行业咨询服务提供商。公司致力于将产业政策研究与真实世界的数据挖掘深度结合,洞悉行业政策对市场的影响,通过专业的研究提供前瞻性的市场分析,为企业产品上市后的市场准入提供整体解决方案。