5 月 17 日,先声药业宣布其 3CL 蛋白酶抑制剂 SIM0417 获批临床,用于曾暴露于新冠检测阳性感染者的密接人群的暴露后预防治疗。
在全球范围内,仅阿斯利康的长效中和抗体鸡尾酒疗法 AZD7442 (Evusheld,Tixagevimab + Cilgavimab)去年 12 月获批这一适应症,2022Q1 Evusheld 销售额为 4.69 亿美元。辉瑞的 Paxlovid 同样开展了一项针对新冠暴露后预防的 II/III 期临床 EPIC-PEP 研究,不过未能达到主要终点。
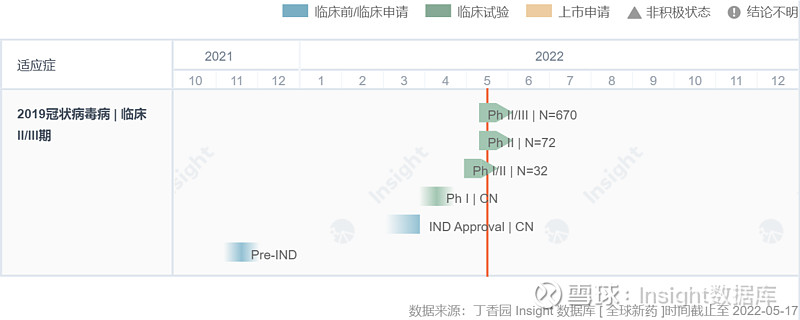
据 Insight 数据库 显示,SIM0417 最初于 2022 年 3 月已经获批临床,4 月初公示启动临床,5 月 12 日就已经启动了 II/III 期临床,联合利托那韦治疗轻至中度 COVID-19 成人患者(NCT05373433),进展飞快。
来源:Insight数据库(网页链接)
SIM0417(分子编号 SSD8432)是先声与中国科学院上海药物研究所、武汉病毒研究所合作的抗新型冠状病毒(SARS-CoV-2)候选药物。该药针对 SARS-CoV-2 病毒复制必须的 3CL 蛋白酶,是一款高活性、低毒性、可口服的小分子抗 SARS-CoV-2 候选药物。2021 年 11 月 17 日,先声药业宣布达成了这项合作,当日先声股价大涨超过 14%。
3CL 蛋白酶结构高度保守,不会随着变异而变化,因而成为是新冠药物开发的热门靶点。辉瑞的 Paxlovid (奈玛特韦 + 利托那韦)中,奈玛特韦就是一款 3CL 抑制剂。而利托那韦作为逆转录病毒药物,可减缓 3CL 蛋白酶抑制剂的代谢或分解,从而使其在体内以更高浓度保持更长时间的活性。
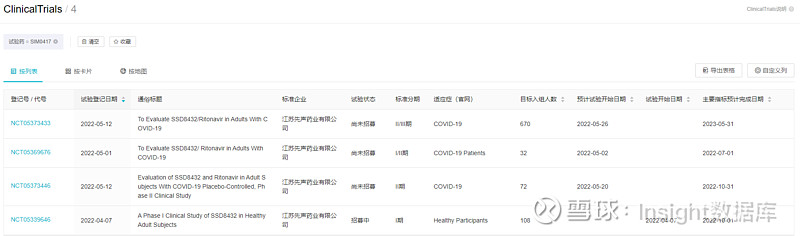
先声药业的 SIM0417 也采取了同样的联合用药方式,已登记的 4 项临床试验中除 I 期临床外均为 SIM0417 + 利托那韦联合用药。这 4 项临床共计纳入 882 例患者。
来源:Insight数据库(网页链接)
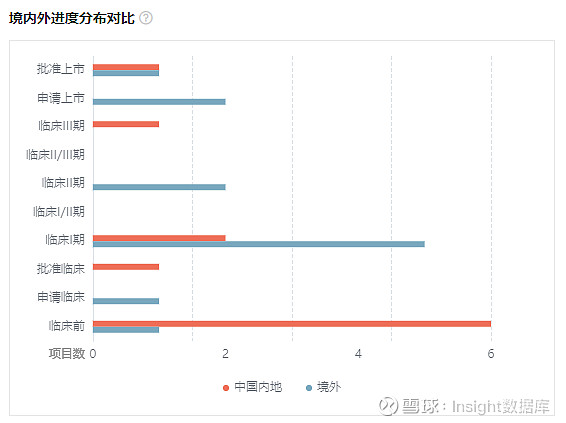
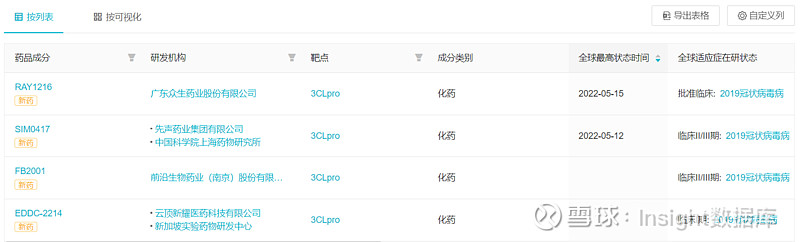
据 Insight 全球新药库 显示,全球共 35 个 3CL 蛋白酶抑制剂在研,除 Paxlovid 外,盐野义的 Ensitrelvir(S-217622)也已经在日本提交了上市申请。除了这两者之外,先声药业的 SIM0417 是进展最快的同类药物。除此之外,前沿生物的 FB2001 日前也已经获批开展 II/III 期临床,不过该药并非口服药物,而以注射给药。FB2001 同样引进自上海药物所。
临床阶段药物中,还包括 3 款临床 II 期阶段药物,5 款临床 I 期阶段药物。近期频繁的相关交易也使早期临床前项目合作不断涌现,20 个产品在临床前开发阶段,随时向临床试验发起冲击。
来源:Insight数据库(网页链接)
筛选总部位于国内的企业,共有 11 个由国内企业开发的 3CL 蛋白酶抑制剂。众生药业的 RAY1216 在 5 月 15 日刚刚获批临床,云顶新耀的 EDDC-2214 也已经启动临床。EDDC-2214 是云顶新耀在今年 1 月超 2 亿美元从新加坡实验药物研发中心(EDDC)获得的产品。另外,君实生物合作苏州旺山旺水生物医药开发的 VV993 也是期待值颇高,两家公司开发的另一款新冠口服药 VV116 已在乌兹别克斯坦申请上市,距离国内上市想必也不会太久。
来源:Insight数据库(网页链接)