3 月 24 日,NMPA 官网显示,武田制药 5.1 类进口新药 Brigatinib 获批上市(受理号:JXHS2100006/7/8)。
Brigatinib(又名:布格替尼/布加替尼)是一款二代 ALK 抑制剂,在美国 NCCN 发布的非小细胞肺癌(NSCLC)最新指南中,布吉他滨被推荐为 ALK 阳性晚期 NSCLC 一线治疗首选用药。

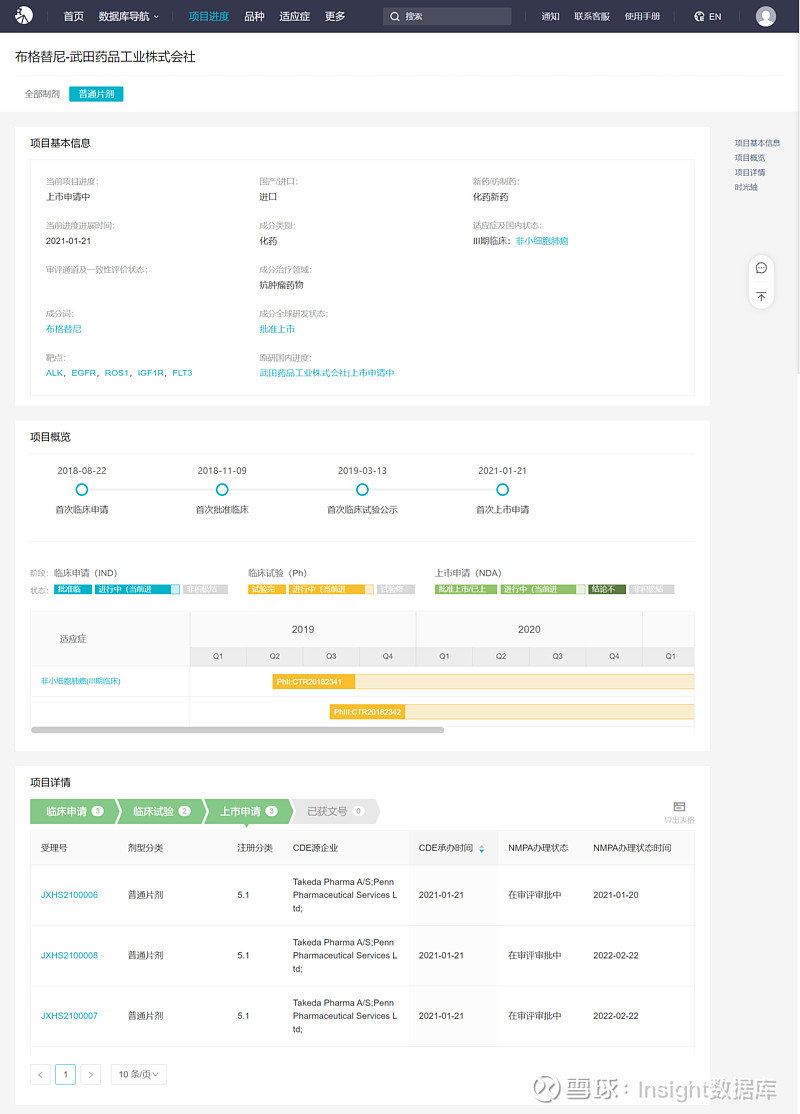
布格替尼(商品名 ALUNBRIG)由武田制药子公司 Ariad 研发,最早于 2017 年 4 月获 FDA 加速批准上市,用于治疗在克唑替尼治疗后病情出现进展或不耐受的 ALK 阳性的 NSCLC 患者;2020 年 5 月获美国 FDA 批准一线治疗 ALK 阳性转移性 NSCLC 成人患者。
FDA 批准布格替尼一线用于 ALK 阳性 NSCLC 治疗是基于 ALTA-1L 研究的结果。ALTA-1L 研究是一项 III 期、开放标签、随机对照临床研究,头对头比较了布格替尼和克唑替尼一线治疗携带 ALK 融合的晚期 NSCLC 患者的疗效及安全性。在先前未接受治疗的 ALK 阳性 NSCLC 患者中,相较于克唑替尼组,布格替尼组的 PFS 率显著增加,1 年 PFS 率分别为 67% vs 43%,疾病复发和死亡风险降低 51%(HR:0.49),客观缓解率(ORR)分别为 71% vs 60%。
基于该研究结果,在 NCCN 新发布的 NSCLC 指南中,布格替尼与阿来替尼共同被推荐为 ALK 阳性 NSCLC 一线治疗首选药物。
另外,布格替尼作为后线治疗也显示出令人惊喜的治疗潜力。在 2020 ASCO 会议中,研究者们发布了注册性临床 J-ALTA 研究的首次分析结果。这项研究共纳入全日本 28 家中心的共计 72 例患者,其中,47 例患者既往接受过阿来替尼治疗和/或克唑替尼治疗。数据显示,患者的 ORR 为 30.6%,DCR 为 78.7%,中位 PFS 为 7.3 个月,颅内 ORR 为 25%。
这一结果显示,对于阿来替尼耐药且携带 G1202R、I1171N、L1152R、L1198F、以及 V1180L 等突变的患者,布格替尼仍然具有一定的疗效。
Insight 数据库 显示,武田最早于 2018 年 8 月首次在国内递交临床申请,2019 年 3 月首次临床公示,2021 年 1 月首次递交上市申请,审评历时一年两个月。
来源:Insight数据库(网页链接)