1 月 4 日,CDE 官网显示,信立泰提交了肾性贫血新药恩那司他片的上市申请并获承办。这是一款口服活性低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),有望成为罗沙司他之后第 2 款上市的同类药物。
2019 年 12 月 26 日,信立泰自日本烟草公司(JT)引进了恩那司他(原研发代号:JTZ-951),以 2250 万美元首付款+最高 6500 万美元研发注册里程碑付款+销售里程碑款和一定比例的销售分成获得了该药在中国市场肾性贫血领域的独家技术开发、生产、市场销售及商业化权益。2020 年 9 月 29 日,该药在日本获批上市。
恩那司他是由 JT 研发的一款口服活性低氧诱导因子脯氨酰羟化酶抑制剂 (HIF-PHI),适应症为肾性贫血。相较现有疗法,恩那司他片改善贫血机制明确,既可促进内源性促红细胞生成素的生成,也可改善铁的利用;且具有良好的安全性和有效性,可显著提高患者依从性。
肾性贫血是慢性肾脏病(CKD)患者中最常见的并发症之一,我国 CKD 患病率约占成年人群的 10.8%(约 1.2 亿人),其中 50% 以上的患者合并贫血。目前,肾性贫血的标准治疗方法为促红细胞生成素(EPO)替代药物(如红细胞生成刺激剂等)联合静脉铁剂,皮下注射给药治疗,但现有治疗方案存在治疗及达标率均低、患者依从性差等诸多局限。
此前,同类药物罗沙司他在美国曾因为临床数据更改事件引发质疑,最终遭到 FDA 拒绝批准。不过,修正后的新数据并没有改变以前对于透析和非透析患者使用罗沙司他的非劣效性结论,但其心脏安全性优势不复存在。各国对该药也是态度不一——罗沙司他全球首批在中国,日本、韩国和智利也批准了该药,在美国 FDA 拒批之后,欧盟仍然给出了肯定答复,批准了该药在欧洲上市。
附:信立泰引进公告:网页链接
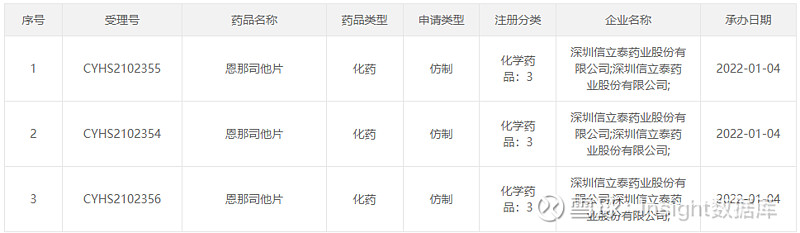
本次信立泰的恩那司他以 3 类仿制申报上市,不过此前在临床开发阶段,该药均是按 1 类新药申报,详见下图:
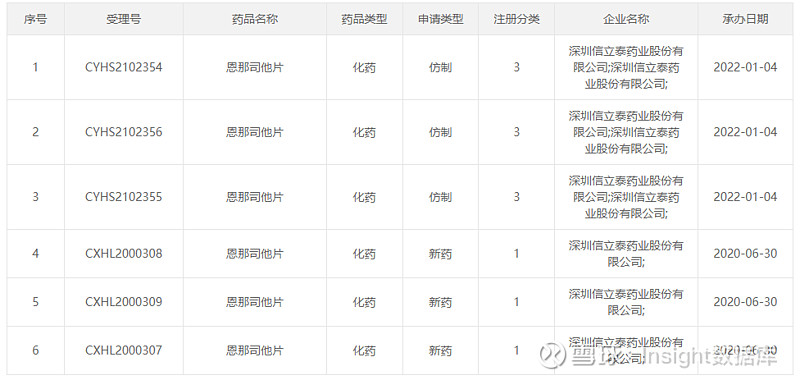
来自:CDE官网
$信立泰(SZ002294)$ @今日话题
精彩讨论
Alpha_hou2022-01-04 14:28化学药品新注册分类共分为5个类别,具体如下:
1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
4类:境内申请人仿制已在境内上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
5类:境外上市的药品申请在境内上市。
3类属于仿制药,但因国内没有上市,所以我国规定按新药管理,颁发新药证书。
道_法_自然2022-01-04 17:29国内报临床的时候,日本原研还没有上市,所以是1类申报。但是,去年日本原研批产啦,现在国内再报产,按法规就是3类。如果日本原研今天还没有批产,国内报产肯定还是1类。有专利保护,这个分类对审评,商业化和医保谈判都没有影响。
一大杯奶茶2022-01-04 15:10化学药品新注册分类共分为5个类别,具体如下:
1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
4类:境内申请人仿制已在境内上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
5类:境外上市的药品申请在境内上市。
3类属于仿制药,但因国内没有上市,所以我国规定按新药管理,颁发新药证书。
Insight数据库2022-01-04 14:36可以看CDE(截图或者CDE官网),3类仿制药是CDE给的定义,这款药以注册分类3类申报上市的,但是理论上信立泰引进应该是申报新药,之前临床申请也都是按1类新药报的。所以这点小编暂时也没太明白,先同步一下CDE的信息。
秋天来了772022-01-04 14:23不谈恩那斯他是什么药,先解释下什么叫三类仿制药
全部讨论
化学药品新注册分类共分为5个类别,具体如下:
1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
4类:境内申请人仿制已在境内上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
5类:境外上市的药品申请在境内上市。
3类属于仿制药,但因国内没有上市,所以我国规定按新药管理,颁发新药证书。
国内报临床的时候,日本原研还没有上市,所以是1类申报。但是,去年日本原研批产啦,现在国内再报产,按法规就是3类。如果日本原研今天还没有批产,国内报产肯定还是1类。有专利保护,这个分类对审评,商业化和医保谈判都没有影响。
化学药品新注册分类共分为5个类别,具体如下:
1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
4类:境内申请人仿制已在境内上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
5类:境外上市的药品申请在境内上市。
3类属于仿制药,但因国内没有上市,所以我国规定按新药管理,颁发新药证书。
这个新3类仿制药分类好 做出1款1类创新药着实不容易,耗费10年以上的研发投入才能成功,如果引进1款国外的新药,不到2年就上市,获得与自主研发的1类新药同样的分类称呼,对自主研发的1类新药来说是不公平的。这样分类就很容易区分是自主研发还是引进的新药了。
我斗胆猜测一下原因,恩那司他片新药引进临床试验因各种原因还未出结果,但因为已经支付了引进费用,获得了原研厂家默许,可以先以仿制药方式申请,这也是某些人为什么知道周二、或者周三会发公告的原因。仿制药申请,你只要提交相应资料,cde就受理,信立泰提交恩那司他片资料,那不是手到擒来,哪天想发公告就提交资料呗,为了维护股价,也是够拼的啊,为什么那么多人搞不明白,因为前面还没有人这么搞过,信立泰这也算创新了
根据新药品分类,新3类为仿制境外上市但境内未上市原研药的药品,具有与原研药品相同的活性成份、剂型、规格、适应症、给药途径和用法用量的原料药及其制剂。由于原研药未在国内上市,通常情况下除进行仿制药BE临床试验外,可能还会进行PK临床,用以证明该药物的有效性,消除人种等因素的影响。

