5 月 24 日,CDE 官网公示,拟将武田「Mobocertinib胶囊」纳入优先审评审批,用于治疗既往接受过化疗且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。目前,国内尚无产品获批用于这一突变类型。

来源:CDE官网
Mobocertinib(TAK-788)是一种小分子酪氨酸激酶抑制剂(TKI),旨在选择性靶向EGFR和HER2外显子20插入突变。2020年4月,美国FDA授予mobocertinib突破性疗法认定,用于治疗携带EGFR外显子20插入突变的非小细胞肺癌患者,这些患者在接受铂基化疗后疾病依然进展。去年9月30日被CDE纳入突破性治疗品种,申请的适应症为:治疗既往至少接受过一次全身化疗的携带EGFR 20号外显子插入突变的局部晚期或转移性非小细胞肺癌患者。
根据公开资料,在一项针对携带EGFR外显子20插入突变、且既往接受过全身化疗的局部晚期或转移性NSCLC患者的1/2期临床研究中,mobocertinib的治疗使患者的中位无进展生存期(PFS)达到7.3个月,总缓解率(ORR)达到43%。正是基于这一出色的结果,美国FDA授予了mobocertinib突破性疗法认定。基于此,武田将开展2期和3期临床试验,检验TAK-788在治疗这一特定NSCLC患者群的疗效。
根据 Insight 数据库,目前 TAK-788 已在全球登记开展了 10 项临床试验,并在国内获批两项临床,用于治疗携带 EGFR 20 号外显子插入突变的局部晚期或转移性非小细胞肺癌患者。此前,美国 FDA 已授予 TAK-788 孤儿药资格和突破性药物资格。
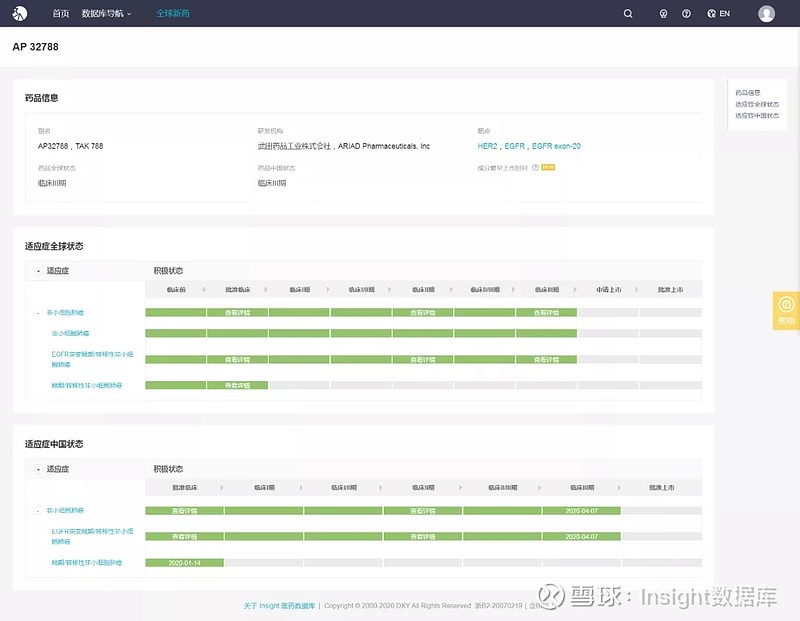
来源:Insight数据库(网页链接)
而目前国内在研的EGFR和HER2外显子20插入突变产品有6种,来自6家企业,其中以武田的研发进展最快,其次是韩美和迪哲,正在进行Ⅱ期临床。
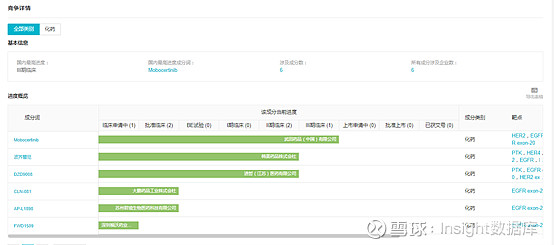
来源:Insight数据库(网页链接)