今日,阿斯利康宣布自愿撤回其 PD-L1 单抗 Imfinzi(durvalumab,度伐利尤单抗)在美国的膀胱癌二线治疗适应症。据企业表示,这项决定是与 FDA 协商共同作出的,原因是其 III 期临床 DANUBE 研究未达到改善先前接受过铂类化疗膀胱癌患者 OS 的临床终点。此次膀胱癌适应症的撤回不影响 Imfinzi 在美国境外该适应症的获批和使用。

Imfinzi 是一种人单克隆抗体,可与 PD-L1 结合并阻断 PD-L1 与 PD-1 和 CD80 的相互作用,从而对抗肿瘤的免疫逃逸,释放对免疫反应的抑制作用。PD-L1 在膀胱癌患者的肿瘤和免疫细胞中广泛表达,在该癌种的免疫逃逸机制中起重要作用。
2017 年 5 月,FDA 基于 I/II 期临床 1108 研究中良好的肿瘤应答率和缓解持续时间数据加速批准 Imfinzi 治疗晚期膀胱癌患者,III 期 DANUBE 试验作为加速批准后的确证性临床而开展,决定 Imfinzi 的正式批准。DANUBE 研究评估了 Imfinzi 单药及联合抗 CTLA-4 单抗 tremelimumab 与标准化疗方案相比在膀胱癌患者人群中的疗效。然而 2020 年 3 月,阿斯利康宣布该研究未能达到终点,两种疗法均未改善膀胱癌患者的总生存(OS)。
阿斯利康肿瘤业务部门执行副总裁 Dave Fredrickson 表示,Imfinzi 在这种适应症中的撤出令人失望,但指出该公司尊重「 FDA 建立加速批准途径时制定的原则」。弗雷德里克森在一份声明中说: 「在过去三年中,Imfinzi 已成为多种肺癌的重要治疗方案,这是阿斯利康关注的重点领域。」
在美国,Imfinzi 已被批准用于非小细胞肺癌,广泛期小细胞肺癌。Imfinzi 还被一些国家批准用于先前接受治疗的晚期膀胱癌患者。
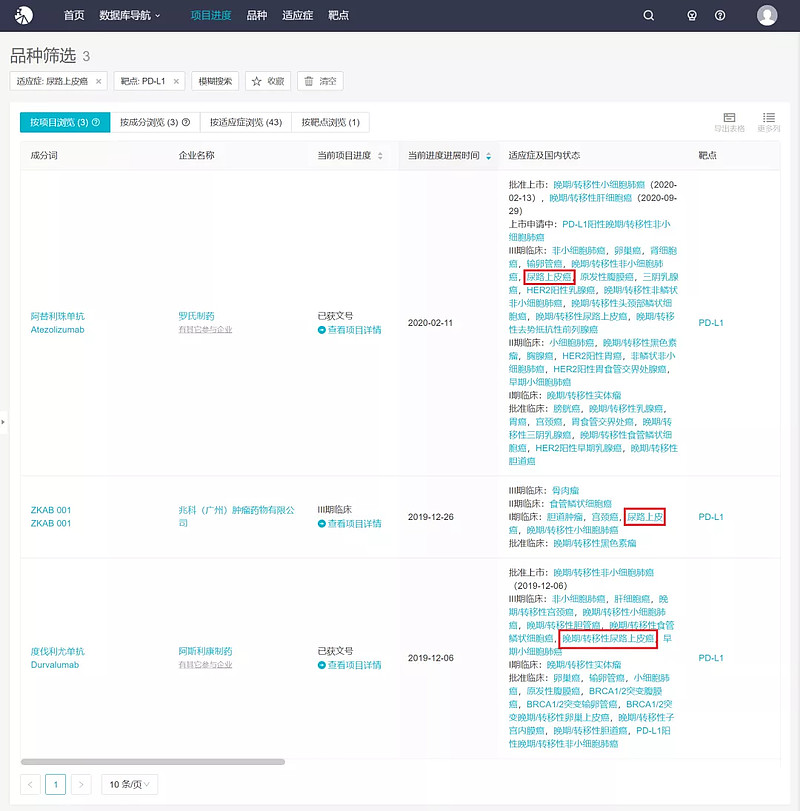
而在国内,度伐利尤单抗最早于 2019 年 12 月 6 日获批,目前仅获批一项适应症,用于在接受铂类药物为基础的化疗同步放疗后未出现疾病进展的不可切除、III 期非小细胞肺癌 (NSCLC) 患者的治疗。其膀胱癌适应症尚处于 III 期研究中。此外,目前国内仅 3 款 PD-L1 单抗有该项适应症在研,除度伐利尤单抗外,还有罗氏的阿替利珠单抗和兆科的 ZKAB001,前者处于 III 期临床,后者处于 I 期临床。
来自 Insight 数据库(网页链接)