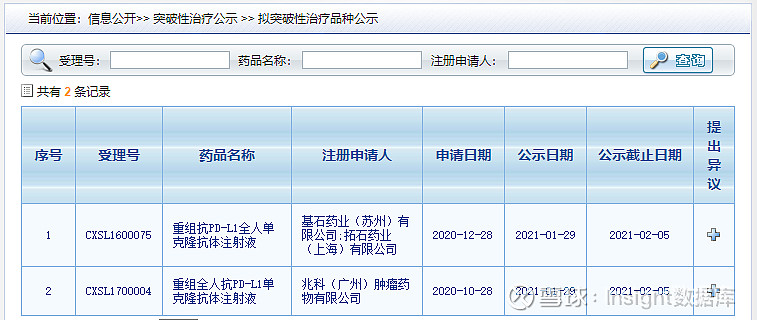
1 月 29 日,CDE 最新公示更新,拟将基石药业的 PD-L1 单抗和兆科药业的 PD-L1 单抗纳入突破性疗法程序。
基石药业「舒格利单抗」
中美突破性疗法「双认定」
舒格利单抗(CS1001)是由基石药业开发的一款潜在同类最优的抗 PD-L1 抗体,是基于 OmniRatt® 转基因动物平台开发的一款全人源 IgG4 单抗药物。本次拟突破性疗法的适应症为复发或难治性结外自然杀伤细胞╱T 细胞淋巴瘤 (R/R ENKTL) ,此前该适应症已被美国 FDA 授予突破性疗法认定。
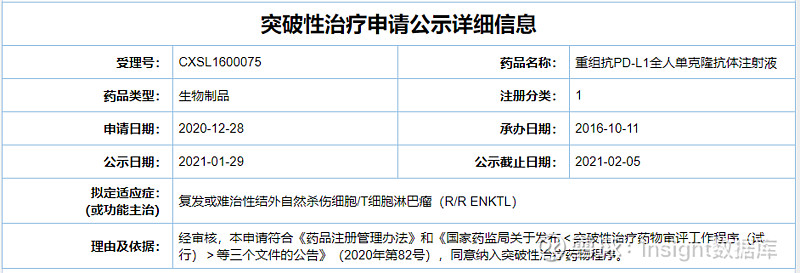
基石药业在 2020 CSCO 会议上口头报告了其针对 R/R ENKTL 的注册临床研究数据。CS1001-201 研究是一项评价舒格利单抗单药治疗R/R ENKTL的单臂、多中心、2 期研究。数据显示,截至 2020 年 7 月 1 日,在 38 例疗效可评估患者中,主要研究终点客观缓解率为 44.7%,完全缓解率为 31.6%,中位缓解持续时间(mDoR)为 16.8 个月,67.8% 的缓解持续时间超过一年。接受给药的 43 例患者,中位总生存期 19.7 个月,1 年生存率为 55.5%。
此外,基石药业还就非小细胞肺癌、胃癌和食管癌等多个大癌种开展临床试验。Insight 数据库显示,其目前已在国内开展 8 项临床,其中一线治疗非小细胞肺癌适应症进展最快,已达到终点并报上市。此外,食管鳞癌、胃癌适应症也已处于 III 期临床阶段。
舒格利单抗项目概览(Insight)
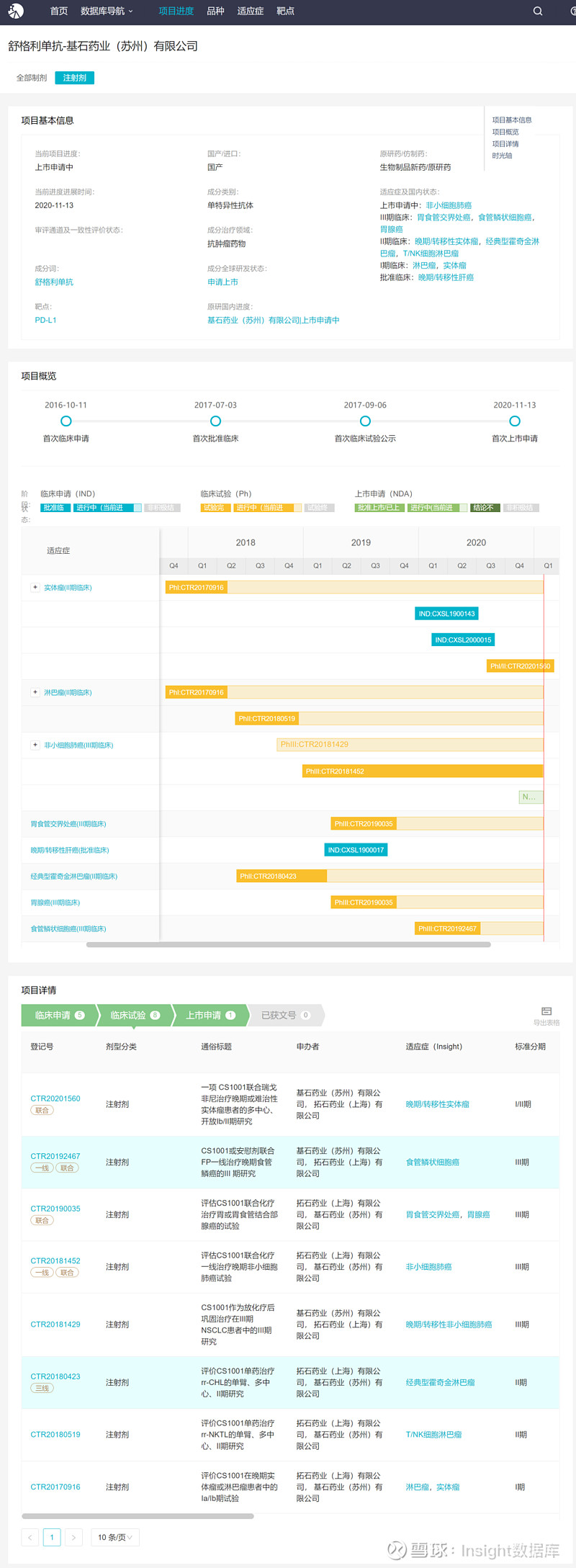
来自 Insight 数据库(网页链接)
兆科药业 ZKAB 001
宫颈癌新疗法
ZKAB001 是李氏大药厂子公司兆科药业自美国 Sorrento Therapeutics 公司引进的一款针对肿瘤免疫检查点的全人源 PD-L1 单克隆抗体(mAb)。本次拟突破性疗法的适应症为:接受过一线含铂方案失败或不能耐受的复发转移性宫颈癌。
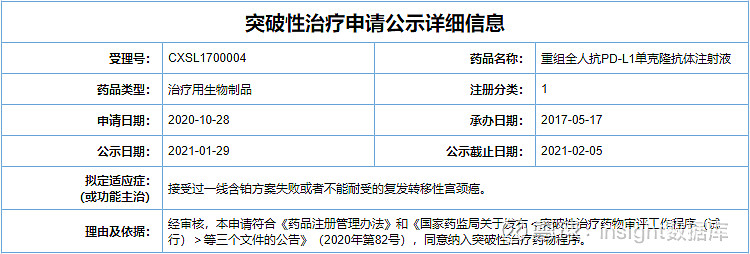
李氏大药厂早于 2020 年 7 月即公开宣布向 NMPA 递交该项突破性治疗认证申请,成为最早响应突破性疗法文件的企业之一。如今,ZKAB001 顺利亮相于 CDE 突破性疗法栏目中。突破性疗法认定将赋予该项目更多的 CDE 沟通交流和指导机会,加速该项目的临床开发,助力该药上市进程。
根据 Insight 数据库,该项目最早于 2017 年 5 月即已递交临床申请,2018 年 1 月首次获批临床,迄今已开展了 8 项临床试验,涉及多个癌种,包括骨肉瘤、食管鳞状细胞癌、宫颈癌、尿路上皮癌、小细胞肺癌、黑色素瘤,进展最快的为骨肉瘤适应症,已进展至 III 期临床。本次拟突破性疗法的宫颈癌适应症目前尚处于 I 期临床阶段。
ZKAB001 项目进度概览 ▼
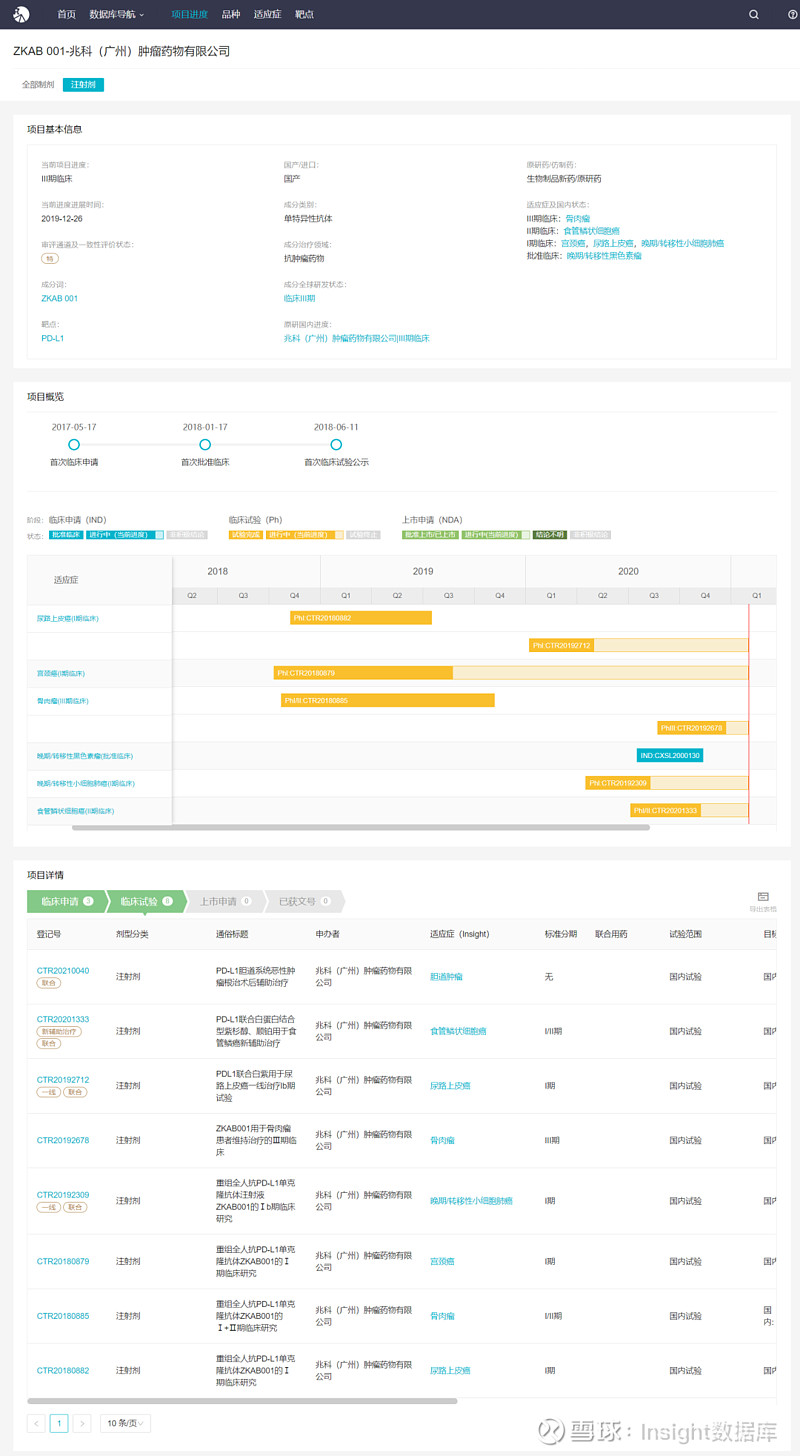
来自 Insight 数据库(网页链接)
诚心合作,非诚勿扰
PR 稿对接:请加微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
数据库合作:请加微信 yiyaoshujuku001

点击阅读原文
微信申请试用数据库 30 天
