5 月 14 日,武田中国宣布, 安适利®(注射用维布妥昔单抗)正式获国家药监局批用于成人 CD30 阳性的复发或难治性系统性间变性大细胞淋巴瘤(sALCL)和经典型霍奇金淋巴瘤(cHL)的治疗。

维布妥昔单抗(Brentuximab vedotin,Adcetris)是由武田制药和美国西雅图遗传学公司联合开发的一种抗体偶联药物(ADC),由靶向 CD30 蛋白的一种单克隆抗体 brentuximab 和一种微管破坏剂(单甲基 auristatin E,MMAE)通过一种蛋白酶敏感的交联剂偶联而成,其中该偶联技术为西雅图遗传学公司的专有技术。
目前,维布妥昔单抗在美国已经批准了多种适应症,包括经典霍奇金淋巴瘤(cHL)、间变性大细胞淋巴瘤(ALCL)和外周 T 细胞淋巴瘤(PTCL)和蕈样肉芽肿(MF)等, 是近 40 年来 FDA 批准的第一个 ALCL 新药,也是第一个针对 cHL 和 PTCL 的一线治疗药物。
图片来源:Insight 全球新药数据库库(网页链接)
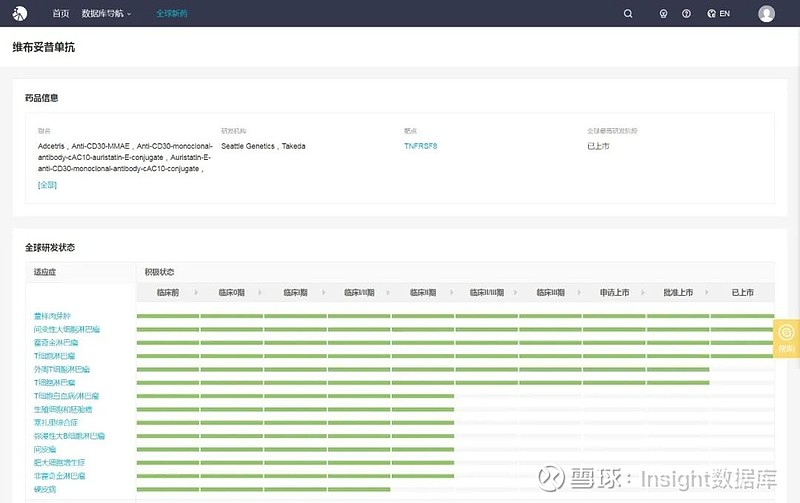
2019 CSCO 会议上,北京大学肿瘤医院的宋玉琴教授公布了维布妥昔单抗在我国患者人群中的最新数据——其在 cHL 和 sALCL 患者中的总有效率均达到 70% 左右,且长期随访的无进展生存(PFS)数据也很好,此外安全性也很好。
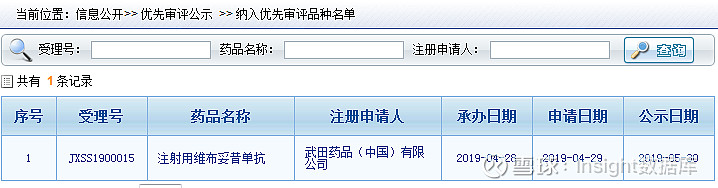
2019 年 4 月,CDE 受理了维布妥昔单抗的上市申请,并将其纳入优先审评品种名单,据其在国内进行的临床试验,笔者猜测申报的适应症是复发性/难治性 CD30 阳性霍奇金淋巴瘤(HL)或系统性间变性大细胞淋巴瘤(sALCL)。
若维布妥昔单抗顺利获批,将成为 2020 年武田制药在国内获批的第二款药物,而武田 2020 年在国内获批的第一款药物——维多珠单抗,已于 3 月 11 日被 NMPA 批准用于溃疡性结肠炎和克罗恩病,此外,据 Insight 数据库,武田高血压药物美阿沙坦钾片的上市申请(受理号 JXHS1800027、28)已经处于化学药二部,预计今年也有望获批。

全球已获批 8 款 ADC 药物
ADC 药物是由单克隆抗体、偶联链(linker)和细胞毒性小分子药物三部分组成,它的出现填补了抗体药物和传统化疗药物之间的空白,已成为国内外抗体药物研发的新方向。
截至目前,全球已经批准了 8 款 ADC 药物,其中罗氏的恩美曲妥珠单抗,表现最好,2019 年销售额高达 13.93 亿瑞士法郎,而且该药已于今年 1 月分在国内获批,商品名为赫赛莱,适应症为单药用于接受紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的 HER2 阳性早期乳腺癌患者的辅助治疗。
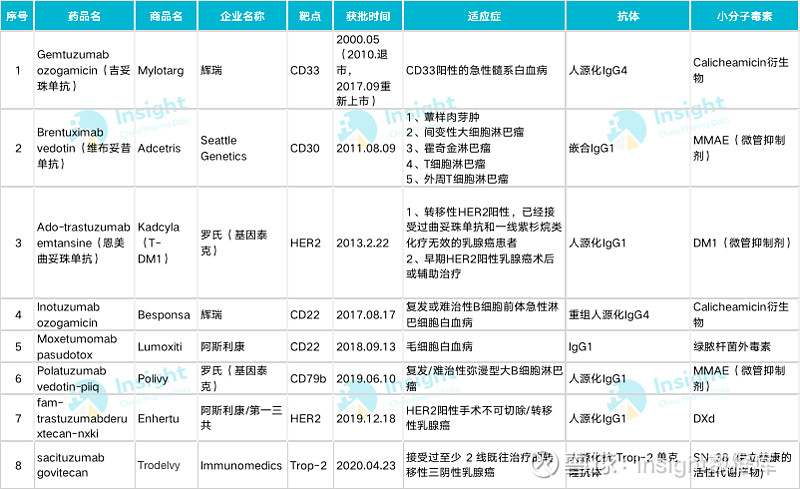
在国内,除了罗氏恩美曲妥珠单抗以及即将获批的武田的维布妥昔单抗,辉瑞也已递交了靶向 CD22 的伊珠单抗奥唑米星的上市申请(JXSS2000001)。
而且随着我国新药研发能力的提升,目前已有多家企业布局 ADC 领域,其中百奥泰的 BAT8001 进展最快,处于 III 期临床阶段,荣昌生物的 RC48-ADC 处于 II 期临床阶段,科伦药业的 A166 处于 I/II 期临床阶段,而恒瑞医药、东曜药业、浙江医药、特瑞斯等企业 10 余个项目正处于 I 期临床阶段。

Insight 线上讲堂第14期开课!本期特邀泰格益坦质量保证与培训副总监马莹做《MAH制度下药物警戒体系的构建及实施》的分享,深度剖析相关法规,建立健全药物警戒体系,探讨体系建设的发展与未来!扫码报名,抢先占位!
点击阅读原文
查看维布妥昔单抗审评时光轴
