撰文|medium
编辑|于靖
12月19日,注定成为T细胞疗法历史中里程碑的一日。
在这一天,Atara Biotherapeutics迈出了公司发展的一小步——首款药物获批上市;却也是T细胞疗法的一大步——现货型细胞疗法终于得以明确的临床验证,是可行且可预期的方向。
新闻稿中,Atara与Pierre Fabre联合宣布,欧盟委员会(EC)批准其现货型T细胞免疫疗法Ebvallo(tabelecleucel)上市。
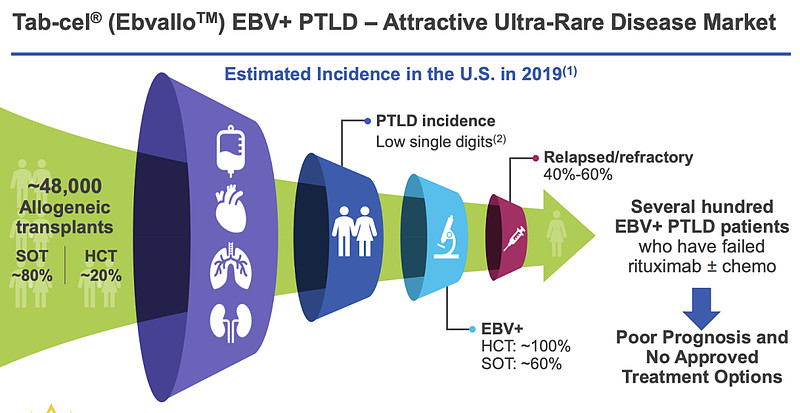
该药物将作为单药治疗EB病毒(EBV)相关的移植后淋巴增殖性疾病(EBV+PTLD),适用于之前至少接受过一次治疗的成人及2岁及以上儿童患者,而对于实体器官移植患者,先前的治疗方式中需包含化疗,除非化疗不宜使用。

PTLD是一种罕见且可能致命的急性血液癌症,是实体器官移植(SOT)或同种异体造血细胞移植(HCT)后,持续免疫抑制导致的淋巴细胞或浆细胞异常增生性疾病,发病率约为1%-30%。
在对其发病机制研究中,Atara发现EBV起着关键作用。其实,EBV感染并不少见,根据相关统计,约有90%以上的成年人都感染过EBV。感染后,EBV会潜伏在外周血B淋巴细胞中,在免疫系统正常情况下,激活的特异性T细胞会阻止B淋巴细胞过度增殖。
以HCT为例,为预防移植物抗宿主病(GvHD)发生,常常需要加强免疫抑制。这就会导致EBV特异性T淋巴细胞功能受损或缺失,使得B淋巴细胞过度增殖,由此最终导致PTLD发生。
据悉,在标准治疗失败的EBV+PTLD患者中,HCT和SOT后的中位生存期分别仅为0.7个月和4.1个月。对于这类治疗失败的患者,可用治疗方案极其有限,凸显出该领域对新疗法的紧迫临床需求。
Ebvallo斩获了多项“首次”——它不仅是全球首款异体T细胞疗法,也代表着欧洲对罕见的致命癌症EBV+PTLD首次开绿灯。
作为一种同种异体T细胞免疫疗法,Ebvallo以人类白细胞抗原(HLA)限定的方式靶向受EBV感染的细胞。这种操作的优势在于,只需要最少的HLA匹配;直接靶向EBV驱动的疾病源头起效;不需要对TCR进行基因编辑,安全性良好。
2015年2月,Ebvallo获得美国FDA授予用于治疗HCT后产生EBV+PTLD的突破性疗法认定(BTD)。Ebvallo也被欧洲药品管理局(EMA)授予相同适应症的PRIME指定。而在美国和欧洲,Ebvallo都被指定为孤儿药。
刚过去的2022年ASH大会上,Atara公布了Ebvallo的III期ALLELE试验结果:在R/R EBV+PTLD患者中,ORR达到50%;超过75%的应答者存活1年。
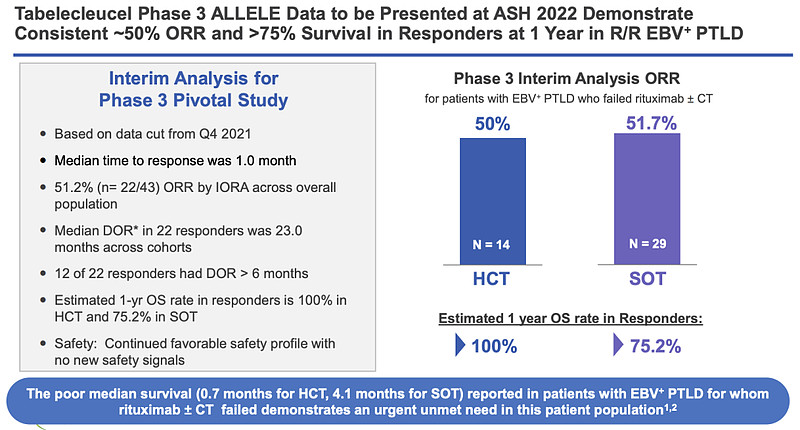
而根据2021年ASH大会上的数据,Ebvallo也表现出优异的长期生存期获益——CR和PR患者的2年总生存率相似,分别为86%和87%;中位OS期大约为55个月。
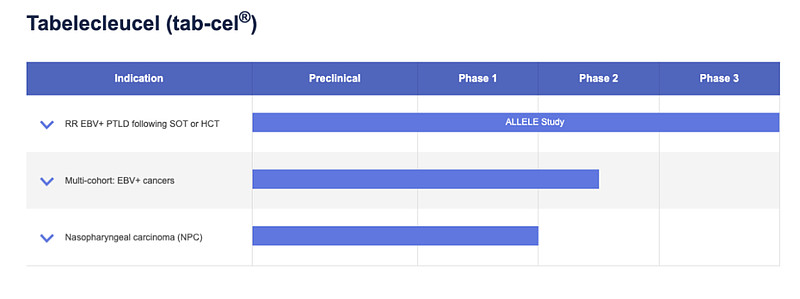
除此之外,Atara还致力于推进Ebvallo在鼻咽癌、其他与EBV相关癌症适应症中的应用。
那么,欧洲的率先获批是否寓意着FDA“叩门”的顺利?目前尚且不能下确切的结论,但有分析师认为影响不大,“因为FDA会定期关注其他监管部门的动作”。
在先前与FDA的沟通中,FDA建议了BLA的可能途径,而不需要进行新的临床试验。具体细节,Atara将于本季度末公布。如果进展顺利,有望可以在2023年看到这款药物登陆美国市场。
在商业化合作伙伴方面,近日Atara与Pierre Fabre修订了商业化授权协议——因Ebvallo获得欧盟批准,Atara将有资格收到3000万美元的里程碑付款。
根据协议,Pierre Fabre将在欧洲和“其他选定市场”主导该药物的商业化和分销。此外,当Atara完成市场授权转移之后,Pierre Fabre还需要负责Ebvallo的医疗和监管活动。
而关于最为令人关注的定价策略,现阶段Atara尚未有任何消息披露。相比动辄40多万美元的CAR-T细胞疗法和210万美元的基因疗法Zolgensma等定制疗法的“天价”,现货型T细胞疗法的价格可能将会“亲民”得多。
参考文献:
1.Atara makes history with world-first nod for allogeneic T-cell therapy Ebvallo;fiercepharma
2.Atara官网新闻稿
3.Atara:Investor Presentation November 8, 2022
4.移植后EB病毒相关淋巴细胞增殖性疾病研究进展;医脉通