
撰文丨medium
编辑丨于靖
2022年还未过半,致力于PI3K抑制剂研发的药企们已逐步分化,几家欢喜几家忧。
1月,上市六年的PI3Kδ抑制剂idelalisib被吉利德撤出某些适应症市场;紧跟着,Incyte宣布撤回PI3Kδ抑制剂Parsaclisib的IND;再到3月,FDA打回MEI Pharma的zandelisib上市申请。
与前三个月的萧条相比,4月初,诺华宣布其PI3Kα抑制剂alpelisib(Piqray)因对PIK3CA相关的过度生长谱(PROS)的治疗有明显的益处而获得FDA加速批准,提振市场对PI3K抑制剂的信心。
相关阅读:
行业似乎要重新审视PI3K领域的机会与挑战。4月21-22日,FDA召开肿瘤药物专家咨询委员会(Oncologic Drugs Advisory Committee,ODAC)会议,就PI3K抑制剂在血癌领域未来的临床试验设计进行讨论投票。
16票赞同vs0票反对,1票弃权。ODAC几乎是全员赞同,PI3K抑制剂的批准需要基于随机数据而不是单臂临床试验。此前已上市的四款PI3K抑制剂——吉利德的Zydelig、拜耳的Aliqopa、Secura Bio的Copiktra和TG的Ukoniq——的血癌适应症均是基于单臂批准。诺华的Piqray用于乳腺癌和PROS治疗,暂不在讨论范围内。
01 PI3K抑制剂开发中的问题
PI3K抑制剂可调节多个细胞过程,包括细胞生长、增值、分化和新陈代谢等。血癌中可见其信号通路的激活——失调的PI3K信号传导促进了恶性淋巴细胞的存活和增殖。
目前,PI3K抑制剂在血癌领域已获批的适应症,包括慢性淋巴细胞白血病 (CLL)、小淋巴细胞淋巴瘤(SLL)、滤泡性淋巴瘤(FL)和边缘区淋巴瘤 (MZL),非霍奇金淋巴瘤(NHL)适应症正在开发中。
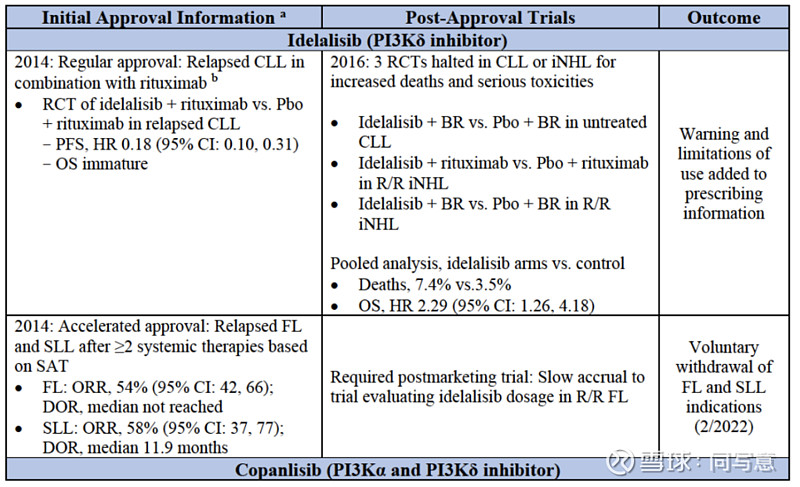
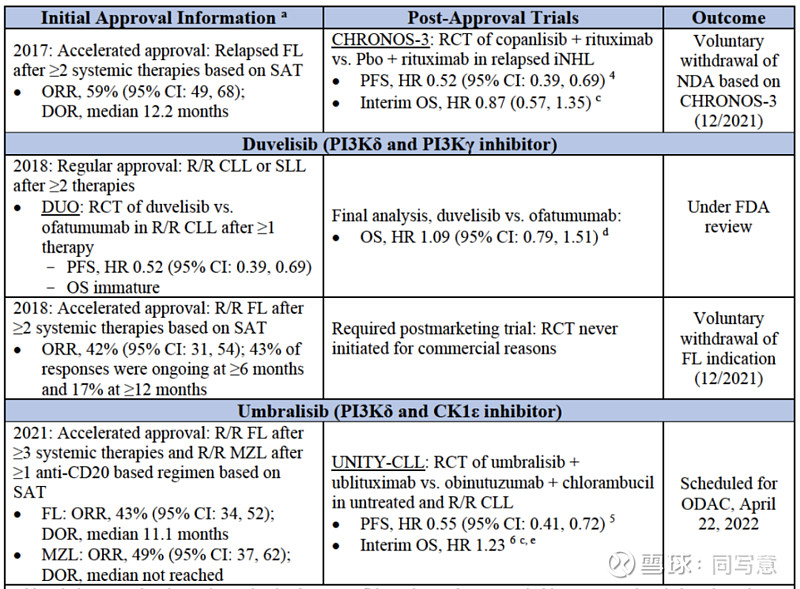
在PI3K抑制剂的研究中,存在三个维度的问题。对改善这些限制的追求,促使行业对PI3K抑制剂试验设计的进行改革。
▌总体生存率(OS)
OS被认为是临床获益的客观衡量标准,是临床试验的最终终点。当研究可充分评估生存率时,OS通常为首选终点。然而在实际临床试验中,OS的评估限制颇多,试验人员不得不退而求其次,选择ORR和PFS等其它作为终点。
在上图列举出的PI3K抑制剂的随机试验中,表现出了较高的死亡率,或者OS结果表示,药物对患者存有潜在危害作用。而ORR和PFS数据,却展现药物的获益。
以Zydelig为例,其在2014年进行了一项双盲、安慰剂对照的随机试验,该试验对比了Zydelig+rituximab和安慰剂+rituximab的疗效。因为达到了PFS终点,Zydelig获得复发CLL适应症的批准。但随后,由于Zydelig组出现严重毒性增加和死亡率上升,三项评估Zydelig联合疗法的随机试验被叫停。
在PI3K抑制剂试验中,与安全性相关的OS分析通常都是描述性表述,只有1/6的PI3K抑制剂包括对OS的正式假设试验(Copiktra)。无论如何,对于以PFS为终点的随机对照试验,FDA现在要求提交OS数据。
▌毒性问题
在多项评估PI3K抑制剂作为单药或与CD20抗体、化疗等联合使用的随机试验中,PI3K抑制剂表现出的毒性无法令人忽视。
在几乎所有的随机对照试验中,PI3K抑制剂组的致命不良事件(AEs)、严重不良事件(SAEs)、3级或更高级别的AE以及因AE而不得不调整试验或者中断试验的比率都显著增加。
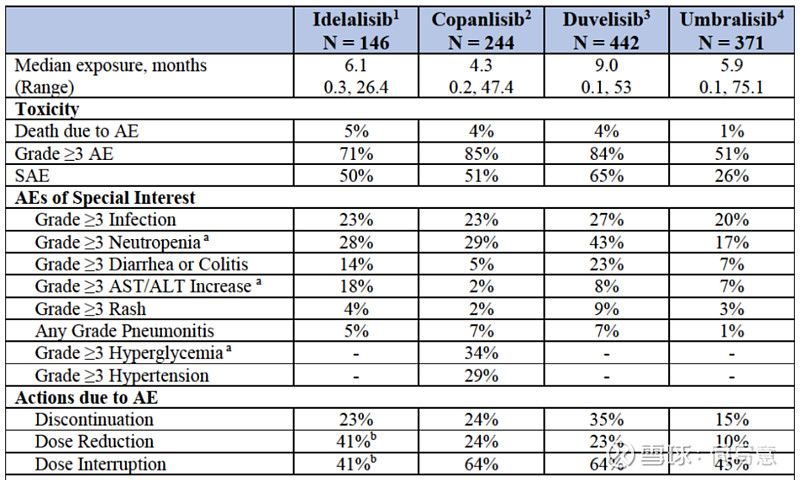
PI3K抑制剂作为单一疗法的毒性
尽管如此,在PI3K抑制剂的开发过程中,仍然未对患者报告的症状进行早期且全面的测量。为了降低风险,保证PI3K抑制剂在预期患者身上可以安全有效使用,PI3K抑制剂的获批通常伴随着一系列的黑框警告、注意事项和风险评估。
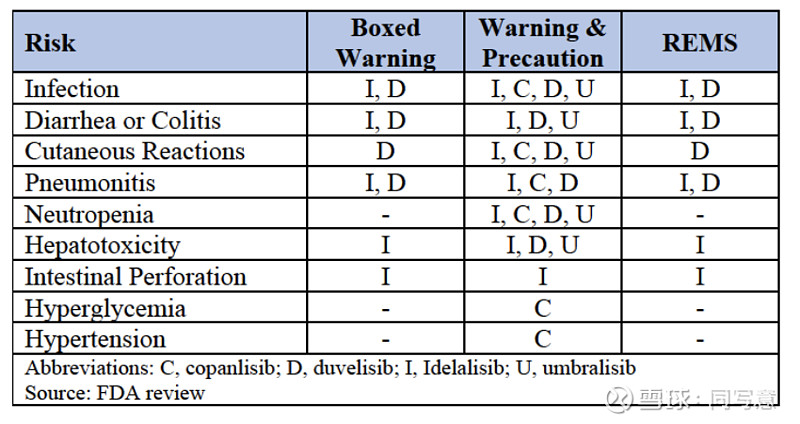
▌剂量问题
药物开发的早期就应该确定药物剂量。理想情况下,应当收集足够的信息来平衡最大功效和最小毒性,对于像PI3K抑制剂这种毒性和有效剂量分界线不明显的药物来说,这点尤为重要。
剂量优化需要收集到足够的药代动力学、药效学、安全性和活性数据等信息,PI3K抑制剂难以进行剂量优化的原因在于不容易确定最大耐受剂量(MTD)。MTD的确认是基于假设——能达到最大疗效的患者所能接受的最高剂量。
但是这种方法可能会错过对较低剂量的探索,不排除低剂量药物可带来疗效和低毒性的可能性。
02 单臂试验的局限性与改进策略
最初,FDA考虑来自单臂试验的数据,是为了支持患有严重和危及生命的疾病,同时有强烈未满足临床需求的患者的治疗。但单臂数据存在明显的固有局限性。
安全性评估问题是首要考虑的因素。在没有比较臂的情况下,观察到的副作用可归因于药物或潜在疾病,难以确定究竟是哪方因素导致。与此同时,单臂试验的随访期相对较短,因此评估长期安全性可信度有限。
其次,在于疗效评估。单臂数据的疗效评估是基于历史对照,或者是在一些不甚健康且具有已知局限性的人群中进行,反应率可能无法准确预测真实的临床获益率。FDA在简报中强调,单臂试验无法准确解释PFS和OS等与时间相关的临床终点数据。
对效益风险评估方面,在单臂试验中,难以平衡在目标人群中观察到的功效与毒性,难以真实评估风险-收益。
来自单臂试验的临床数据限制了对疗效和安全性的解释。而随机试验是控制混杂因素的最有效方法,因此是研究风险-收益的最佳方法。FDA认为,对治疗和对照的随机分配将为已知和未知因素提供公正的比较。
科罗拉多大学胃肠内科肿瘤学项目主任Christopher Lieu在ODAC会议中投了赞同票,他认为,如果治疗让患者暴露在毒性之下,在没有延长患者的生命长度基础上,反而降低患者的生活质量,这并不是真的帮助患者。
ODAC此次会议讨论的问题,仅限于PI3K抑制剂在血液系统恶性肿瘤方面的未来发展,同时,讨论的结果可以为PI3K抑制剂在其他领域的发展,提供思考的可能性。
唯一投弃权票的ODAC成员是杜克大学医学院副教授Anthony Sung,他认为未来无法预测,因此对可能会影响未来临床发展的事情保持沉默。
“如果未来开发的PI3K抑制剂拥有惊人的单臂数据,在那种情况下,我们还需要进行随机试验吗?”Sung问道。
FDA血癌部门主任Gormley回应说,加速药物开发,为患者提供新疗法是共有期盼,前提是,必须保证产品的安全性和有效性。单臂试验并不是获批的唯一途径。
参考资料:
1.网页链接
2.网页链接