3月8日,礼来宣布FDA将召开外周和中枢神经系统药物咨询委员会(PCNS)会议,以讨论TRAILBLAZER-ALZ 2 III期研究。该研究评估了Donanemab在早期症状性阿尔茨海默病中的疗效和安全性。

Donanemab是一款与β淀粉样蛋白亚型N3pG结合的单克隆抗体,能够与阿尔茨海默病患者大脑中沉积中的β淀粉样蛋白结合,从而促进患者大脑中淀粉样蛋白斑块的清除。
不过,FDA尚未确定Donanemab的PCNS会议召开时间,因此决定先将Donanemab的PDUFA时间由2024年Q1推迟至2024年Q1之后。
FDA希望进一步了解与评估Donanemab的安全性和有效性相关的材料,包括接受Donanemab治疗患者的安全性数据以及TRAILBLAZER-ALZ 2研究的独特试验设计对疗效带来的影响。
TRAILBLAZER-ALZ 2研究是一项随机、双盲、安慰剂对照的III期临床试验,主要分析人群(n=1182)为tau蛋白水平中等且有明显AD临床症状患者。主要终点是AD综合评定量表(iADR,评估患者的认知能力和生活自理能力)评分从基线到18个月的变化,关键次要终点包括基线至18个月的临床痴呆评定量表(CDR-SB,评估患者的认知能力)评分、AD协作研究日常生活能力量表(ADCS iADL)评分、AD认知量表(ADAS-Cog13)评分的变化等。
结果显示,与安慰剂组相比,接受donanemab治疗组患者的iADRS评分下降速度减缓了35%(p<0.0001);18个月时,donanemab组CDR-SB评分较安慰剂组下降速度减缓了36%(p<0.0001);ADCS iADL评分显示,18个月时,donanemab组疾病进展速度延缓了40%(p<0.0001)。此外,donanemab将患者疾病进展到下一阶段的风险降低了39%(HR=0.61; p<0.001)。
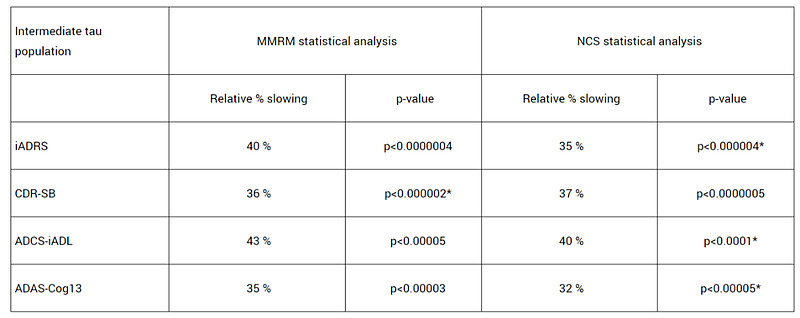
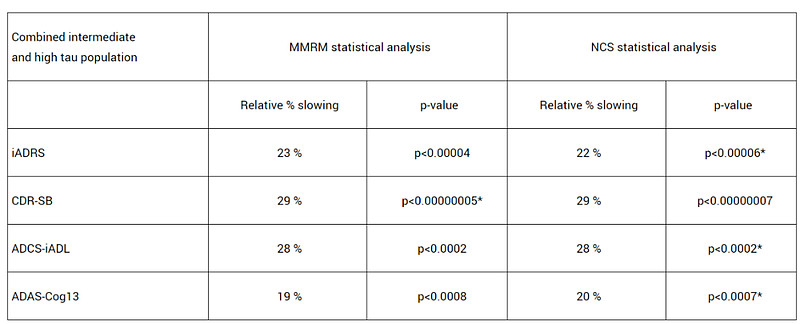
将tau蛋白水平中等人群与较高人群(n=552)结果合并分析后(n=1736),donanemab治疗组仍在所有临床终点中显示出有积极结果(p<0.001),其中CDR-SB评分和iADRS评分分别将下降速度减缓29%和22%。
安全性方面,donanemab组有24%受试者出现淀粉样蛋白相关影像学异常-水肿(ARIA-E),有症状ARIA-E发生率为6%;donanemab组有31.4%患者出现脑微出血和浅表铁质沉积(ARIA-H),安慰剂组为13.6%。大多数ARIA的严重程度为轻度至中度,严重ARIA发生率为1.6%,包括两例死于ARIA的受试者和经历严重ARIA后死亡的患者;有8.7%患者出现输液相关反应,大多为轻度至中度。
$礼来(LLY)$ $再生元制药(REGN)$ $Biogen制药(BIIB)$
更多相关报告和医药资讯持续更新,请持续医药魔方ByDrug 网页链接