7月,吉利德CD47单抗magrolimab在首个III期研究中被证明疗效不足,给整个CD47靶点的前景蒙上了厚重的阴影;Mersana Therapeutics首发ADC UpRi治疗卵巢癌的关键临床未达到主要终点,公司宣布进行重大策略调整;武田Mobocertinib治疗携带EGFR Exon20插入突变的NSCLC患者的III期研究失败,让其失去了率先卡位一线治疗该适应症的机会。在此,为大家筛选其中8项,以供参考。
1.Magrolimab治疗骨髓增生异常综合征III期研究
7月21日,吉利德宣布,CD47单抗magrolimab联合阿扎胞苷治疗高风险骨髓增生异常综合征(MDS)的III期ENHANCE研究因计划分析结果无效而终止。该研究中的安全性数据与已知的magrolimab概况以及该患者群体中典型的不良事件相符。吉利德建议MDS患者停止使用magrolimab治疗。
Magrolimab是一款潜在的first-in-class抗CD47免疫疗法,旨在通过阻断CD47与信号调节蛋白(SIRPα)之间的抑制性相互作用来增强巨噬细胞和其它吞噬细胞识别和消灭外来细胞和恶性细胞的能力,从而达到阻断癌细胞发出“别吃我”信号的目的。Magrolimab原研公司为Forty Seven,2019年7月吉利德以49亿美元的总金额收购了Forty Seven从而将magrolimab收入麾下。
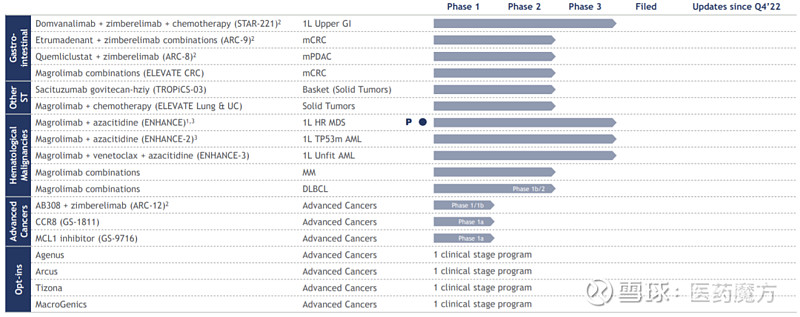
Magrolimab研发计划(来源:吉利德官网)
ENHANCE是吉利德针对magrolimab开展的首个III期研究,旨在评估magrolimab联合阿扎胞苷一线治疗高危骨髓增生异常综合征(HR-MDS)患者的疗效与安全性。这项研究共招募了520例患者,随机接受magrolimab联合阿扎胞苷或阿扎胞苷单药治疗。主要终点是完全缓解率(CR)和总生存期(PFS)。
吉利德开发magrolimab之路并不平坦。2022年1月,由于研究人员报告的可疑意外严重不良反应(SUSARs)在各研究组间存在明显的不平衡,FDA部分暂停了magrolimab+阿扎胞苷的联合研究。同年4月,FDA在回顾了每个试验的综合安全性数据后,解除了magrolimab+阿扎胞苷的联合研究的部分临床暂停。Magrolimab虽然迈过了安全性门槛,却在III期ENHANCE研究中被证明疗效不足。不难想象magrolimab本次的失败将给整个CD47靶点药物的研发前景,蒙上一层厚重的阴影。
2.Mobocertinib治疗NSCLC III期研究
7月27日,武田在2023财年Q1季度财报中披露,EGFR Exon20抑制剂Exkivity (莫博赛替尼,Mobocertinib) 一线治疗EGFR Exon20插入突变非小细胞肺癌(NSCLC)患者的III期EXCLAIM-2研究因无效而被终止。
2021年9月15日,mobocertinib基于一项小规模的I/II期临床试验(NCT0271611)的数据获得了FDA加速批准,适应症为治疗携带EGFR外显子20(Exon20)插入突变并且接受铂类药物化疗期间或之后疾病进展的局部晚期或转移性NSCLC成人患者。
EXCLAIM-2是一项国际多中心、开放标签、随机对照的III期研究,主要研究终点BRIC评估的无进展生存期(PFS)。不过,EGFR Exon20插入突变NSCLC治疗领域也在近期传来了积极消息。7月17日,强生旗下杨森宣布EGFR/c-Met双抗Rybrevant(Amivantamab-vmjw)一线治疗EGFR Exon20插入突变NSCLC的III期PAPILLON研究取得积极结果。与单纯化疗相比,接受Rybrevant+化疗治疗患者的PFS具有统计学和临床意义上的改善。
3.UpRi治疗卵巢癌I/II期研究
2023年7月27日,Mersana Therapeutics宣布其首发ADC项目NaPi2b靶向Upifitamab rilsodotin(UpRi)治疗铂类化疗耐药卵巢癌的关键I/II期UPLIFT研究未达到主要终点。受此影响,该公司股价当日大跌73%。
UpRi是一款潜在first-in-class靶向钠依赖性磷酸盐转运蛋白(NaPi2b)的ADC药物。UpRi是基于Mersana的Dolaflexin技术平台构建,载荷为MMAF,DAR值为10左右。

UPLIFT是一项单臂研究,共招募了268例既往接受过1至4种治疗方案的铂类耐药卵巢癌患者,其中141人被确诊为NaPi2b阳性(定义是肿瘤比例评分(TPS)≥75%)。所有患者既往接受过的系统治疗中位数为3线,其中31%的患者曾接受过4线治疗。该研究的主要终点是NaPi2b阳性人群中研究者评估的客观缓解率(ORR),次要终点包括研究者评估的所有患者的ORR、缓解持续时间(DoR)以及安全性和耐受性。
结果显示,NaPi2b阳性人群中ORR为15.6%,研究未达主要终点。
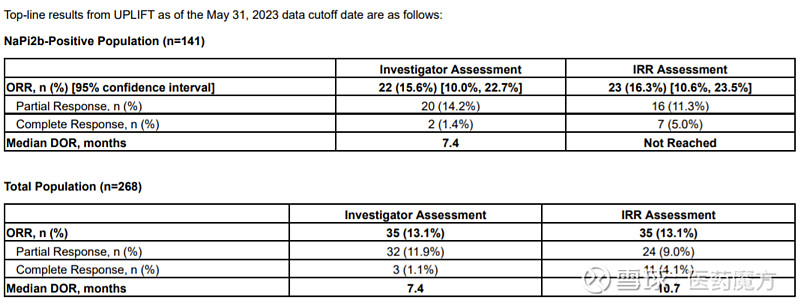
值得注意的是,UPLIFT研究并非是UpRi首次失利。今年6月,因出现5例患者死亡事件,FDA就暂停了UpRi两项卵巢癌临床研究UP-NEXT和UPGRADE-A的新患者招募。受到UpRi研发不顺利的影响,Mersana也宣布公司将进行重大策略调整,逐步减少乃至停止开发NaPi2b ADC,并裁员50%。
4.KSI-301治疗视网膜血管疾病III期研究
7月24日,Kodiak Sciences宣布了在研抗体偶联生物聚合物(antibody biopolymer conjugate,ABC)tarcocimab tedromer(KSI-301)用于治疗视网膜血管疾病的3项III期研究的顶线结果。然而,2项研究结果表明接受KSI-301治疗的患者白内障发病率增加,Kodiak决定终止该药物的临床开发计划。受此消息影响,该公司股价当日大跌60.15%。
KSI-301是基于ABC平台开发的一款超长效抗VEGF药物,旨在延长药物在眼部组织的作用时间,从而改善视网膜血管疾病患者的预后,并为糖尿病眼病患者提供早期治疗和预防视力丧失的方案。
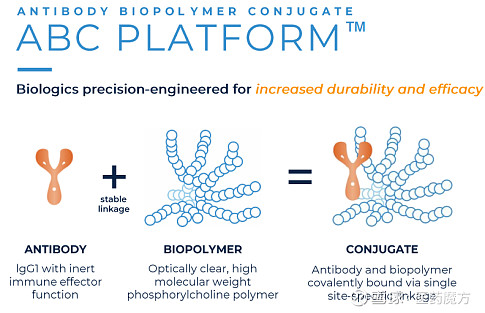
ABC平台作用机制(来源:Kodiak官网)
本次公布的是III期DAYLIGHT研究、GLEAM研究和GLIMMER研究的顶线结果。DAYLIGHT是一项随机、双盲、阳性对照的III期研究,旨在评估高频次KSI-301给药对比阿柏西普在既往未接受过治疗的湿性年龄相关性黄斑变性(AMD)患者中的疗效与安全性。DAYLIGHT研究达到了主要终点,在3个月治疗后,与阿柏西普治疗相比,接受KSI-301治疗患者的最佳矫正视力(BCVA)评分改善更明显。此外,KSI-301的安全性及耐受性良好,同时眼内炎症发生率较低。
GLEAM和GLIMMER研究是2项设计相同、随机、双盲、阳性对照的III期研究,旨在评估KSI-301对比阿柏西普在既往未接受过治疗的糖尿病性黄斑水肿(DME)患者中的疗效与安全性。结果显示,这2项研究没有达到主要终点,即与接受阿柏西普治疗相比,接受KSI-301治疗的患者没有表现出明显的视力改善。
然而,随着时间的推移,研究人员在GLEAM和GLIMMER研究KSI-301治疗组的部分患者中观察到了白内障的发生。不过在为期一年的DAYLIGHT研究期间,接受KSI-301或阿柏西普治疗的湿性AMD患者中均未观察到白内障的发生。
尽管KSI-301显示出了治疗潜力,但Kodiak还是决定终止该药物的进一步临床开发计划。Kodiak首席执行官Victor Perlroth博士表示:“目前尚不清楚是什么原因导致DME患者在接受KSI-301治疗后白内障发病率增加。但鉴于这些发现和结果,我们将停止该项目的临床开发。”
5.Trigriluzole治疗脊髓小脑性共济失调III期研究
7月27日,Biohaven宣布,因trigriluzole用于治疗脊髓小脑性共济失调(SCA)的III期BHV4157-206研究未达主要终点,FDA拒绝受理了该药物用于治疗SCA的新药上市申请(NDA)。
Trigriluzole是一款第三代兴奋性氨基酸转运蛋白2(EAAT2)调节剂,可调节人体主要的兴奋性神经递质谷氨酸水平。该分子通过增加神经胶质细胞中EAAT的表达并增强其功能来增加神经元突触对谷氨酸的摄取,从而降低神经元突触中的谷氨酸水平。
BHV4157-206研究是一项随机、双盲、安慰剂对照的III期临床试验,共纳入218例成年SCA患者,旨在评估trigriluzole(200mg)的疗效和安全性。研究的主要终点为修订版共济失调功能评定量表(f-SARA)总分相比于基线的变化。
结果显示,在总体SCA人群中,trigriluzole组与安慰剂组患者的f-SARA评分变化均为4.9分,无显著统计学差异。Biohaven表示,造成该结果的原因是研究期间SCA患者疾病进展的情况低于预期。Biohaven根据基因型对疗效数据进行事后分析后发现,在SCA3型患者亚组(占总人群41%),trigriluzole组患者的f-SARA评分变化显示出了治疗获益(P=0.053)。此外,在总体人群中,trigriluzole组可以行走的患者跌倒风险降低了58%(10% vs. 23%;P=0.043)。
SCA是一种显性遗传性疾病,其特征是进行性共济失调,影响手、手臂和腿的协调以及平衡和言语能力。SCA通常在成年早期出现症状,并在数年内进展。疾病进展后,患者可能需要依靠轮椅行动,或者因步态不协调而易跌倒、因言语障碍而无法沟通、吞咽困难,甚至过早死亡。症状的范围和疾病进展速度取决于SCA的类型、发病年龄和其他遗传因素。目前,美国尚无SCA疗法获批上市,而全球内仅taltirelin(促甲状腺素释放激素类似物)在日本获批用于治疗SCA。
6.MVA-BN RSV预防RSV III期研究
7月22日,Bavarian Nordic宣布其呼吸道合胞病毒(RSV)疫苗产品MVA-BN RSV在III期VANIR研究中未能显著降低下呼吸道疾病(LRTD)的发生率。基于上述结果,Bavarian决定终止该产品的开发计划,并结束与优锐医药的合作关系。
MVA-BN RSV是一款以MVA-BN为载体的RSV疫苗,同时编码RSV表面蛋白G蛋白及F蛋白和内部蛋白N蛋白及M2蛋白,旨在刺激广泛的免疫应答。2022年3月,优锐医药以2.25亿美元的总交易额获得该疫苗的中国、韩国、东南亚国家权益。
VANIR研究是一项全球性、随机、双盲、安慰剂对照的III期临床试验,共纳入超过20000例60岁及以上的受试者。最终研究结果显示,MVA-BN RSV预防至少2种LRTD症状发生的效力为59%,显著优于安慰剂组。然而,该疫苗预防至少2种LRTD症状发生的效力仅有42.9%,与安慰剂组的数据无显著性差异。
值得一提的是,今年3月,强生的病毒载体RSV疫苗JNJ-64400141亦被终止开发。强生给出的解释是“对投资组合进行审查以确定产品开发优先级以及对RSV疫苗的前景评估后,决定终止RSV成人疫苗项目”,不过,也有外界推测其终止决定可能跟疫苗的预防效果或安全性相关。
7.VIR-2482预防甲型流感II期研究
7月20日,Vir Biotechnology宣布甲型流感中和抗体VIR-2482用于预防症状性甲型流感的II期PENINSULA研究未达到主要或次要疗效终点。受此消息影响,该公司股价大跌44.9%。
VIR-2482是一种用于预防甲型流感的广谱中和抗体,能够覆盖自1918年西班牙大流感以来所有甲型流感主要病毒株。VIR-2482通过抗体改造延长了半衰期,一剂即可覆盖5~6个月流感季。
PENINSULA研究(NCT05567783)是首个评估单抗预防甲流作用的II期门诊试验。在接受最高剂量(1200mg)VIR-2482治疗的受试者中,观察到方案定义的甲型流感样疾病下降了约16%,但无统计学意义。根据CDC流感样疾病标准定义,接受最高剂量治疗的受试者症状性甲流病症减少了约57%,这是两个次要终点之一。安全性方面VIR-2482的耐受性总体良好,未发现任何安全信号。
8.Zynlonta治疗DLBCL II期研究
7月11日,ADC Therapeutics自愿暂停了CD19靶向ADC Zynlonta(Loncastuximab tesirine)联合利妥昔单抗用于治疗先前未经治疗、身体健康状况不佳或虚弱的弥漫性大B细胞淋巴瘤(DLBCL)的II期LOTIS-9研究的患者入组,原因是该研究出现了12例严重安全事件。此次消息公布后,ADC Therapeutics股价大跌16%。
ADC Therapeutics近期对参与LOTIS-9研究的40名患者的汇总数据进行了审查,发现该研究可能出现过多的呼吸相关事件。该公司在咨询了数据监测委员会(DMC)后主动暂停了临床试验。这些与呼吸相关的TEAE(治疗期间出现的不良事件)包括7例5级致命事件和5例3级或4级事件。根据研究者的评估,12个事件中的11个(包括7个5级致命事件中的6个)被单独评估为不太可能或与研究药物无关。5个3级或4级事件中有4个已经解决,患者已经完成了每个方案的治疗。这些事件的原因仍在进一步调查中。
LOTIS-9研究是Zynlonta针对DLBCL患者的首个一线治疗研究,其联合利妥昔单抗二线治疗不符合移植条件(NTE)DLBCL的LOTIS-5研究正在进行中。
值得注意的是,CDE于2023年7月13日受理了瓴路药业递交的注射用泰朗妥昔单抗(Loncastuximab tesirine)单药治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)的上市申请。这也是国内首个申报上市的靶向CD19的ADC药物。