12月8日,Akero Therapeutics公司宣布FDA授予efruxifermin (EFX) 治疗非酒精性脂肪性肝炎 (NASH) 的突破性疗法认定。去年10月,EFX已获FDA授予的快速通道资格认定。

NASH是非酒精性脂肪性肝病的一种严重形式,其特征在于脂肪在肝脏中过度堆积,对肝细胞产生应激和损伤,引起炎症和纤维化,进而发展为肝硬化、肝功能衰竭、癌症甚至死亡。对整个医药行业来说,NASH一直是个难题,其需求远未得到满足,目前尚无治愈或特异性的治疗方法。据估计,到2026年,NASH市场将达到183亿美元。
Efruxifermin(AKR-001)是通过模仿天然FGF21的生物活性谱设计而成,融合Fc延长半衰期,同时替换了FGF21序列中的某些氨基酸;半衰期达到3-4天,可以实现每周1次或每2周1次皮下注射给药。
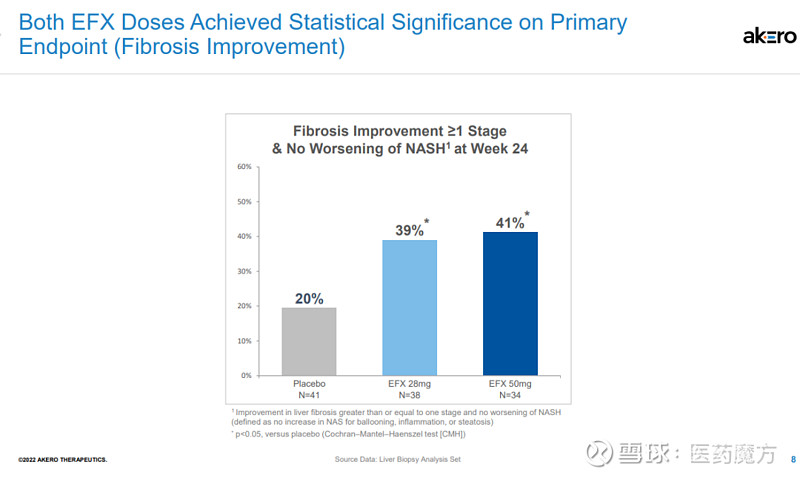
FDA授予EFX突破性疗法认定是基于一项IIb期HARMONY研究的积极结果。该研究旨在评估EFX治疗肝硬化前NASH(纤维化F2-F3)的安全性和有效性,结果已于今年9月公布,第24周时,皮下注射Efruxifermin 28mg和50mg剂量组均达到了改善肝脏纤维化的主要终点,分别有39%和41%的患者实现了至少一个阶段的肝纤维化改善且NASH没有恶化,而安慰剂组仅为20%。
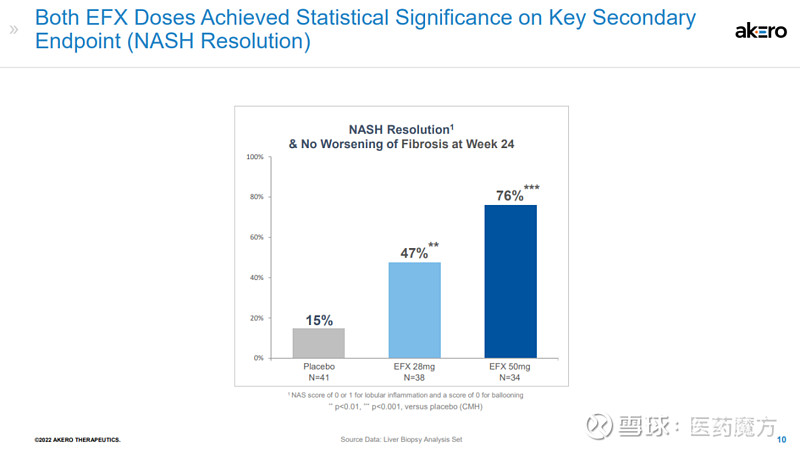
该研究还达到了多个关键次要终点。皮下注射EFX 28mg和50mg后,分别有47%和76%的患者在肝纤维化不恶化的情况下获得了NASH缓解,而安慰剂组为15%。
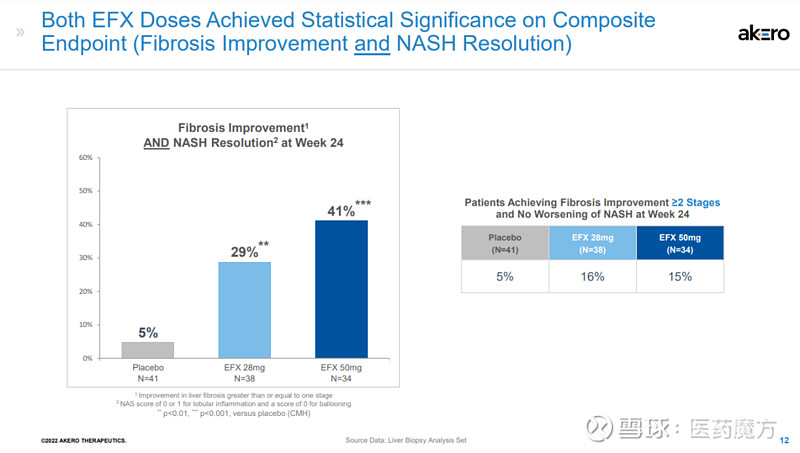
另外,28mg和50mg剂量组分别有29%和41%的患者达到了肝纤维化改善和NASH缓解两个终点,而安慰剂组为5%。
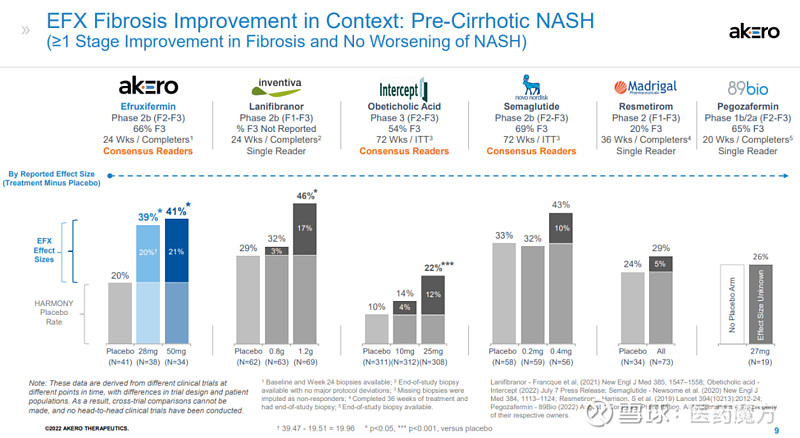
本次研究结果达到的组织学改善效果是已披露数据NASH新药中最好的,如果获批上市,有望成为治疗NASH的best-in-class药物。
该公司表示,另一项IIb期SYMMETRY研究已于2021年7月启动,旨在评估EFX用于因NASH引起的代偿期肝硬化(F4)、肝功能Child-Pugh A级患者的疗效与安全性,预计2023年下半年公布结果。