6月7日, 美国FDA批准了18年来首个治疗阿尔茨海默症的新药阿杜卡尼单抗(aducanumab)。
消息甫一发布,迅速引爆朋友圈。
有人感慨:抗Aβ机制药物获批何其艰难,只要坚持,总有见到曙光的时候;
有人嘲讽:FDA有时也没节操,加速获批不该是3期研究失败后的备胎;
有人吃瓜不嫌事大:绿谷GV-971可敢一战?
更多人心情复杂:对于望眼欲穿的患者家属来说,任何可能性都是他们想要尝试的…
阿杜卡尼单抗的3期临床因不太可能改善AD患者认知功能而提前终止有目共睹,仅仅凭借探索性分析中“淀粉样蛋白斑负担水平”这一未经确证的替代终点,在专家组几乎0票支持的情况下仍然加速批准上市,引发巨大争议。
抛开Aβ假说本身的争议不谈,AD新药凭借未经验证的替代终点获批上市,统计师是力挽狂澜,还是颠倒乾坤?让人又爱又恨的“替代终点”,应该如何正确理解?联想2021年初以来,PD-1/PD-L1或主动、或被动的撤市风云,如何看待加速批准这把“双刃剑”面临的全新挑战?
医药魔方Med有幸邀请到中国卫生信息与医疗健康大数据学会统计理论与方法专业委员会主任委员、国家药监局药品注册审评专家咨询委员会专家、南京医科大学陈峰教授,从生物统计工作者的角度,谈谈这一事件给医药同行带来的启示。

临床研究的替代终点
临床实践的全新起点
根据《联邦食品、药品和化妆品(FD&C)法案》第 507(e)(9) 节:“替代终点”一词指标记物,如实验室测量值、放射成像、体征或其他测量值,本身不是对临床获益的直接测量;以及——
(A)已知可以预测临床获益,并且可以用于支持传统批准药物或生物制品;或者
(B)可以合理预测临床获益,并且可以用于支持按照第506(c)条进行的药品或生物制品加速审批。
其中,实体瘤领域可用作加速审批的替代终点包括常见的无进展生存期(PFS)、客观缓解率(ORR)、病理学完全缓解(pCR)、无转移生存期(MFS)、无病生存期(DFS)和无事件生存期(EFS)。
对替代终点的探索经历了漫长的历程,临床应用也绝非一蹴而就。
医药魔方:监管机构根据替代终点批准新药时,一般都有哪些方面的考量?
陈峰:替代终点是与临床获益相关的、对临床结局具有预测价值的早期指标,且生物学上可解释。替代终点的选择需要根据临床试验的具体情况来确定。
以肿瘤为例,替代终点需要根据不同的适应症,以及治疗的线数,如新辅助、辅助、一线、二线、后线等,具体情况具体考量。对于晚期恶性肿瘤而言,由于OS比较短,一般替代终点就没有意义了;而对于部分难以观察到OS的早期肿瘤(如乳腺癌),替代终点就是必要的选择。
另一方面,是否采用替代终点,也跟某个药物是否临床急需密切相关。比如阿尔兹海默症(AD),十几年来都没有好的治疗方法,如果一定要观察到真正的终点,时间就比较长,临床等不起。所以,我们看到FDA采取的决策是附条件审批上市,并要求渤健必须进行上市后试验,以确认该药物可以改善认知。(编者注:渤健有9年的时间来完成试验,如果药物不能按预期发挥作用,FDA将采取措施将其从市场上撤回。)
医药魔方:伴随临床需求而来的替代终点,被广泛接受往往经历了漫长的历程,您能举几个例子吗?
陈峰:以公众认知度较高的HPV疫苗为例,从预防的角度来看,临床终点可想而知,一定是观察到女性宫颈癌的发生。但给十几岁的女孩注射疫苗,观察到这样的终点需要等到二十年以后,临床试验就需要开展很长时间。有人就提出,可以往前一点,观察到宫颈癌前病变。即使这样,时间也很长。
那怎么办呢?后续的流行病学和生物学证据表明,高危型HPV的持续感染,很可能导致癌前病变,从而发展成宫颈癌。持续6个月的HPV感染,可以用作更早的替代终点。对此,一开始大家并不都能接受,随着证据越来越多,也就慢慢接受了。美国和欧洲,目前都是基于是否能够预防HPV持续感染作为评估标准。
所以,对于替代终点的认知是有一个过程的,既需要临床上的因果关系,也要有生物学的因果关系。进一步讲,以肿瘤化疗为例,由于临床应用时间较长,大量研究验证了PFS与OS的相关性;而近年的新型靶向治疗和免疫治疗,PFS 与OS之间的关系,是否还与化疗一样?这都需要有一个探索和认识的过程。
加速审批的双刃剑
力挽狂澜的统计师
1992年,FDA的优先审批(PR)和加速批准(AA)政策在设立之初,旨在针对缺少有效治疗手段的严重或危及生命的疾病,快速满足需求缺口。1997年,快速通道(FT)设立;2012年,突破性疗法(BT)出炉。
据统计[3],1992年11月至2017年5月,FDA加速批准了64种血液肿瘤和实体瘤产品的93个适应症,其中,53个产品属于新分子实体(NME),67项试验数据属于单臂试验设计(72%)。以免疫检查点抑制剂为例,截至2019年3月,44项获批的适应症中有28项(68%)基于替代终点,24项(55%)基于加速批准。
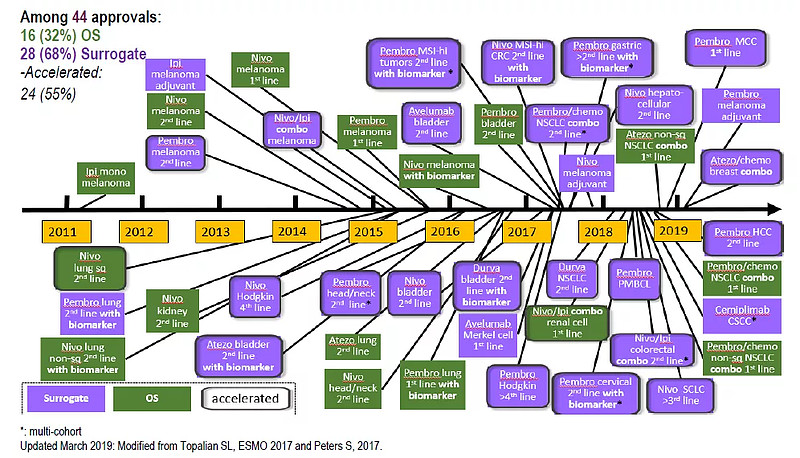
与之对应的是,中国的药政改革也引入了一系列药品加快审评审批路径,包括2015年的优先审评制度,2017年的附条件批准相关法规,以及2018年出台指导原则进一步鼓励境外临床试验数据用于注册申请。2016-2020年,国内共批准了52种新的癌症药物。其中, 44种受益于至少一项快速程序[4]。
2020年11月,CDE正式公布《药品附条件批准上市技术指导原则(试行)》。附条件批准药物在上市后是否会在规定的时间内完成和提交确证性临床试验及结果,是国内外监管机构共同面临的全新挑战。
医药魔方:您如何看待阿尔茨海默病新药阿杜卡尼单抗的加速获批?
陈峰:针对AD新药这个案例而言,由于目前披露的信息有限,此处不具体探讨临床试验的细节。简单理解的话,问题在于3期研究的主要疗效指标没有达到,但在一些亚组或一些次要指标还可以。前期的临床试验也显示了不错的效果。研发人员还使用了定量药理学的分析方法,来进一步说明该药在某些指标上的治疗效果。
影像数据显示,阿杜卡尼单抗治疗组第26周和78周的淀粉样蛋白斑负担水平较安慰剂组有明显减轻,这也是FDA加速批准上市所用的替代终点。
一般而言,如果替代终点对后期临床终点的预测价值非常大,验证性试验成功的可能性就比较大;如果预测价值很差,失败的概率就很高。目前已知的是,阿尔兹海默症患者淀粉样蛋白斑负担水平与认知能力评分之间的关系未经验证。至于上市后的真实世界研究能否成功,或许时间是检验真理的唯一标准,让我们拭目以待。
医药魔方:渤健的生物统计师在阿杜卡尼单抗失败3期研究的“起死回生”中发挥了至关重要的作用,这是否会给外界带来一些误解,比如数字游戏“颠倒黑白”?
陈峰:表面上来看,的确像是一个失败的研究,通过事后分析从不同的角度挖掘阳性结果,这也正是为什么阿杜卡尼单抗的上市引发巨大争议。
根据FDA公告披露的信息,“Aduhelm 的后期开发计划包括两个 3 期临床试验。一项研究达到了主要终点(编者注:事后分析高剂量组达到主要终点),显示临床事件减少。第二项试验未达到主要终点。然而,在对其进行评估的所有研究中,Aduhelm 以剂量和时间依赖性方式一致且非常令人信服地降低了大脑中淀粉样蛋白斑块的水平。预计淀粉样蛋白斑块的减少将导致临床事件的减少。”
如果单独分析一项临床试验,后期数据挖掘、分析的假阳性确实很高,这一点毋庸置疑;但从上述细节推测,FDA的审评决策大概率不依赖于单独一项临床试验的结果判断优劣,可能还考虑了不同临床试验之间的互相验证、结果的趋势、安全性、临床需求等等。期待后续审评报告和更多公开信息的披露,帮助公众了解事件的全貌。
很多人对此抱有误解,好像把数据集颠过来、倒过去分析一下,找到有统计学意义的指标,就可以去申报上市,这是绝对的误解。
医药魔方:那么,应该如何理解生物统计师对失败临床试验的数据挖掘?
陈峰:即使是一项失败的临床试验,数据集也肯定包含一些有用的信息:主要疗效指标没有差别,但可能对某些次要指标有效,或者在某个亚组有效。所以任何一个研究者,当临床试验失败以后,都会对数据进行深度挖掘。
与预先设定的统计分析不同,计划外分析(也称为探索性、回顾性或事后)也可以提供有价值的信息,但原理和目的存在很大的差异:前者旨在验证假设,后者则生成新的假设。因此,数据挖掘通常是为了提出下一个假说做准备,但像阿杜卡尼单抗这样用来申报上市的案例,非常罕见。
任何一项临床研究,只要去挖掘挖掘,总能够得到一些“有意义”的结论,但是这种情况下假阳性的概率很高。因此,还需要从生物学角度作进一步的解释,如果解释不通,也不能贸然开展下一项试验。
医药魔方:对于大部分不懂统计学的医药同行来说,需要注意哪些误区?
陈峰:第一,统计学是一个非常重要的评价标准,但它不是唯一的标准。
统计工作者在整个临床研究过程中确实发挥了非常重要的作用:设计方法的选择、样本估计、终点指标选择、统计目的与假设设定、制定统计分析方案等等;但是在药物评审的时候,是从药学、临床、统计学、伦理学、社会学、卫生经济学,以及与同类研究间的一致性等各个方面综合判断是否安全有效,质量可控。
第二,通常强调的统计分析,都是基于预先设定的分析计划完成假设检验。试验过程中不允许更改,如果需要更改,就涉及到适应性设计,但适应性设计同样也需要事先定义。通俗一点讲,该怎么做就怎么做,最后做出来什么就是什么。
第三,统计学分析的关键在于控制假阳性。除了罕见病和肿瘤领域之外,美国FDA要求新药开展2项或以上独立的确证性临床试验,才能申报上市。为什么这样做?就是为了进一步控制假阳性。
研究者与统计师,对灵魂伴侣
的渴求深入创新药的骨髓
根据中国肿瘤药物临床试验年度报告[5],与2019年相比,2020年临床试验、试验药物及上市药物增速分别为52.3%(474种vs.722项)、36.7%(335种vs.458种)、11.8%(17种vs.19种)。
俗话说,质量源于设计。抗肿瘤创新药蓬勃发展的背后,生物统计学人才的巨大缺口是不可逃避的话题。
据悉,国内有且只有十所高校设立了生物统计学专业:南京医科大学、南方医科大学、重庆医科大学、广东医科大学、海南医学院、蚌埠医学院、滨州医学院、潍坊医学院,中国药科大学和北京大学也刚刚设立该专业。
这一巨大的反差,预示着怎样的隐忧?
医药魔方:国内学统计的人很多,为什么生物统计师却如此紧缺?
陈峰教授:这个问题可以分成三个层次来看。首先,虽然学统计的人相当多,但绝大部分都在金融、保险、商务等社会经济领域,很少有人涉足生物医药。统计学的理论方法都是相通的,根据应用的领域不同有一定的特殊性。与金融行业相比,生物统计师的起薪可能并不高,但是发展的空间比较大。
其次,高校人才培养周期较长,数量有限。以南京医科大学为例,一年培养本科生35~40个,研究生20个左右,博士生3~4个,可以说是非常少了。即使将现有十所院校加起来,每年生物统计学专业毕业的本科生合计也不超过500人,而其中还有一部分学生侧重在医院卫生业务统计,这与临床试验的生物统计,又有一定的区别。
综合来看,生物统计学人才的巨大缺口也就不难理解,熟悉肿瘤创新药临床试验设计的优秀统计师,更是凤毛麟角。
医药魔方:2020年末,国家卫生健康委员会发布了《医疗卫生机构开展研究者发起的临床研究管理办法(征求意见稿)》,IIT研究的质量规范和稽查管理成为大势所趋。据您观察,国内外研究者(PI)与生物统计师协作的现状是怎样的?
陈峰教授:国外很多大的生物医药课题组,都有自己专门的统计师。统计师长期与研究者在一起工作,对研究的专业背景有所了解,就可以深度参与课题设计,大大提升数据挖掘的效率。
而国内由于人才紧缺,有专职统计师的临床科研团队非常少。有需求,怎么办?大多是临时找人帮忙。但正因为人少,所以每个生物统计师都很忙。有资源的PI可以跟企业合作,借用人手,这是一条路;有部分年轻的大夫,自己学,学完了自己做,也是一种无奈的选择。
现在卫健委发文,对研究者发起的临床研究要加强稽查,数据质量到底怎么样,可靠不可靠?这意味着需要更多数据管理、统计师的参与。
问题也就随之而来,如何弥合日益严峻的人才缺口和日益增长的创新药研发、临床研究需求?考虑到学校培养周期长、人数少,应该调动社会力量,吸引行业相关专业人员参与专业培训,或许也不失为一种潜在的解决办法。
值得一提的是,最近药物信息协会(DIA)正在构建线上统计学院,专门培养临床试验统计师。
路漫漫其修远兮。
结语
有光的地方,就有影子。凭借替代终点加速审批上市,近年在肿瘤领域已经屡见不鲜,但3期失败之后凭借事后分析申报上市,仍令人大跌眼镜。有人评论,阿尔兹海默症新药的获批,可能是迄今为止,生物统计师最耀眼的高光时刻。但这同样可能使这群临床科研的“幕后英雄”蒙受公众的诸多误解和质疑。
陈峰教授举了一个非常有意思的小例子:因为中文没有复数,很多人误解新药1期、2期、3期研究是单数,分别开展一项临床试验;实际上是不对的,仔细看英文原文就会发现,1期、2期需要一系列试验,3期则是至少两项试验互相验证。
如果读到这里,惊讶的发现不曾意识过这个问题,不妨回味一下本文的标题:生物统计师,不是临床研究「魔法师」。
推荐阅读:
Nature评论 | FDA批准阿尔茨海默症新药:治疗突破 or 底线突破?
一图读懂 | FDA:作为药物加速批准或许可基础的替代终点表
参考文献:
[1]网页链接
[2]网页链接
[3] Beaver JA, et al. JAMA Oncol 2018;4(6):849–56
[4] Li G, Liu Y, Xie C, Zhou Q, Chen X.Nat Rev Drug Discov. 2021 Jun;20(6):416.
[5]吴大维,黄慧瑶,唐玉等.2020年中国肿瘤药物临床试验进展[J].中华肿瘤杂志,2021,43(2):218-223.
