抗体偶联药物(Antibody Drug Conjugates,ADC)的火热程度已经毋庸赘言。ADC药物的成功与抗体药物和偶联技术的进步密不可分,特别是偶联技术的不断突破将ADC药物推向了爆发期。早期的随机偶联技术在产品均一性、批间稳定性方面等都存在诸多缺陷,定点偶联技术的出现为解决这些问题提供了可能,已经成为ADC药物中常用的偶联手段。
启德医药2013年创立于苏州生物医药产业园,其创始人在公司未注册之前便已开始布局ADC偶联技术,以差异性的酶催化技术开发新型抗体偶联药物。2021年,启德医药首个申报的ADC产品GQ1001获得临床默示许可。大家也难免好奇这家企业采用的是怎样的偶联技术,与业界常用的技术又有何区别?
技术基石:Sortase 酶
Sortase 酶是一类介导革兰氏阳性菌细胞壁锚定蛋白与细胞壁共价结合的转肽酶,自从2004年首次报道应用Sortase A作为一种蛋白质或多肽的连接工具以来,Sortase A参与的连接反应迅速成为一个研究热点,已被广泛应用于生物化学、蛋白质组学、生物医药以及生物工程技术等领域。近些年来,Sortase A在生物技术领域的应用吸引了越来越多的关注。
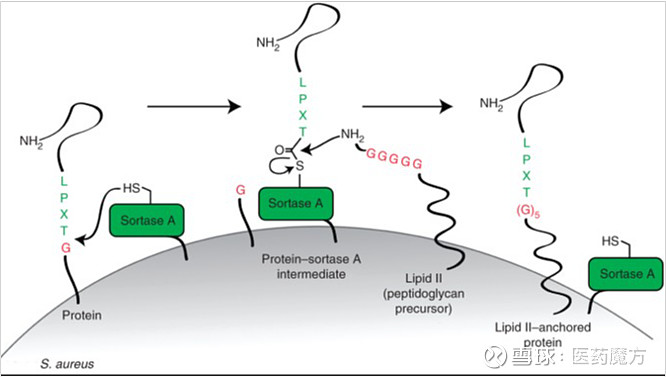
Sortase酶催化示意图(Nature protocols, 2013,Vol8(9): 1787)
Sortase 酶家族根据其不同的一级序列和底物主要分为A、B、C、D四个亚家族。Sortase 酶通过识别抗体特定保守序列Leu-Pro-Xxx-Thr-Gly(LPXTG,其中X为任何氨基酸,甘氨酸不能为游离羧酸盐)。识别之后,Sortase 酶在苏氨酸和甘氨酸残基之间切割,形成酰基酶中间体,Sortase 酶的活性位点半胱氨酸与靶蛋白苏氨酸残基的羰基形成一个新键。然后,连接子中间体的游离氨基作为亲核试剂攻击而分解,从而将Linker和毒素直接偶联在抗体特定位置。
技术应用:GQ1001
启德医药并非Sortase 酶的发现者,却是国内较早将Sortase 酶应用于ADC偶联技术的企业。早在2013年4月,启德医药创始人秦刚便以自然人提交专利优先权申请(WO2014177042)。
可以看出,与其他ADC企业不同,启德医药并非采用酶催化来进行抗体的糖基化修饰或去修饰、还原或插入偶联位点(如引入叠氮基)等,而是直接使用酶催化将Linker和毒素链接到抗体。
GQ1001便是该项技术的成功应用。官网信息显示,GQ1001是根据启德医药独特的连接酶催化偶联技术和拥有专利的开环连接子技术,通过毒素DM1与trastuzumab的定点特异性偶联产生的ADC。通过专利检索,也发现了GQ1001结构形式:
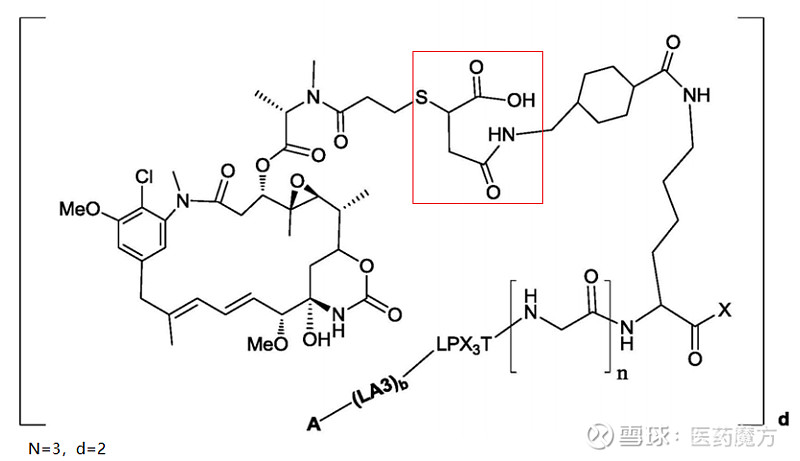
GQ1001结构形式(CN201580023609)
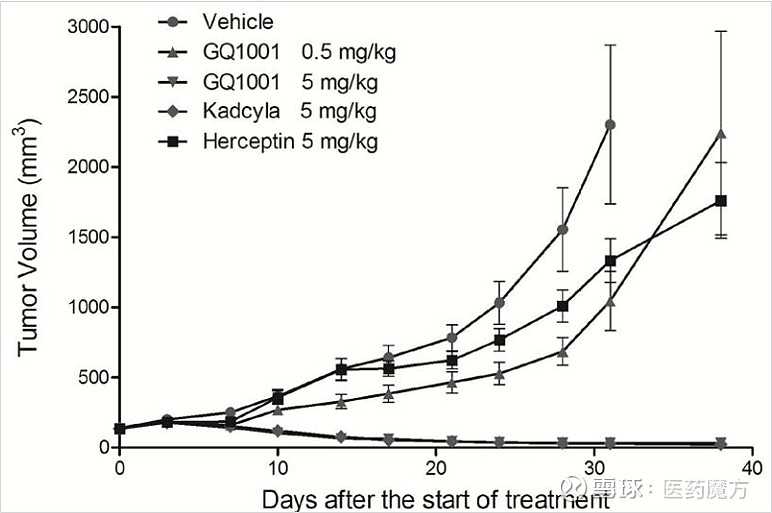
GQ1001也体现了特定的药物研发历程。如上图所示,GQ1001携带DM1作为毒素而不是Dxd,红色圈示部分似乎也就是启德医药所述的拥有专利的开环连接子技术,琥珀酰亚胺的环状结构被打开,与巯基链接的碳原子形成新的手型中心,裸露出的羧基也对水溶性的提高有所裨益。作为时代的产物,GQ1001也是对标了Kadcyla,显示了与Kadcyla相似的肿瘤抑制作用。
CN201580023609
基于专利信息而言,GQ1001的优势或许也是其安全性。实验动物的体重与对照无显著差异,而Kadcyla变化较大。并且,动物解剖结果也显示,GQ1001各剂量组动物大体未见异常突变,而Kadcyla的60mg/kg剂量组动物可见与给药相关的大体改变,包括脾脏增大(6/6)、肝脏边缘钝圆(4/6)及胸腺小(1/6)。
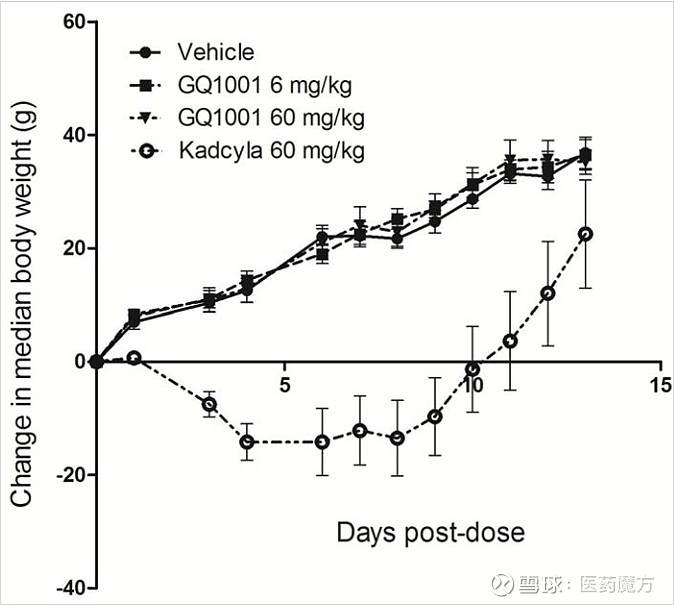
CN201580023609
另一方面,Sortase酶催化的优势是成本和效率。启德医药采用固定化酶工艺,将Sortase 酶固定在琼脂糖树脂装载在偶联柱中,抗体和连接子-载荷底物通过固定化酶催化偶联,相较于化学法,酶法通常更具高效性。基于连续流模式,偶联柱内同时高效进行着数千亿个超快速偶联反应,因此实现了高度均质的生物偶联药物的高效生产。
技术前景:ADC趋势
DS-8201的成功和百奥泰ADC产品的连续失败,将关于ADC产品优势的思考带入讨论话题。Enhertu的毒素Dxd和高DAR(药物抗体比)也引起关注。通过对启德酶催化技术和专利分析,可以看出,启德医药通过抗体修饰和连接子策略选择,可以实现更多样的产品布局。
基于抗体修饰提高DAR的策略对于启德医药的酶催化技术也是适用的,在此不过多讨论。除了开环连接子技术,启德医药也探索过Linker的改变提高DAR,比如单一连接子携带1-4个毒素和/或其他分子的骨架片段,这一点也是符合ADC药物发展趋势。
启德医药这种连接子策略,一方面,可以携带相同机制分子,直接用来提高DAR;另一方面,也可以携带不同机制分子,包括微管毒素、DNA毒素与免疫激动剂、免疫抑制消除剂、M2细胞消除、细胞周期抑制等新机制的分子组合。Idera的TLR9激动剂Tilsotolimod联合CTLA4抗体治疗PD-1难治性晚期黑色素瘤临床失败,但并不一定是分子机制问题。此外,对于Treg细胞抑制免疫反应的机制也已经相对清晰,但小分子的全身暴露是最直接的挑战。ADC药物或许将是再次验证和解决这些问题的一种策略。
2020年11月,启德医药宣布完成B轮融资,并与博瑞医药达成战略合作,携手开发创新ADC药物。基于博瑞医药在小分子药物开发方面的丰富经验和独特优势,未来,启德医药或许将进一步加大ADC药物的探索和优化,如Linker的迭代升级、可裂解和不可裂解Linker之间的转换、不同机制毒素分子的单独和协同应用等。
结语
企业之间最核心的竞争是技术、最直接的竞争是速度、最潜质的竞争是产品设计。产品设计不应局限于当下,更要有对疾病治疗和产品竞争的远期预测。ADC药物,已经开始向一线治疗发起挑战,Enhertu(DS-8201)直接挑战曲妥珠单抗和帕妥珠单抗的临床研究即将开始。未来,疾病治疗格局将如何变化,产品设计不得不多做思量。
通过对药物成功或失败的研发经验进行总结和反思,探究疾病治疗的现状和趋势预测,可以更好的指导产品研发和设计策略。或许,在不仅是为了“Fast”而“Follow”、为了“专利”而“修饰”时,优质药物才会更加的普遍涌现。