6月8日,罗氏在中国提交的Tiragolumab注射液临床申请获得CDE受理,Tiragolumab是一种TIGIT单抗。

TIGIT在多种免疫细胞中表达,包括CD8+T细胞,CD4+T细胞和NK细胞,是一种CD226共刺激受体的特异性负调节子。肿瘤细胞表面高表达的CD155是TIGIT的高亲和力配体,一旦与NK和T细胞表面的TIGIT结合,就会使T细胞对肿瘤细胞的杀伤作用受到抑制。
TIGIT是肿瘤免疫治疗中最有前景和潜力的靶点之一。初步临床结果显示,抗TIGIT抗体作为单药疗法或联合抗PD-1/PD-L1抗体药物均展现出一定的安全性和抗肿瘤有效性,特别是联合疗法有望发挥协同增强作用。目前,国外正在开展多个抗TIGIT单克隆抗体药物相关的临床研究,但尚无品种获批。
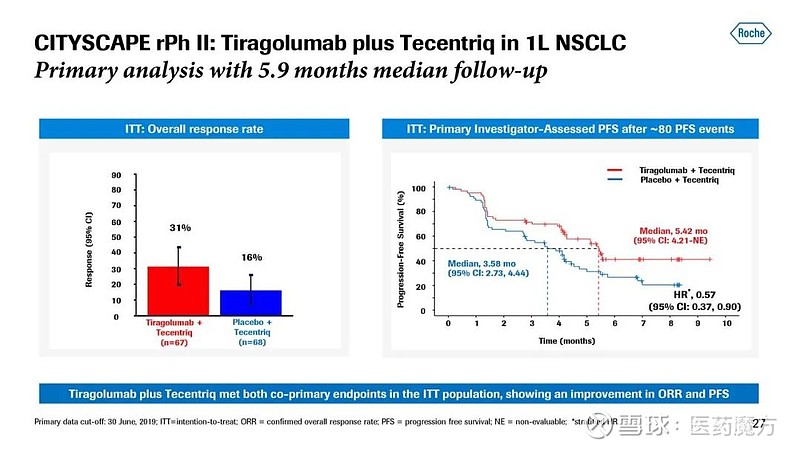
罗氏在ASCO2020大会上口头报告的tiragolumab联合Tecentriq一线治疗PD-L1阳性NSCLC患者的II期CITYSCAPE研究数据显示,随访5.9个月时,Tiragolumab+Tecentriq治疗组较安慰剂+Tecentriq治疗组患者ORR显著改善(31.3% vs 16.2%),中位PFS显著延长(5.4 vs 3.6个月),患者的疾病恶化或死亡风险降低43%(HR=0.57, 95%CI:0.37, 0.90)。
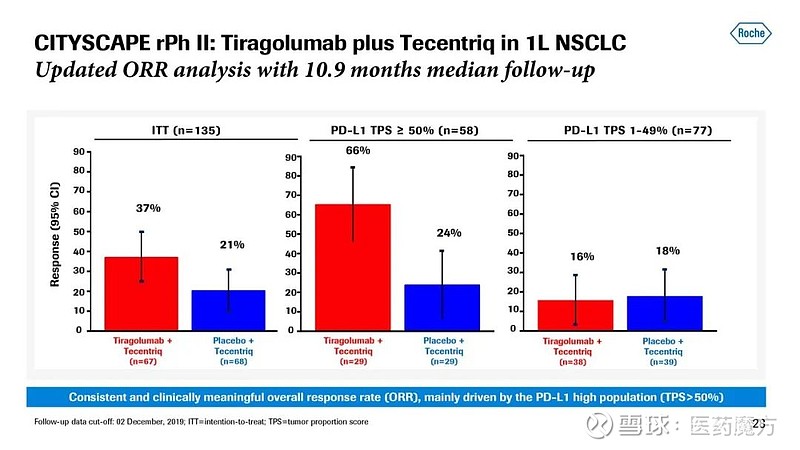
随访10.9个月结果显示,在ITT人群中,tiragolumab+Tecentriq治疗组较安慰剂+Tecentriq治疗组ORR显著改善(37% vs 21%);在PD-L1高表达(TPS≥50%)人群中,tiragolumab+Tecentriq(n=29)ORR相比安慰剂+Tecentriq(n=29)显著升高(66% vs 24%);但是在PD-L1低表达(TPS 1%~49%)人群中,tiragolumab+Tecentriq治疗组(n=38)ORR相比安慰剂+Tecentriq(n=39)并未得到改善(16% vs 18%)。
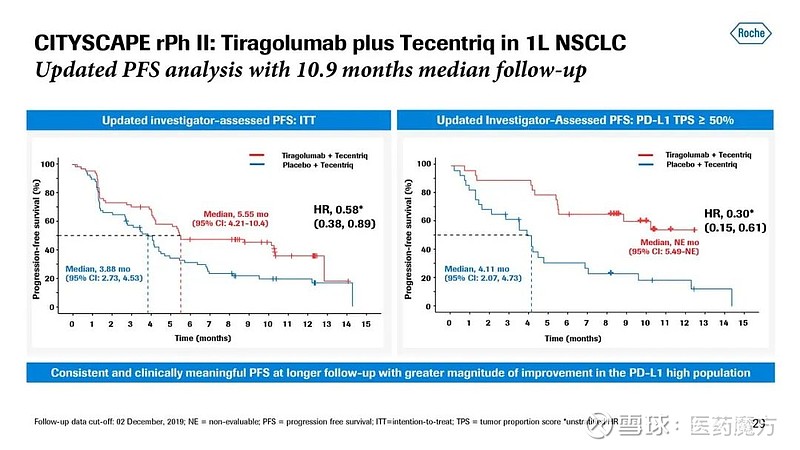
PFS方面,在PD-L1高表达人群中,tiragolumab+Tecentriq治疗组相比安慰剂+Tecentriq的生存获益有显著提升(未成熟 vs 4.11个月)。
安全性方面,tiragolumab+Tecentriq治疗组耐受性良好,与安慰剂+Tecentriq治疗组安全性数据总体类似,免疫介导的不良事件更为常见,多为1/2级,并且可以管理。
目前,罗氏Tecentriq已经在中国获批用于一线治疗广泛期小细胞肺癌,并且提交了Tecentriq联合贝伐珠单抗一线治疗肝癌的上市申请。