5月29日,辉瑞宣布根据独立数据监测委员会的分析,其CDK4/6抑制剂Ibrance (palbociclib)联合辅助内分泌疗法用于治疗HR+/HER2-乳腺癌的III期PALLAS研究不太可能到达无侵袭性疾病生存期(iDFS)的主要终点。
PALLAS研究是一项在全球21个国家400多个中心开展的随机(1:1)、前瞻性、开放标签的国际多中心III期临床试验,旨在评估palbociclib联合标准辅助内分泌疗法对于早期浸润性(2期和3期)乳腺癌男/女性患者的疗效和安全性。该研究中,一组患者将先接受为期2年的palbociclib联合标准辅助内分泌疗法治疗,随后接受标准辅助内分泌疗法直至第5年,另一组患者则单独接受为期5年的标准辅助内分泌疗法治疗。
辉瑞表示,该研究中目前正在接受palbociclib治疗的患者将由医生确定下一步治疗计划,长期随访仍将按计划进行。该研究未观察到新的安全信号。
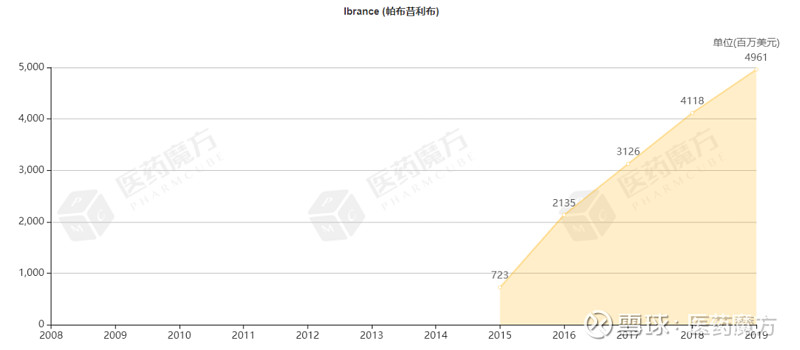
Ibrance于2016年2月获得FDA批准用于治疗HR+/HER2-乳腺癌女性患者,并于2019年4月获得FDA批准用于治疗HR+/HER2-乳腺癌男性患者。2019年,Ibrance销售额为49.61亿美元。
辉瑞肿瘤学首席开发官Chris Boshoff博士表示:「我们对这一结果感到失望。乳腺癌是世界范围内主要的癌症死亡原因,在延迟或预防乳腺癌复发或转移方面存在着严重未满足的临床需求。PALLAS是一项涉及许多亚组的大型研究,我们正在积极合作,以确定是否有患者可以通过palbociclib组合治疗而受益。Ibrance自从2015年最初获批以来,已经改变了HR+/HER2-乳腺癌的治疗前景。我们感谢所有为此做出贡献的患者和医疗机构等合作伙伴。」
辉瑞董事长兼首席执行官Albert Bourla说:「虽然这一结果并不是我们希望看到的,我们仍然致力于推动科学发展和乳腺癌患者的护理。考虑到公司营销组合的广度和渠道实力,我们的增长预测不会依赖于任何个别产品。在普强和迈蓝合并完成后,我们依然对公司实力充满信心,预计2025年,公司收入的年复合增长率至少为6%。」