2019年,PD-1/PD-L1药物的动态依然受人关注,但是相关新闻的刷屏强度、事件本身的震撼程度已经不能跟前几年同日而语。这或许是因为PD1/PD-L1药物在能够取得突破的瘤种都早已实现了突破,如果还没有攻克哪个瘤种,那就说明这个瘤种确实挺难突破的,这也是PD1/PD-L1药物的局限性所在以及大家渴望发掘下一个类似PD1/PD-L1这样的革命性肿瘤免疫治疗靶点的原因(注:更多前沿新靶点,请关注医药魔方Pro)。
换一个角度,当大家对PD-1/PD-L1已经有点审美疲劳或者关注度已经从PD-1/PD-L1身上有所转移的时候,其他领域的一些研发进展和突破就显得亮眼起来。所以在2019年,我们看到了KRAS抑制剂30多年来的峰回路转,看到了RNA疗法和基因疗法的方兴未艾,看到了双特异性抗体和ADC药物的异军突起……,一个个热点新闻事件让我们应接不暇,观感上远比PD-1/PD-L1独霸朋友圈时的单调更加绚烂多彩。
2019年末,医药魔方从NextPharma筛选了年度最「靓」的临床数据,带大家重新回味一下今年新药研发领域的重大进展。所谓“靓”,一方面是说这些临床研究数据令人印象深刻,过目难忘;另一方面是说这些临床数据都可以被认为是针对某种疾病治疗、某个靶点药物开发或某类药物的重大突破。
1、司库奇尤单抗
公司:诺华
机制:IL-17A单抗
疾病:银屑病
研究代号:NCT03066609(III期)
3月4日,诺华在AAD2019大会上公布了一项Cosentyx治疗中重度斑块状银屑病的III期研究(NCT03066609)中国队列数据,是Cosentyx和IL-17A单抗针对中国患者的III期研究首次亮相。
研究采用随机、双盲、安慰剂对照、国际多中心设计,为期52周,入组了441例伴有或不伴有银屑病关节炎的中重度慢性斑块型银屑病中国患者,随机分为3组,分别通过皮下注射方式给予Cosentyx 300mg (n=221),Cosentyx 150mg (n=110),安慰剂 (n=110)。研究主要终点是第12周PASI 75和IGA2011 0/1。次要终点是第12周的PASI 90。
结果显示,Cosentyx在中国患者中起效迅速、疗效出色。病情改善在治疗的第3周就能体现,且疗效随治疗时间延长而更加显著。Cosentyx 300mg治疗组第12周PASI 75患者比例为97.7%,80.9%的患者达到PASI 90。安全性方面,Cosentyx耐受性良好,不良事件发生率与之前的研究一致。
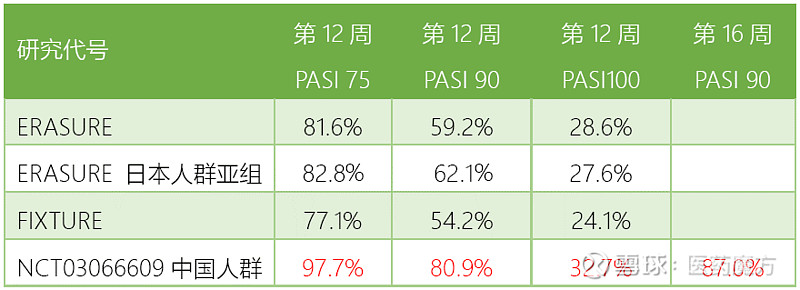
Cosentyx对中国银屑病患者显现出来的疗效数据令人惊喜,如果对比之前发表过以安慰剂为对照的临床研究数据,Cosentyx对中国银屑病患者的疗效和安全性还优于一些国际数据(如上表所示),更为难得。
不同PASI皮肤清洁情况(来源:诺华中国官网)
银屑病目前是一种无法治愈的慢性疾病,中国患者众多,数量接近700万,但是受关注程度相比癌症而言并不算高。银屑病患者更容易因为患病部位皮肤暴露和病情反复发作产生抑郁、自卑、焦虑、社交恐惧等心理疾病,对家庭照护也是非常大的负担。
但是长期以来,中国银屑病治疗首选外用药、光疗,其次是内用(口服或注射)甲氨蝶呤、环孢素、维A酸等副作用较大的传统化药,生物制剂通常是最末的选择。Cosentyx在中国患者中获得出色数据以及获批上市标志着中国的银屑病治疗进入新纪元,有望提升生物制剂在中国银屑病治疗中的治疗地位,推动中国银屑病临床治疗的进步。
10月中旬的EADV2019大会上,Cosentyx针对中国患者的III期研究52周数据发布。几乎所有接受300mg治疗的患者在52周内疗效稳定,而且实现PASI 90和PASI 100的患者比例较第12周还有所上升,提示有更多的患者可以从Cosentyx长期治疗中获益。
2、奥拉帕利
公司:阿斯利康
机制:PARP抑制剂
疾病:胰腺癌
研究代号:POLO(III期)
6月2日,阿斯利康在ASCO2019大会上公布了PARP抑制剂奥拉帕利一项代号为POLO的胰腺癌III期研究结果。POLO研究纳入154例接受一线含铂化疗后疾病未发生进展的胚系BRCA突变转移性胰腺癌患者,分别给予奥拉帕利(300mg,bid)和安慰剂作为一线维持疗法,直至疾病进展。对比考察奥拉帕利与安慰剂在无进展生存等方面的疗效和安全性差异。
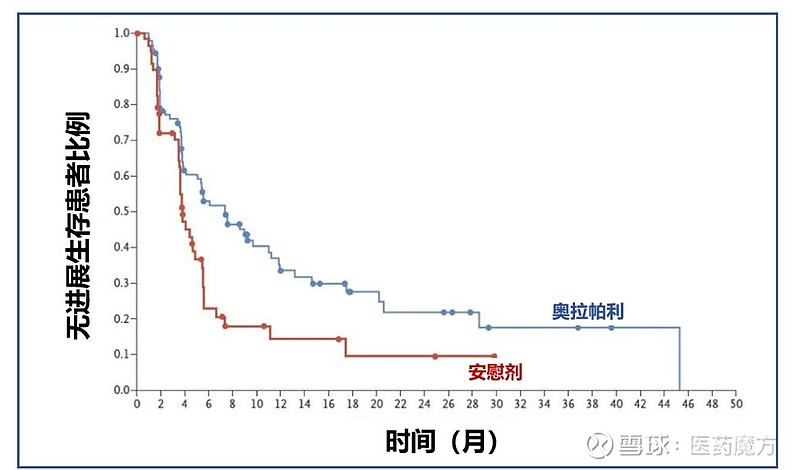
结果显示,奥拉帕利作为一线维持疗法相比安慰剂使胰腺癌患者的无进展生存期翻倍(7.4 vs 3.8个月),疾病进展风险降低了47%(HR 0.53),1年无进展生存率翻倍(33.74% vs 14.5%),2年无进展生存率翻倍(22.1% vs 9.6%)。
POLO研究患者无进展生存数据
胰腺癌是一种恶性程度和死亡率都非常高的肿瘤,5年生存率仅有大约6%(2%-9%),被称为“癌中之王”。胰腺癌非常难治,多年来的主流治疗方案就是以吉西他滨为基础的化疗药组合,对胰腺癌患者生存期的改善都非常有限,20多年来无明显突破,临床治疗需求远未得到满足。、
从患者获益角度上看,胰腺癌中的BRCA突变率大约为7%。POLO研究提示BRCA突变的转移性晚期胰腺癌患者在以含铂化疗方案获得宝贵的临床缓解之后,再单药使用奥拉帕利作为一线维持治疗可以显著延长一线治疗的无进展生存期,不影响患者生活质量,并且让2年无进展生存率翻倍,提升可接受二线治疗的患者比例,这是胰腺癌临床治疗的重大突破,对于初治的转移性胰腺癌患者意义重大。
3、AMG-510
公司:安进
机制:KRAS抑制剂
疾病:实体瘤
研究阶段:I期
6月3日,安进在ASCO2019大会上口头报告了KRAS G12C抑制剂AMG-510的首个人体临床试验结果。该项开放标签I期研究入组了35例既往接受过至少2线治疗的KRAS G12C突变实体瘤患者,包括14例非小细胞肺癌患者,19例结直肠癌患者,2例其他类型肿瘤患者。按照给药剂量分为4个队列,分别给予AMG-510 每日1次180,360,720,960mg。研究的主要终点是安全性,次要终点包括药动学、客观应答率(每6周评估1次)、应答持续时间、无进展生存期。
结果显示,在10例可评估的NSCLC患者中,有5例(50%)获得部分缓解(PR),4例疾病稳定(SD),疾病控制率达到90%(9/10);5例获得PR的患者在读取数据时已经治疗7.3-27.4周,并且仍在接受治疗。其中有1例获得PR的患者在读取数据后病情继续改善,在第18周获得完全缓解(CR)。在18例可评估的结直肠癌患者汇总,13例患者实现SD,并且大多数是接受180或360mg剂量水平的药物。
在9月份的WCLC2019大会上,AMG-510这项I期研究的数据做了进一步更新,在13例疗效可评估的NSCLC患者中,有7例部分缓解,6例疾病稳定,疾病控制率为100%,疗效与此前相当。
AMG-510结构式
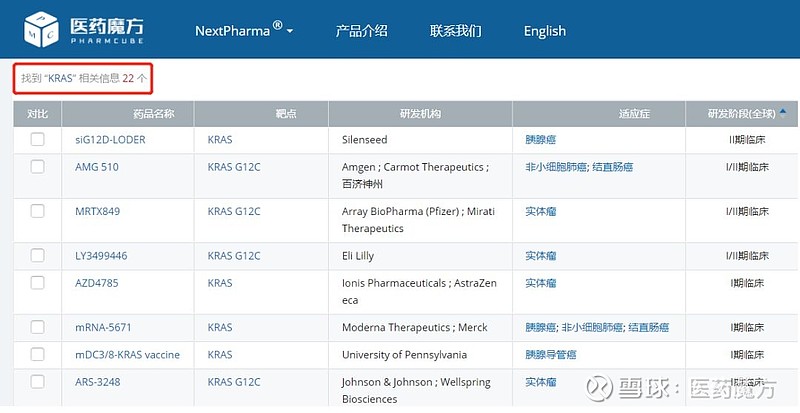
AMG-510的这项I期研究结果具有里程碑意义,让产业界为之沸腾,因为这是针对“不可成药"靶点KRAS的首个临床候选药物,让大家看到了针对KRAS突变肿瘤这一难题的破解之道,比如KRAS突变率高达97%的胰腺癌。KRAS G12C突变在NSCLC中的发生率大约为13%,在结直肠癌中大约为3%-5%,在其他实体瘤中大约为1%-2%,同样是不小的市场。在AMG-510之后,诸多KARS概念项目在AMG-510之后纷纷上马启动开发。截至目前,NextPharma收录的KRAS相关项目已经达到了22个。
4、泰它西普
公司:荣昌生物
机制:TACI-Fc融合蛋白
疾病:系统性红斑狼疮
研究阶段:II/III期
7月12日,荣昌生物在人民大会堂新闻发布厅公布了泰它西普(RC18)一项治疗系统性红斑狼疮(SLE)的关键II/III期临床研究的结果。该研究采用多中心、随机、双盲、安慰剂对照的研究,入组249例患者SLE患者,结果显示泰它西普高剂量组治疗48周的SRI(系统性红斑狼疮应答指数)显著高于安慰剂对照组(79.2% vs 32.0%),到达了研究的主要终点,而且安全性表现优异,病人耐受性良好。
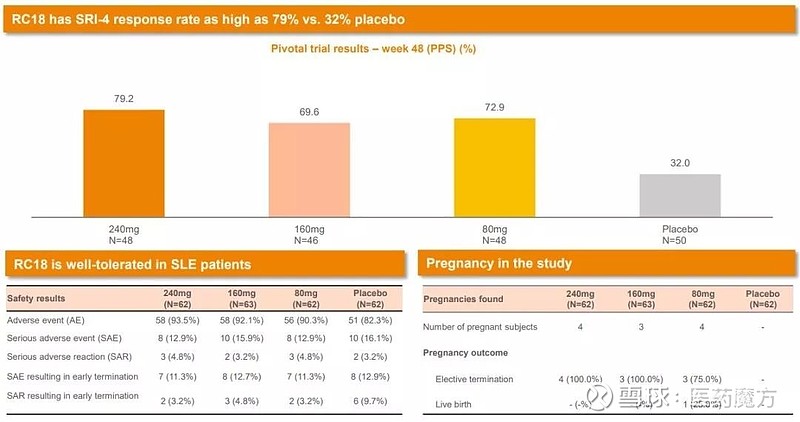
基于此研究的数据,荣昌生物已经向NMPA提交了泰它西普的上市申请,并被CDE正式纳入了优先审评程序。这项研究也称得上是中国创新药为数不多的高光时刻之一,因为SLE的临床试验非常困难,国外有多项III期研究失败。
红斑狼疮是一种自身免疫性炎症性结缔组织病。系统性红斑狼疮是红斑狼疮各类型中最常见(约占70%)也是最严重的一种,多发于青年女性,发病年龄以20~40岁最多。由于会累及肾脏、呼吸和神经系统,10年生存率低于50%,近年逐渐提升到60%~70%。我国流行病学调查报告显示,SLE患病率为70/10万人,妇女中比例更高,可达到113/10万人。中国大约有患者100万人,临床需求远未得到满足。
SLE的传统治疗药物大多是一些没有选择性的免疫抑制剂,用来缓解炎症反应,比如阿司匹林、环磷酰胺、糖皮质激素类药物,还有就是1955年4月被FDA批准上市的羟氯喹。一直到2011/3/9,由GSK开发的注射用贝利尤单抗被FDA批准治疗SLE,是近60年来全球批准的首个红斑狼疮新药,此后该领域又无其他新药重磅进展。
贝利尤单抗属于first in class的B淋巴细胞刺激因子(BLyS,也叫BAFF)的特异性抑制剂,与血清中的可溶性BLyS有较高的亲和力,进而阻断BLyS与B细胞上的受体结合,抑制B细胞增殖以及B细胞向浆细胞的分化,从而减少血清中B细胞产生的自身抗体,达到治疗SLE的目的。
泰它西普是一款TACI-Fc融合蛋白,能够同时靶向于 BLyS/APRIL 两个靶点,与安慰剂相比对SRI的改善程度要明显好于贝利木单抗,并且价格可能会更亲民,这也让大家对这款国产SLE新药充满期待。
5、达格列净
公司:阿斯利康
机制:SGLT-2抑制剂
疾病:心衰
研究代号:DAPA-HF研究(III期)
9月1日,阿斯利康在ESC2019大会上公布了达格列净III期DAPA-HF研究的结果。这是首个在射血分数降低心衰患者(不管是否伴有2糖尿病)中应用SGLT-2抑制剂治疗心衰的结局研究,结果发现达格列净能使心血管死亡或心力衰竭恶化的主要复合终点发生风险降低26% 。
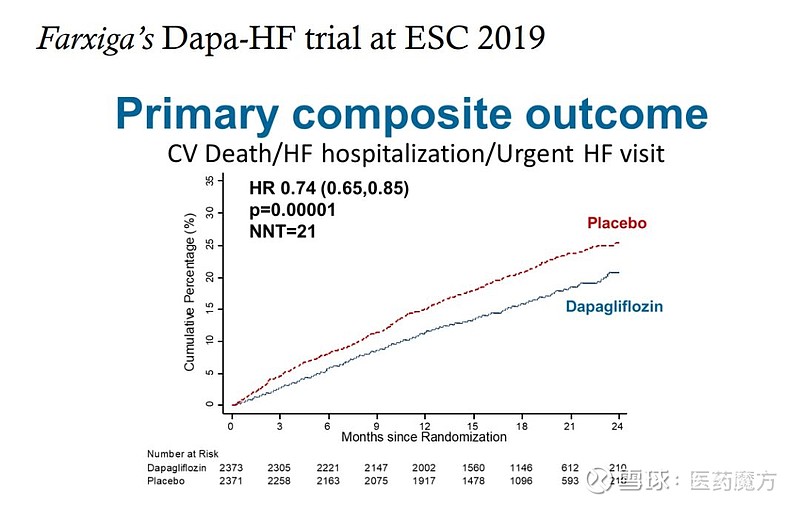
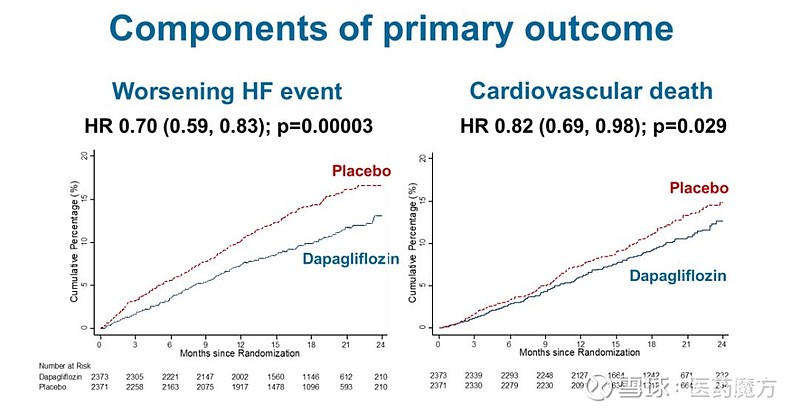
DAPA-HF研究对主要复合终点的各项组成部分单独进行了分析。达格列净组心力衰竭首次恶化的发生风险下降30%,因心血管疾病导致的死亡风险下降18%。达格列净对主要复合终点的影响,在研究的各个关键亚组中表现基本一致。
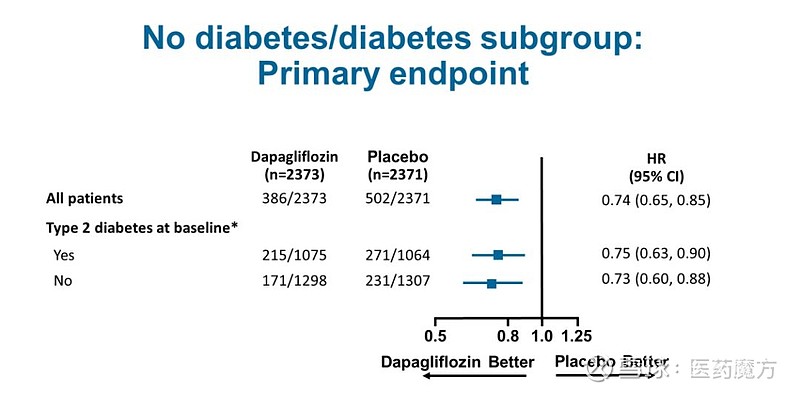
达格列净在DAPA-HF研究中的安全性状况与该药物既往已确认的安全性一致。在治疗心衰时常被关注的低血容量(7.5% vs 6.8%)和肾脏不良事件(6.5% vs 7.2%)发生率与安慰剂相当。在两个治疗组中,严重低血糖事件(0.2% vs 0.2%)均罕见发生。
心衰是心脏泵血功能不足的一种严重疾病,5年死亡率近50%,并且因为活动受限会使得患者的生活质量急剧下降。全球大约有2600万例心衰患者,美国大约有650万例,并且流行率还在上升。心衰新药开发进展缓慢,过去20年也只有诺华Entresto一个重磅药物获批,临床需求远未得到满足。
达格列净属于SGLT-2抑制剂,是新型的口服降糖药,已经明确的作用机制是可以抑制肾脏对葡萄糖的重吸收,通过尿液排泄的形式降低体内血糖水平。但是达格列净可用于治疗心衰(不管是否有2型糖尿病),降低26%的心血管死亡或心衰恶化风险,这已经超出了大家当前对于SGLT-2作用机制的认识。达格列净作为首个首个证明对心衰患者结局有获益的SGLT-2抑制剂,具有里程碑意义。
6、inclisiran
公司:The Medicines Company
机制:RNA疗法
疾病:高血脂
研究代号:ORION-11(III期)
9月2日,The Medicines Company在ESC2019大会上公布了inclisiran首个关键III期ORION-11研究的结果。ORION-11研究入组1617例有心血管风险(ASCVD)、最高剂量他汀无法有效控制LDL-C的高血脂患者,评估皮下注射inclisiran 300mg(前两针间隔3个月,此后每6个月一针)的疗效和安全性。
结果显示,治疗第17个月经安慰剂校正后inclisiran组LDL-C水平降低54%,治疗第3-18个月经安慰剂校正后inclisiran组时间-平均LDL-C水平降低50%,而且观察17个月没有发现之前研究以外的安全性问题。
Inclisiran是The Medicines Company公司研发的RNA干扰疗法(小干扰RNA),作用靶点是已经被证明可以有效降低LDL-C进而降低心血管风险的PCSK9,通过RNA的干扰作用降低mRNA水平并抑制PCSK9蛋白的生成。疗效方面,inclisiran在ORION-11研究中降低LDL-C的效果同样不俗。
与PCSK9单抗药物不同,inclisiran可以通过化学合成获得,生产成本要低得多,而且给一年只需给药2次,可以给高血脂患者带来极大的便利。inclisiran的数据足够优秀,治疗方式足够革新,如果获批,inclisiran也会是心血管药物领域的颠覆者。
7、 KarXT
机制:毒蕈碱受体调节剂
疾病:精神分裂症
研究阶段:II期
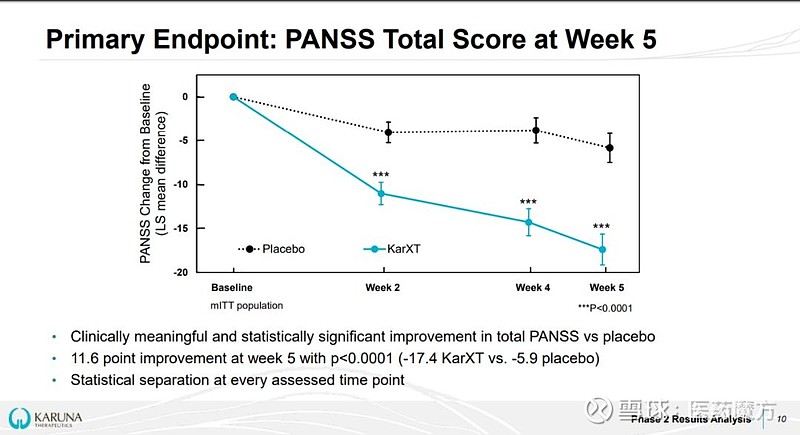
11月18日,Karuna Therapeutics公司宣布KarXT治疗成人精神分裂症的II期研究到达主要终点。在这项随机、双盲、安慰剂对照研究中,182例正在经历精神病急性发作的18~60岁成人精神分类症患者完成药物洗脱期之后,按照1:1随机分组,分别给予KarXT或安慰剂,连续5周。结果发现,KarXT治疗组第5周PANSS总评分较基线的改善程度相比安慰剂对照组的改善程度具有临床意义和统计学意义差异(-17.4 vs -5.9),KarXT治疗组PANSS总评分多改善了11.6分,到达了主要终点。
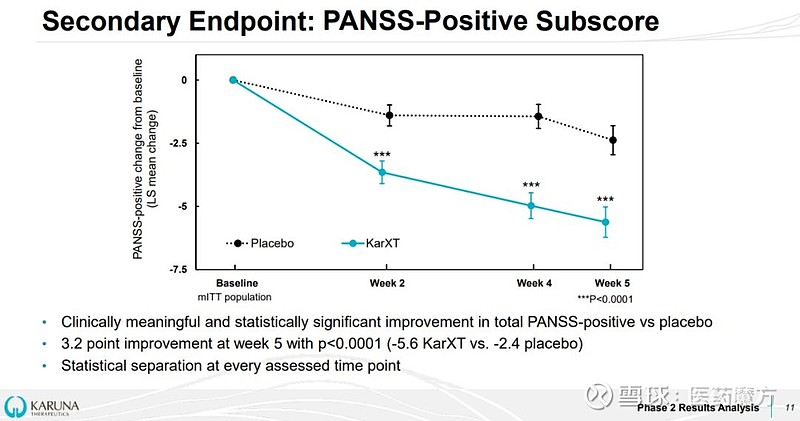
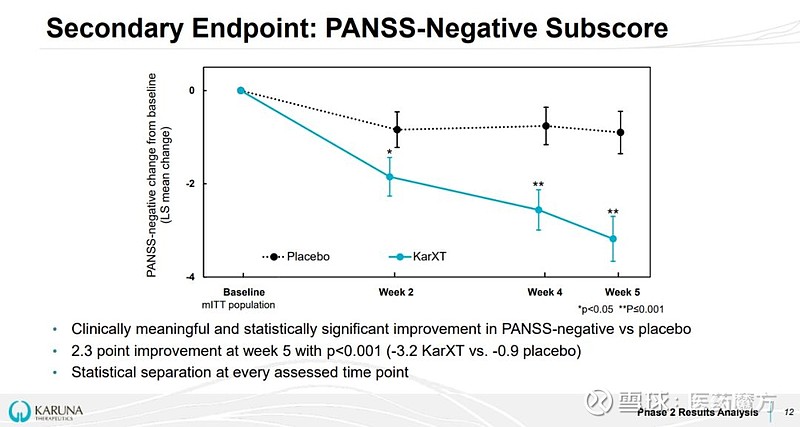
在PANSS阳性症状评分、PANSS阴性症状评分方面,KarXT治疗组的改善也均较安慰剂组有显著差异。
KarXT在试验中的给药剂量比较灵活。第1~2天,给予呫诺美林50mg/曲司氯胺20mg(每日2次)。第3~7天,将剂量增加到呫诺美林100mg/曲司氯胺20mg。从第8~35天,如果患者耐受性良好,允许将剂量增加到呫诺美林125mg/曲司氯胺30mg,不过之后也可以根据患者的耐受情况将剂量下调至呫诺美林100mg/曲司氯胺20mg。结果发现,91%的患者可以按照弹性剂量方案设计递增到最高剂量。
安全性方面,KarXT耐受性良好,中断治疗的患者比例与安慰剂组相似(20% vs 21%),因为治疗相关急性不良事件终止治疗的患者人数与安慰剂组相同(2 vs 2例)。KarXT组和安慰剂总体不良事件发生率分别为54%和43%。
KarXT是由呫诺美林和曲司氯胺组成的毒蕈碱受体的口服调节剂。其中,呫诺美林是中枢毒蕈碱受体M1和M4双激动剂,之前虽然未曾获批过,但是化合物专利早已过期;而曲司氯胺则是临床上使用多年的外周毒蕈碱受体拮抗剂。所以这个精神分裂症复方算是“老药新用”。
由于两种成分经不同的肝药酶代谢,并且半衰期不同,所以在搭配使用的机制上就显得比较巧妙。比如,精神分裂症患者的阳性症状(如躁狂、易怒)容易控制,但阴性症状(如冷漠、意志贫乏)较难改善,呫诺美林可以刺激中枢毒蕈碱受体,用于可以缓解精神分裂症患者的阴性症状。曲司氯胺不能进入中枢,不会影响呫诺美林的作用,同时可以凭借较长的半衰期持续抑制呫诺美林的外周毒蕈碱受体激动副作用。
精神分裂症是一种慢性精神疾病,影响全球2100万人口。2017年美国大约有270万精神分裂症患者。目前至少1/3的精神分裂症患者对现有治疗不应答,74%的患者在治疗18月后会因严重副作用停止治疗。精神分裂症药物的开发非常困难,临床失败消息居多,很多厂家都已放弃。因此KarXT的II期研究成功算是精神分裂症领域为数不多的好消息之一。KarXT值得豪赌一把,Karuna Therapeutics也获得了ARCH Venture的风投资金。
8 、Tecentriq+贝伐珠单抗
公司:罗氏
机制:PD-L1单抗+VEGF-A单抗
疾病:肝细胞癌
研究代号:IMbrave 150(III期)
11月22日,罗氏在ESMO-Asia 2019大会上公布了Tecentriq+贝伐珠单抗 VS 索拉非尼一线治疗肝细胞癌(HCC)患者的IMbrave 150研究的详细结果。
IMbrave 150研究采用全球多中心、开放标签设计,501例既往未接受过系统性治疗的不可切除的HCC患者按照2:1分组,分别在每个周期(21天为一个周期)的第1天经静脉输注给予阿替利珠单抗1200 mg、贝伐珠单抗15 mg/kg,或者在每个周期的第1-21天口服给予索拉非尼400 mg(每天2次)。直至出现不可接受的毒性或由研究者确定继续治疗无临床获益。
结果显示,对于既往未接受系统治疗的不可切除肝细胞癌患者,Tecentriq+Avastin作为一线疗法相比索拉非尼相显著延长了患者总生存期(13.2 vs 未成熟),使患者死亡风险降低42%(HR=0.58;95%CI:0.42~0.79;P=0.0006);同时显著延长了PFS(4.3 vs 6.8个月),6个月无进展生存率分别为55%和37%,使得疾病恶化或死亡风险降低41%(HR=0.59;95% CI:0.47~0.76;P<0.0001)。患者生存获益显著。
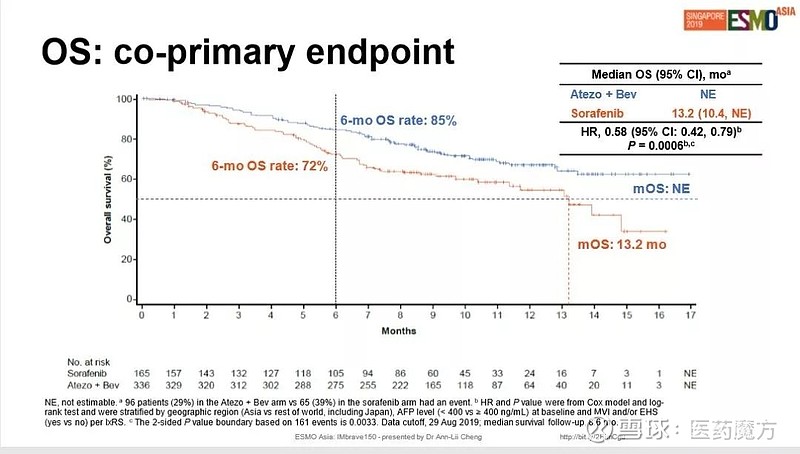
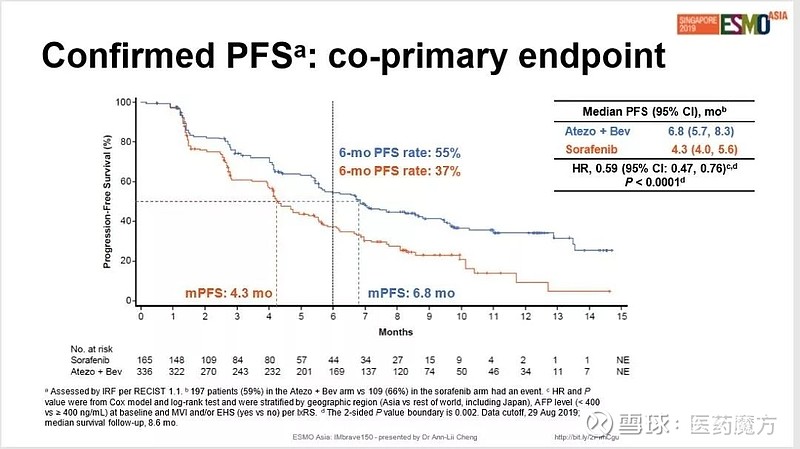
安全性方面,Tecentriq+Avastin组3~4级严重不良事件发生率与索拉非尼组相似(57% vs 55%),5级严重不良事件发生率接近(5% vs 6%)。
肝癌是常见高发癌种,全球每年新发肝癌约85.4万例,中国为46.6万例,占全球的一半;全球每年因肝癌死亡患者81万例,中国为42.2万。当前肝癌的一线标准疗法主要是索拉非尼靶向治疗,或者含奥沙利铂的FOLFOX化疗方案,但是疗效有限。
索拉非尼获批后的10多年来,还没有药物能在一线疗法中“头对头”打败索拉非尼。O药、K药也都是作为肝癌的二线疗法被加速批准,但是在上市后的确证性研究中均未达到预设终点,以失败告终。
Tecentriq+Avastin的联合方案打破了肝细胞癌10多年来一线治疗的僵局,带来了迄今为止不可手术切除的肝细胞癌一线系统治疗III期临床研究中所显示出的最好的疗效,也是10多年来首个临床研究打败现有标准疗法索拉非尼的全新疗法。
9、mosunetuzumab
公司:罗氏
机制:CD3/CD20双特异性抗体
疾病:复发难治NHL
研究代号:GO29781(I/Ib期)
12月8日,罗氏在ASH2019年会上公布了mosunetuzumab(RG7828)单药使用对复发难治性B细胞非霍奇金淋巴瘤患者的I/Ib期临床数据((NCT02500407)),这些患者中甚至包括一部分接受过CAR-T疗法但疾病仍复发或者对CAR-T疗法产生抵抗的难治性患者,可以说是几乎无药可用了。
结果显示,mosunetuzumab单药在复发难治惰性NHL患者中的ORR为62.7%(42/67),完全应答为43.3%(29/67),而且完全应答患者中82.8%(24/29)可以将应答状态保持26个月;在复发难治侵袭性NHL中的ORR为37.1%(46/124),完全应答为19.4%(24/124),完全应答患者中70.8%(17/24)可以将应答状态保持16个月。
对于接受过CAR-T治疗的患者,ORR为38.9%(7/18),CR 22.2%(4/18)。常见不良事件包括细胞因子突释综合征(28.9%),其中20.0%为1级,1.1%为3级。
NHL是淋巴瘤最常见的类型,占80%-90%,有诸多亚型。作为血液癌症,NHL肿瘤细胞更容易被药物触达,一线治疗的缓解率通常较高,但是由于微小残留病灶同时也极容易复发。NHL患者通常存在多次复发多线治疗的情况,直到最后无药可用。CD20/CD3双特异性抗体Mosunetuzumab让这类患者看到了曙光。
Mosunetuzumab可以同时结合T细胞上的CD3和B细胞上的CD20,重新定向激活内源性T细胞以杀死恶性B细胞。相比而言,CAR-T疗法是把体外扩增好的对表达特异抗原肿瘤细胞有杀伤能力的大量T细胞回输到体内,相当于让装备好的“外援”进入人体战斗,而Mosunetuzumab是在进入体内后,实现对T细胞和B细胞的捆绑以及定向杀伤。
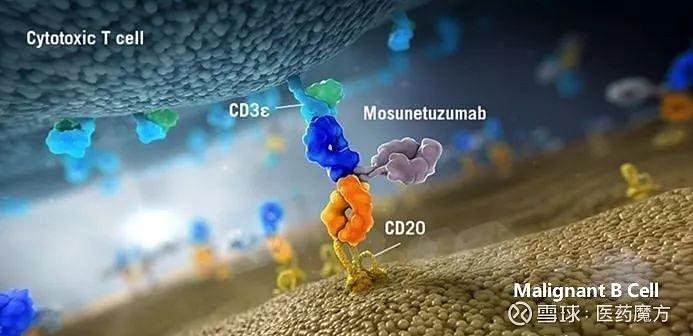
从过程上看,Mosunetuzumab更温和一些,这一点在不良反应的安全性数据上有体现,总体而言Mosunetuzumab的不良反应级别更低,也更容易管理。另外,Mosunetuzumab的半衰期为6-11天,所以看到了患者的CR持续期可以维持较长时间。
10、DS-8201
公司:阿斯利康
机制:HER2-ADC
疾病:HER2+乳腺癌
研究代号:DESTINY-Breast01(II期)
12月11日,阿斯利康/第一三共在SABCS2019大会上公布了靶向HER2的抗体偶联药物DS-8201 (trastuzumab deruxtecan)的II期DESTINY-Breast01临床研究的结果。
这项单臂、II期研究共招募184例对已有HER2药物耐药的HER2阳性乳腺癌患者。这些患者入组前已经接受了平均6种方案的深度治疗,包括Kadcyla(100%)、曲妥珠单抗(100%)、帕妥珠单抗(65.8%)、其他抗HER2疗法(54.3%)、激素疗法(48.9%)以及其他系统疗法(99.5%),但是仍无法控制病情,属于临床上已经无药可用的患者。
结果显示,DS-8201的客观应答率为60.9%,疾病控制率达到97.3%。这组数据与DS-8201在I期研究中针对111例HER2阳性乳腺癌患者的临床结果基本一致(分别是59.5%和93.7%),提示药物疗效稳定可靠。
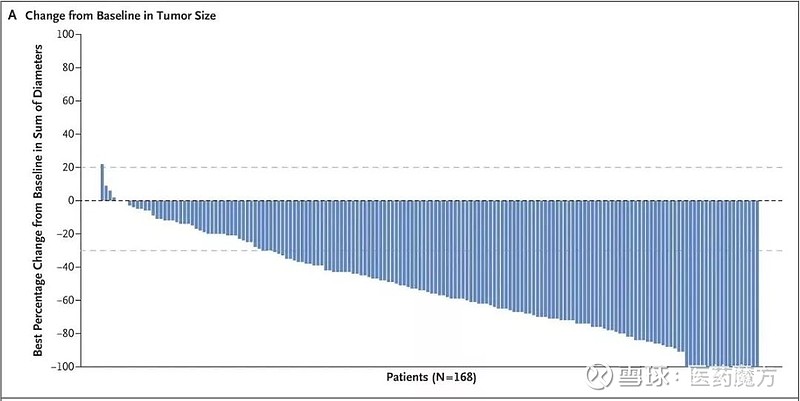
另外,缓解持续时间14.8个月,无进展生存期为16.4个月,12个月总生存率达到了86%。这个数据对于无药可用的HER2乳腺癌患者而言已经相当惊艳。
HER2阳性乳腺癌占所有乳腺癌患者的大约20%,虽然侵袭性强、恶性程度高,但并不是最让人绝望的癌症,因为有诸多HER2靶向疗法可用,临床预后并不算差。不过对于经过多线HER2治疗耐药的患者,就会陷入绝望,迫切需要新的治疗选择。DS-8201针对的就是既往HER2疗法失败的患者,有望填补临床需求。DS-8201已于2019年9月和10月分别向日本PDMA和美国FDA提交了上市申请。