2019年接近尾声,回顾一下今年刷屏的明星药。
NO.1
AMG-510——全村的希望
AMG-510火得出人意料,也火得情理之中。作为产业界研究RAS通路30多年后首个进入临床的KRAS G12C候选药物,AMG-510在今年ASCO大会上的蹿红,就像隐没在深山的小村落里突然考出来一个清华大学生一样吸引眼球。
RAS基因家族是发现最早、突变概率最高的人类致癌基因,有KRAS、NRAS、HRAS三个成员,其中又以KRAS突变最为流行,占85%。一直以来,RAS蛋白被认为是“不可成药”的靶点,因为RAS蛋白表面光滑没有小分子结合口袋。而AMG 510是通过结合KRAS蛋白表面隐藏的沟槽来发挥作用,可以与突变的KRAS蛋白上的半胱氨酸发生不可逆结合,从而使KRAS进入失活状态。
ASCO2019大会公布数据时,AMG 510入组了35例既往接受过至少2线治疗的KRAS G12C突变患者,包括14例NSCLC患者,19例CRC患者,2例其他类型肿瘤患者。在10例可评估的NSCLC患者中,有5例部分缓解,4例疾病稳定,疾病控制率达到90%,其中1例获得PR的患者在读取数据后病情继续改善,在第18周获得完全缓解。在18例可评估的CRC患者中,13例疾病稳定。
ESMO2019大会公布数据时,AMG510入组了76例KRAS G12C突变的实体瘤患者。在13例疗效可评估(给药剂量960mg/d)的NSCLC患者中,有7例部分缓解,6例疾病稳定,疾病控制率为100%,疗效与此前相当。但是在12例疗效可评估CRC患者中,只有1例部分缓解,10例疾病稳定,疾病控制率为92%。虽然对NSCLC疗效可观,但是AMG510对结直肠癌的疗效引起投资人担忧。
考虑入组的患者经过2线重度治疗以及观察病例数和时间都不充分,我们可以对AMG510的后续数据保持关注和期待。毫无疑问,AMG510具有里程碑意义,大家似乎从它的身上看到了针对KRAS突变肿瘤这一难题的破解之道,也让PD-1之后积压的投资热情又找到了一个新出口。诸多KARS概念项目在AMG501之后纷纷上马启动开发。截至目前,NextPharma收录的KRAS相关项目已经达到了22个。
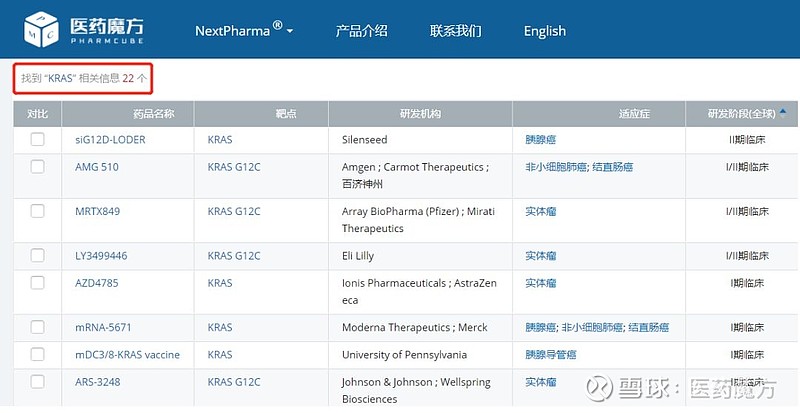
KRAS突变多见于实体瘤,特别是胰腺癌中的突变率高达97%。而特定位点的KRAS G12C突变在NSCLC中的发生率大约为13%,在结直肠癌中大约为3%-5%,在其他实体瘤中大约为1%-2%。美国每年大约有3万例新确诊的KRAS G12C突变癌症患者,这个市场还是非常诱人的。
NO.2
奥拉帕利——下一个神药
Lynparza(奥拉帕利)之所以被列为2019年最受关注的明星药物,除了其凭借卵巢癌、乳腺癌适应症取得亮眼销售成绩外,还因为其在胰腺癌、前列腺癌领域取得了具有重大临床意义的突破,极大拓宽了PARP抑制剂的市场边界。
今年6月的ASCO大会期间,III期POLO研究公布积极结果。奥拉帕利作为一线维持疗法用于铂化疗后疾病未发生进展的生殖系BRCA突变(gBRCA+)转移性胰腺癌患者,显示奥拉帕利作相比安慰剂使胰腺癌患者的无进展生存期翻倍(7.4 vs 3.8个月),疾病进展风险降低了47%(HR 0.53),1年无进展生存率翻倍(33.74% vs 14.5%),2年无进展生存率翻倍(22.1% vs9.6%)。
转移性胰腺癌疾病恶化速度快,在所有癌症中5年存活率最低,被大家称作“癌症之王”,多年来的主流治疗方案就是以吉西他滨为基础的化疗药组合。奥拉帕利在患者接受初次化疗使得疾病得到控制以后维持使用,显著推迟疾病恶化或复发时间,提升可接受二线治疗的患者比例,是20多年来胰腺癌维持治疗的重大突破。
今年ESMO大会期间,前瞻性III期PROfound研究结果的详细数据亮相。对于已接受新型内分泌治疗后耐药的转移性去势抵抗性前列腺癌(mCRPC)患者,在携带BRCA1/2、ATM、CDK12等DNA同源重组修复(HRR)缺陷相关基因突变的队列A中,奥拉帕利相比恩杂鲁胺或阿比特龙可以显著延长影像学无进展生存期(rPFS,7.4 vs 3.6个月),使得疾病进展或死亡风险降低66%。在携带其他12个广泛HRR基因突变中任何一个的队列B中,中位rPFS也得到显著延长(5.8 vs3.5个月),疾病进展和死亡风险降低51%。
PROfound研究的意义在于,不仅证明了奥拉帕利对于接受过新型内分泌治疗后疾病进展的mCRPC患者有良好的疗效,还提示了HRR缺陷相关基因突变是前列腺癌患者接受PARP抑制剂的获益标志物,同时也加快了前列腺癌临床治疗从化疗时代向精准靶向治疗时代迈进。
实际上,诸多类型肿瘤中都存在HRR缺陷相关的基因突变,意味着奥拉帕利的适应症拓展之路仍很宽阔。DNA修复机制相关研究成果在2015年获得了诺贝尔化学奖,奥拉帕利在2014年底作为全球首个PARP抑制剂上市原本当年就该迎来高光时刻,只可惜当时PD1、CAR-T等肿瘤免疫疗法风头正劲,行业内对PAPR抑制剂的关注度相对不够,即便阿斯利康自身对奥拉帕利的开发优先级可能也在I药之后。但是随着大家对免疫治疗的认识加深,PARP抑制剂重回视野中心,不仅PARP抑制剂的全球项目交易频繁,老辣的默沙东也以K药深度绑定奥拉帕利的联合开发。奥拉帕利会成为下一个抗肿瘤神药吗?
NO.3
inclisiran——降脂超越想象
传统认知上,高血脂这种慢性病是需要每日服药来控制病情进展和并发症发生的,能把服药次数从每天2次减为1次已经是谢天谢地了,你能想象一个高血脂的病人,每隔半年才治疗一次吗?这跟没得病不是一样的吗?如果这种降脂药上市了,那些他汀厂家还怎么活?把患者用药需求强度降得这么低,研发这种新药的厂家又是怎么想的?这家公司的名字叫The Medicines Company,专注于开发革命性的心血管疾病疗法,11月底刚刚被诺华以97亿美元收购。有望实现一年给药2次的这款降血脂药物inclisiran是一款RNA干扰疗法(干扰siRNA),请大家记住他们的名字。9月初的ESC2019大会上,inclisiran每6个月给药1次的首个关键性III期ORION-11研究的完整数据首次公布。结果显示,对于最大耐受剂量他汀已经无法控制LDL-C水平的患者,一年两次皮下注射给药300mg inclisiran,治疗第17个月经安慰剂校正后inclisiran组LDL-C水平降低54%,治疗第3-18个月经安慰剂校正后inclisiran组时间-平均LDL-C降低50%
11月初的AHA2019年会上,ORION-10研究结果公布,主要终点方面,inclisiran在治疗第17个月经安慰剂调整的LDL-C水平降低了58%、从第3-18个月经安慰剂调整的inclisiran组时间-平均LDL-C水平降低了56%。
inclisiran针对的靶点是机制和疗效证据非常清晰的PCSK9,不过与当前2个已经上市的PCSK9抗体药物相比,inclisiran在生产成本上要便宜得多,在给药次数上更是显著优于需要每2周或每月给药1次的PCSK9单抗,而且对于他汀药物已经无法控制血脂水平的患者,inclisiran还可以让LDL-C再降50%,这种超越想象的“黑科技”药物,想想还真是令人激动。
NO.4
Aducanumab——数据统计师的胜利
如果仅仅是因为III期临床失败让Biogen市值一夜缩水150亿美元,aducanumab恐怕还不能被列为2019年的明星药物,毕竟Aβ领域埋葬的亡魂太多,再多上aducanumab一个也不会让大家感到意外。意外的是,谁会想到aducanumab竟能死而复生?
10月22日,已经被大家在内心里判处死刑整整7个月的aducanumab,竟然被Biogen宣布将于2020年初向FDA提交上市申请。一夜之间,Biogen公司的市值又大涨百亿美元,尽收之前失地。
药还是那个药,试验那是那个试验,但是数据已经不是之前的数据了。
之前宣布aducanumab代号为ENGAGE和EMERGE的两项III期试验失败的依据是由独立数据监测委员会做出的。他们在进行中期数据分析后认为,aducanumab对于阿尔茨海默病以及轻度阿尔茨海默病痴呆引起的轻度认知功能损伤没有改善作用,很可能难以到达主要疗效终点 。
帮Biogen在黑暗中看到希望之光的是他们自己公司的医学数据统计师们。他们在分析了更大的数据集之后,发现在名为EMERGE的临床试验中,接受高剂量aducanumab治疗的AD患者在第78周的认知能力评分(CDR-SB)与对照组相比显著降低了23%,到达了主要终点。另外在其他几项次要终点指标上,高剂量aducanumab治疗组较安慰剂也显示出了持续降低的效应。影像数据也显示,aducanumab治疗组第26周和78周的淀粉样蛋白斑负担水平较安慰剂组有明显减轻。于是,Biogen在拿到最新分析结论后便跟FDA沟通,宣布了将会提交NDA的决定。
尽管Biogen在12月初的阿尔茨海默病临床试验会议上公布了EMERGE试验结果反转的具体原因,业内对于FDA届会不会批准aducanumab上市仍抱有疑问。但无论最终结果如何,医学数据统计分析师的价值在这场征服阿尔茨海默病的新药开发大战中得以凸显出来。
NO.5
泽布替尼——中国创新药新高度
泽布替尼被FDA批准可以说是在大家意料之中,但是能比预定的审批期限(2020/2/27日)提前3个月之多,还是多少超出了大家预期。据内部知情人士透露原委:FDA去临床中心核查,零major find。回顾中国药企出海历程,从原料药到制剂,从仿制到创新,从me too到fast follow,几代人的努力终于换来了首个被FDA批准的诞生自中国本土的原创新药,这称得上是中国新药从0到1的突破,具有里程碑意义。
无论百济神州高举高打的美国Biotech模式在国内多么稀缺和难以复制,但承载诸多期望的泽布替尼确实是代表了中国创新药目前达到的一个新高度。迈出了艰难的第一步之后,相信更多的突破也会随之而来。回到泽布替尼本身,被FDA批准上市只是成功的第一步,如何在美国卖一款原创新药是百济神州和中国制药公司面临的新命题,毕竟美国市场表现不成功或者低于预期的新药也比比皆是。泽布替尼在美国的定价是12935美元/月,与首个BTK抑制剂伊布替尼相当。另据吴晓滨博士透露,百济神州在美国的商业团队已经建立、培训完毕,美国患者最快年内就能用到这款中国新药。
NO.6
NC318——华人之光
陈列平教授被视作肿瘤免疫治疗时代的华人之光,因发现PD-L1(又称B7-H1)并将其应用于肿瘤免疫治疗的杰出贡献而得到国际学术界的认可。尽管去年与诺贝尔奖擦肩而过让不少人略感遗憾,但是不可否认,陈列平教授作为拥有极高成就的华人面孔,其在肿瘤免疫治疗领域的任何进展都备受关注。NextCure由陈列平和Michael Richman在2015年成立,2016年获得6700万美元A轮融资,2019年5月8日登陆纳斯达克。
NextCure推进速度最快的在研项目NC318是一种靶向Siglec-15的单抗。从作用机制上看,Siglec-15在癌细胞和肿瘤浸润髓系细胞中也广泛表达,和PD1/PD-L1一样都是关键的免疫抑制蛋白,但是Siglec-15的表达与PD-L1完全不重叠。如此以来,NC318就具有用于PD-L1阴性患者的潜力。11月5日,癌症免疫治疗学会(SITC)的会议前摘要首次披露了NC318的I期数据,在其中7例PD-1治疗无效的NSCLC患者中观察到了1例CR,1例PR,1例SD且肿瘤体积减小,2例SD,缓解率达到29%,疾病控制率达到71%。这个数据与PD-1单抗早期临床试验的数据类似,资本市场闻风而动,一夜之间Nextcure股价从25.5美元大涨248%至92.22美元。
当日换手率也有35%,说明不少大赚一波的股东离场,也有不少新鲜的股东进场,二人互道一声“安好”。时隔一周之后,SITC会议公布的数据显示NC318早期数据不理想,Nextcure股价应声下跌超50%,完美吐回涨幅。抛开资本市场血腥的涨跌起伏,NC318如果能为PD-1治疗无效的患者提供新的治疗选择,绝对是肿瘤免疫治疗的一大突破。NC38目前治疗的患者数量还很少,我们可以对后续更多的数据保持关注。
NO.7
GV971——充满争议的突破
11月2日,周末,21:00。
猝不及防的,国产阿尔茨海默病新药甘露特钠胶囊(GV-971)在国家药监局官网上显示获批。毕竟,如果国家药监局再不加班加点得把通知发出来,一款国产新药在中国获批的消息就会借由国家邮政局11月1日正式发行的这张“方寸天地”传遍大江南北了。你说奇怪不奇怪?
甚至集邮杂志公众号早在1周前就已经预告将会发行这枚邮票,暗示GV-971的获批是板上钉钉。如果考虑到邮票发行还要提前制定年度或季度发行计划报批,邮票图稿的设计也需要时间上的提前量,GV-971的命运很可能早在几个月前就已确定。
有人说要把集邮杂志当做医药信息情报收集的来源渠道之一,这似乎并不必要。不过GV-971对外呈现的这种获批方式以及程序背后的意味,着实会让尊崇科学的医药人在内心深感不适。
回到GV-971这个药品本身,争议或质疑持续至今仍未消弭,包括由开发企业自身的黑历史臆断这家公司肯定做不出什么好药,或者是习惯了国外企业的惨痛失败形成思维惯性而对国产药能够实现突破并无信心,又或者是基于科学认知对GV-917临床试验的给药周期、安慰剂效应以及作用机制发起质疑……
从既成事实上看,GV-971获批绝对是阿尔茨海默病领域具有突破性意义的事件,但是事件本身对于中国制药产业的长期影响是好是坏目前难以评判。眼下汹涌的负面舆情也是开发企业和国家药监局必须面对和向公众澄清的,包括饶毅教授近期的实名举报一事让GV971的公信力再度下滑。
总之,阿尔茨海默病领域太需要数据证据令人信服的新药了,无论是医生患者,还是产业投资人、企业玩家,都是如此。尽管我们知道这个领域的新药研发真的很难。所以还是希望争议更多聚焦在科学讨论的层面,关注企业后续能否提供更充足的数据证据以及国家药监局对于这款“有条件批准”新药的后续动作。
$AMGEN-T(04332)$ $阿斯利康(AZN)$ $百济神州(BGNE)$ @今日话题 @雪球达人秀 #创新药#