Arcutis制药的ZORYVE是一种不含类固醇的局部PDE4抑制剂,此前已在美国获批用于治疗脂溢性皮炎和斑块状银屑病。据该公司昨日宣布,美国食品药品监督管理局已批准ZORYVE(roflumilast,罗氟司特)0.15%乳膏的补充新药申请,用于治疗成人和6岁及以上儿童患者的轻度至中度特应性皮炎。
特应性皮炎是一种常见的湿疹类型,这是一种慢性、复发性炎症性皮肤病,表现为红色、剧烈瘙痒的皮疹,可发生在身体任何部位,儿童和成人的表现可能不同。
ZORYVE是一种每日使用一次的无类固醇乳膏,可快速清除疾病并显著减少瘙痒,并专门研发为长期疾病控制的治疗选择。Arcutis计划在7月底之前向患者供应0.15%罗氟司特乳膏。

此次补充新药申请的批准是基于三项3期INTEGUMENT临床试验、一项2期剂量范围研究和两项1期药代动力学研究的积极结果。
其中,两项相同的平行组、双盲、赋形剂对照的3期临床试验INTEGUMENT-1(NCT04773600)和INTEGUMENT-2(NCT04773600),评估了1337名6岁及以上患有轻度至中度特应性皮炎的成人和儿童患者在患处皮肤上每日一次涂抹0.15%罗氟司特乳膏或赋形剂持续4周的安全性和有效性。
这两项研究均达到了其主要终点,即经过验证的特应性皮炎研究者整体评估(vIGA-AD)评分为皮肤症状清除或几乎清除,并且第4周时较起始有2级改善。在INTEGUMENT-1中,罗氟司特乳膏组(N=433)有32%的患者实现了以上结果,而赋形剂组(N=221)只有15.2%;在另一项研究中,罗氟司特乳膏组(N=451)为28.9%,赋形剂组(N=232)为12%。两项研究中接受罗氟司特乳膏治疗的患者,约有40%在第4周时达到清除或几乎清除的vIGA-AD评分,最早在第1周就出现显著改善。
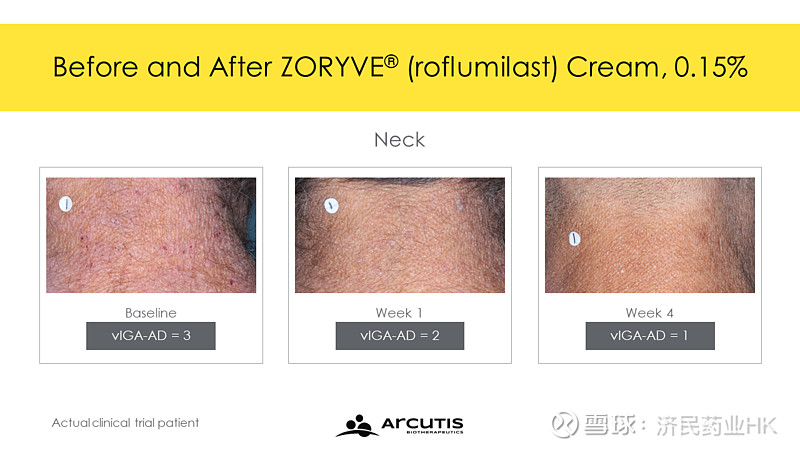
通过每日最严重瘙痒数字评定量表(WI-NRS)评分相对于起始的变化来衡量,并与赋形剂进行比较,在首次使用ZORYVE乳膏治疗的患者中,瘙痒得到了快速显著改善。此外,在每项研究中,超过30%的接受ZORYVE乳膏治疗的患者在第4周实现了WI-NRS成功(INTEGUMENT-1:33.6%对比20.7%;INTEGUMENT-2:30.2%对比12.4%),早在第1周就已看到显著改善。
WI-NRS成功定义为在WI-NRS0-10量表上至少减少4分(12岁及以上且起始WI-NRS评分至少为4分的患者)。
与使用赋形剂相比,使用罗氟司特乳膏治疗的患者在第4周时湿疹面积和严重程度指数(EASI75)改善了75%的患者超过40%:在INTEGUMENT-1中,罗氟司特组为43.2%,赋形剂组为22.0%;而在另一项研究中,罗氟司特组为42%,赋形剂组为19.7%。两项研究中,与使用赋形剂相比,使用罗氟司特乳膏治疗的患者在第1周就实现了EASI-75的显著改善。
无论是在罗氟司特乳膏组还是赋形剂组中,治疗中出现的不良事件(TEAE)发生率都很低,大多数TEAE的严重程度被评估为轻度至中度。在综合3期关键试验中,两组中均未出现发生率超过2.9%的受试者的不良反应。最常见的不良反应包括头痛、恶心、应用部位疼痛、腹泻和呕吐。
INTEGUMENT-OLE开放标签研究招募了658名从INTEGUMENT-1或-2转入的受试者。4周后的任何时间,通过每日一次使用达到vIGA-AD评分“清除”的INTEGUMENT-OLE受试者改为每周两次使用(130名受试者;占研究人群的19.8%)。所有其他受试者继续每日一次使用。在参与INTEGUMENT研究28周和56周后,分别有61.3%和65.7%的受试者达到EASI-75。
参考来源:‘FDA Approves Arcutis’ ZORYVE® (roflumilast) Cream 0.15% for the Treatment of Atopic Dermatitis in Adults and Children Down to 6 Years of Age’,新闻稿。Arcutis Biotherapeutics, Inc.;2024年7月9日发布。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指导,请咨询主治医师。