人乳头瘤病毒(HPV)是生殖系统疾病最常见的病原体。尽管大多数HPV感染可能会在几个月内在不经任何干预的情况下消失,但某些感染可能会持续存在并发展为宫颈癌。2020年,在所有类型的癌症中,中国确诊宫颈癌病例排名第八,达到11.85万例。同时,在中国,当诊断处于局部阶段及区域阶段时,宫颈癌的五年存活率可分别超过80%及40%,而当宫颈癌诊断处于远处转移阶段时,五年存活率仅为12.9%。2020年中国宫颈癌死亡人数为5.91万人。
宫颈癌是发病率仅次于乳腺癌的女性恶性肿瘤,接种HPV疫苗可大大降低患宫颈癌的风险,并且即使感染了HPV甚至出现宫颈癌前病变的情况,只要及早发现并得到适当治疗,是可以治愈的。
(一)行业的市场空间和成长性
自2015年至2020年,Merck的HPV产品全球销售收益已由19亿美元增加至39亿美元,复合年增长率为15.6%。HPV疫苗的市场规模在2020年为人民币135亿元,预计到2030年将达到人民币690亿元,2020年到2030年的复合年增长率为17.7%,预期HPV九价疫苗市场将于2030年的HPV疫苗市场中拥有最大的市场份额。
1、HPV疫苗接种率覆盖率很低,目前仍处于供不应求的状态。
世卫组织2020年发布了《加速消除宫颈癌全球战略》,建议到2030年,90%的女孩在15岁之前完成HPV疫苗接种。截至目前,HPV疫苗在各国的覆盖率远低于90%,2020年,全球2针接种率仅13%。中国9-45岁女性总人群约3.2亿人,9-19岁女性人群7500余万人,HPV疫苗接种需求基数大。假设所有已发放的HPV疫苗批次均已全部使用且所有接种HPV疫苗的女性均已完成接种计划, 2018-2020年中国9-45岁适龄女性累计接种2159.74万剂次HPV疫苗,累计估算接种率为2.6%。
2、中国疫苗企业存在出海发展的可能。
2021年10月,馨可宁正式通过世卫组织的预认证(PQ认证),产品已在摩洛哥获批(2022年5月),此外还在泰国、尼泊尔、哈萨克斯坦、印尼、马来西亚、柬埔寨、肯尼亚等国进行了二价HPV疫苗的注册申报。
3、HPV疫苗接种亦有可能扩展到男性群体。
所有能感染女性的HPV血清型亦能感染男性,并在男性中引起严重疾病,包括阴茎癌、肛门癌、头颈癌等。根据《中国人乳头瘤病毒及相关疾病报告》,在所有阴茎癌中,HPV DNA的可检测率约为51%。此外,《2020年全球癌症统计数据》显示,肛门癌和头颈癌的43%及75%患者是男性,这两种癌症都与HPV感染有关。有专家表示,在未来针对男性的疫苗获得批准后,希望男性青少年人群能够接种疫苗,从而从根本上减少感染,防止随后发生可能导致癌症的病变。中国已经有针对男性的HPV候选疫苗正在进行临床试验。例如,MSD的九价人乳头瘤病毒疫苗在中国20至45岁男性中进行III期临床试验,北京康乐卫士生物技术股份有限公司的九价重组人乳头瘤病毒疫苗在9至45岁男性中进行I期临床试验,及中国国药集团的四价重组人乳头瘤病毒疫苗在9至17岁男性中进行I期临床试验。
(二)竞争格局
目前获批上市的HPV疫苗共有五款。进口的疫苗有葛兰素史克的二价HPV疫苗、默沙东(智飞生物代理)的四价HPV和九价HPV疫苗。国产HPV疫苗包括万泰生物的二价HPV疫苗和沃森生物二价HPV疫苗。高危HPV感染主要由16型、18型、31型、33型、45型、52型及58型HPV引起,导致了全球约90%的宫颈癌病例,其中HPV 16型及18型造成了全球约70%的宫颈癌病例。此外,全球约90%的肛门及生殖器疣病例由HPV 6型及11型引起。因此,HPV二价疫苗(16型及18型)可预防约70%的宫颈癌,而获批准的HPV四价疫苗(6型、11型、16型及18型)可预防约70%的宫颈癌及约90%的肛门及生殖器疣。HPV九价疫苗进一步扩大其保护范围至约90%的宫颈癌及90%的肛门及生殖器疣。
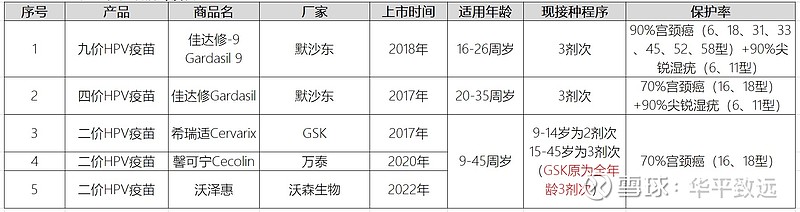
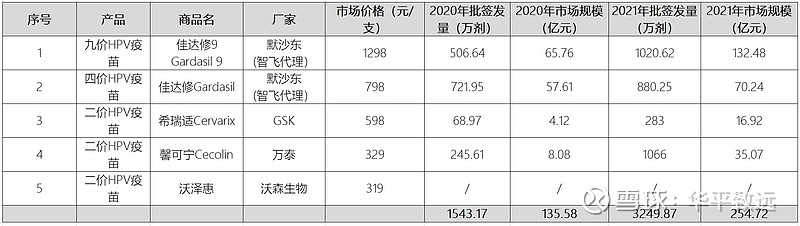
2021年HPV疫苗总批签发量约为3250万支,同比增长110%;其中GSK的2价HPV疫苗约为283万支(+310%)、万泰生物的2价HPV疫苗约为1066万支(+334%)、默沙东的4价和9价HPV疫苗分别约为880万支(+22%)、1020 万支(+101%)。按照二价、四价、九价疫苗的中标价格测算,2021年国内HPV疫苗市场规模约为255亿元,同比增长88%。
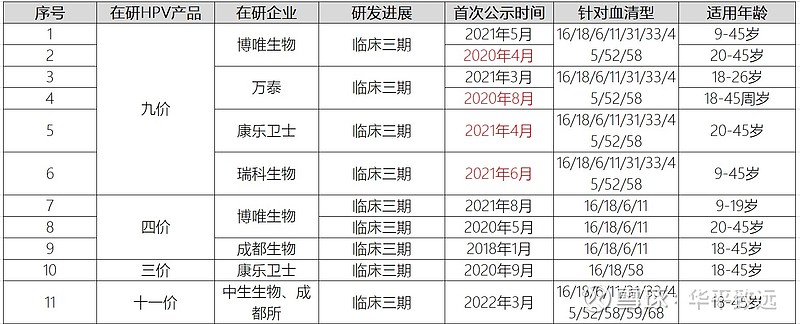
HPV疫苗技术要求高,且临床试验过程复杂漫长,从而导致研发时间相对较长。临床上检测出HPV感染往往需要多年时间,且可能需要更长时间来检测潜在的宫颈病变。HPV从感染到出现癌前病变,平均要5年,最长10年,这也意味着疫苗上市前临床试验至少需要5年;如果以HPV持续病毒感染率作为临床终点指标,一般可以节约两年的时间。从现有已上市的HPV疫苗的监管历史来看,HPV疫苗从I期临床试验到产品最终上市,通常需要近10年的时间。从目前各家进度来看,国产九价疫苗大部分都要2026-2027年(2025年开始陆续提交BLA)才能出来。据瑞科生物招股书披露,其重组九价HPV疫苗(即REC603)正进行III期临床试验,首位受试者已于2021年6月26日招募入组,并于2021年10月为效力测试完成12,500名受试者招募,计将于2022年上半年完成三针给药,计划于2025年达到III期临床试验的主要终点,并向国家药监局提交BLA申请。
(三)风险因素
1、HPV接种剂次被监管部门批准减少的风险。基于推动提高接种覆盖率的目的,WHO免疫战略专家组(SAGE)会议提出减少接种剂次的建议。即9至14岁的女性被推荐接种1或2剂次HPV疫苗;15到20岁女性也应接种1或2剂次疫苗;21岁以上的女性应在间隔6个月的时间里接种2剂次HPV疫苗。5月30日,GSK宣布其二价HPV疫苗“希瑞适”适用于9-14岁女孩的两剂次接种已经获得NMPA批准,在此之前,GSK的二价疫苗接种程序主要是3剂次。预计疫苗厂商会主动作为,和各国政府监管机构、公共卫生机构积极沟通,并开展临床试验,在经济较为发达国家低年龄组接种2剂次、中高年龄组仍然接种3剂次,而非洲等经济相对落后的国家实施WHO的建议。
2、HPV疫苗尤其HPV二价疫苗划归为一类苗并集采降价的风险。截至2020年末,110个国家已将HPV疫苗纳入其常规国家免疫计划。然而,中国政府尚未将HPV疫苗列入国家免疫计划。如果我国要实现2030消除宫颈癌规划的目标,由政府财政来买单来提高HPV疫苗渗透率是是必然的选项,但目前各地财政状况不足以承担所有存量人员的接种需求,短期来看是由中央倡导经济条件好的地区率先实施,但较长期来看HPV疫苗尤其是二价苗大概率会列入一类苗。2021年,多地已启动HPV疫苗免费或补贴接种,例如广东省、四川成都、江苏南京、内蒙古鄂尔多斯、山东济南、福建厦门、河北省石家庄和唐山等多省市相继启动HPV疫苗免费或补贴接种计划。