▎追溯
2023年2月7日,Dragonfly Therapeutics宣布百时美施贵宝退回IL-12项目权益,后者在花费6.5亿美元后,并未看到预想的临床效果,进而放弃。

但Dragonfly 相关负责人表示,BMS不应将取消交易的决定归咎于 IL-12 的临床表现,项目经费可能是关键因素。
对于BMS退回IL-12这个项目,Dragonfly的态度是积极的,并且Dragonfly的研发总裁Joseph Eid博士表示,很高兴IL12回归到Dragonfly旗下,同时鉴于临床前模型和临床上的表现,会加速DF6002在一系列适应症的开发,联用并举。Joseph Eid曾领导KEYTRUDA的临床开发。
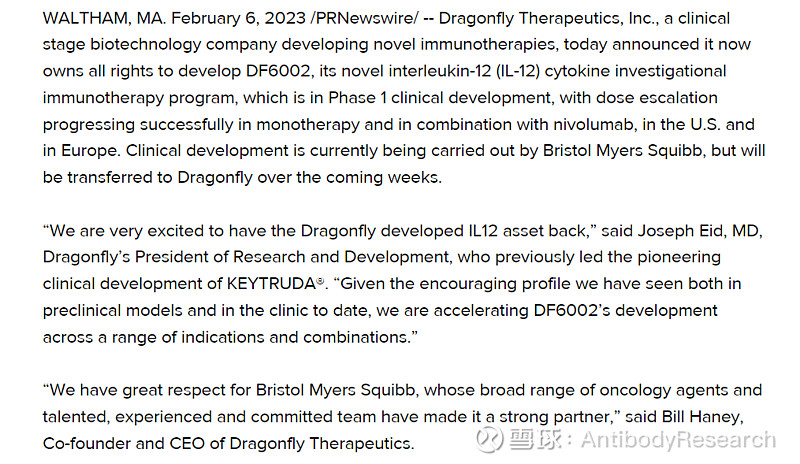
DF6002为长效设计,加了一个Fc,除此之外,根据其表述,可能并没有再做其他工作,如果是这种设计,未来成功的可能性极低。而Werewolf做的是相关的procytokine。
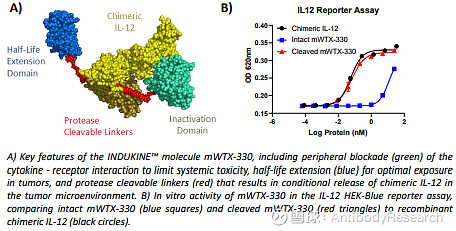
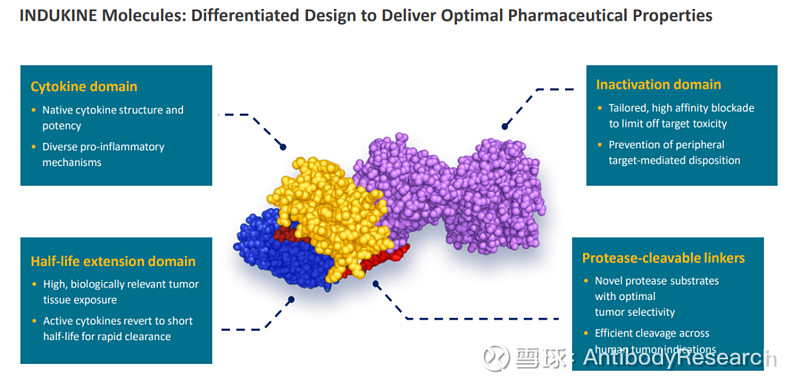
在临床前的动物模型中,IL-12的前药有不错的效果。但我个人觉得,到了临床可能效果也一般,不具备肿瘤靶向性,依赖于linker对于肿瘤微环境的敏感性,起到的作用微弱。
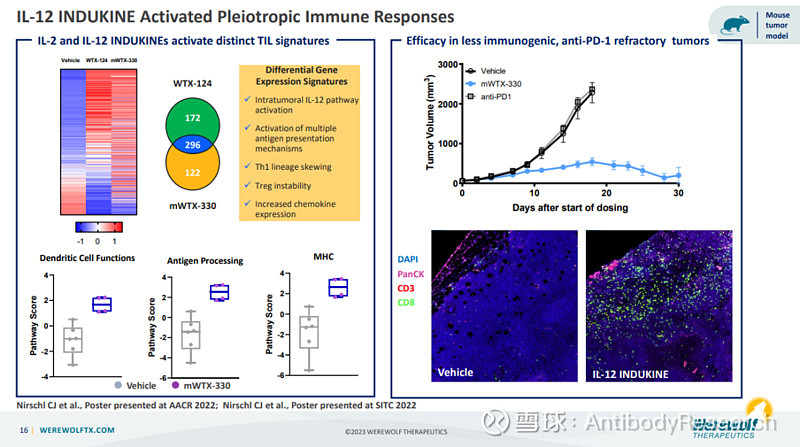
Pro-cytokine,一般是用抗体去做遮蔽物。我个人觉得,Pro最多的一个作用可能就是减活,提高给药窗口,而未必真能在肿瘤部分得到可控且准确的释放,一个是酶是否足量,二linker在裂解后,遮蔽物能够掉下来。Cytomx做过相应的实验,当遮蔽肽亲和力过强时,效果几乎为零,所以只能选择弱亲和力的遮蔽物。例如以下的实验,几乎是无法断定是否是因为Linker被裂解而产生的效果,还是本身亲和力较弱,保留抗体部分作用,而起到的效果。
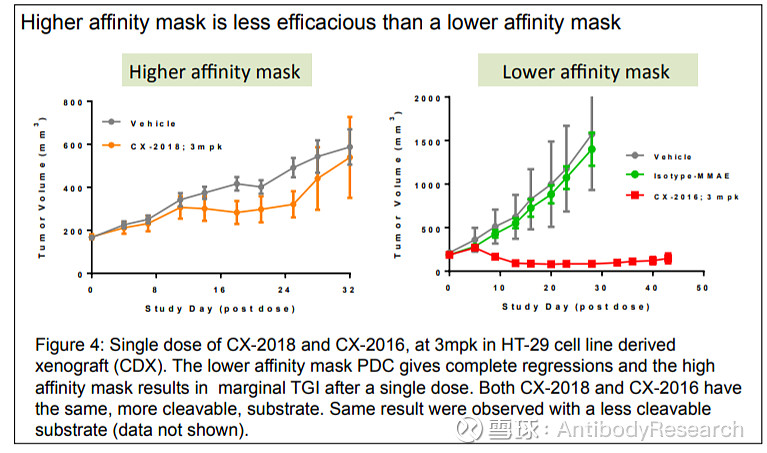
所以,我们再来看Pro-cytokine,可以借鉴ADC的思路。通过看IL-12(或IL-2)的临床给药剂量,是非常低的,意味着毒性很大。而当下的ADC开发毒素选择一般选择为中弱毒性,所以,定向进化降低细胞因子活性或者开发pro-cytokine就是可以去考虑的方向。而这种设计是不具备肿瘤靶向性的,所以,还在再选择高表达的TAA靶点抗体,两者结合,TAA抗体带着减活细胞因子或者pro-cytokine到肿瘤部位,将冷肿瘤变为热肿瘤,来发挥作用。

但这样的单药药效可能也不会太好,还是要联合化药,或者杀伤性ADC,甚至在此基础上联合PD1抑制剂。
未来一定是联合用药的天下。可以做的方向也有很多。Pro-cytokine,还有尝试的余地,主要的作用更能在于减活,增大给药窗口,但是可能还是要加上肿瘤靶向性,选择高表达的TAA,一味的依靠linker对于肿瘤微环境的敏感性,很难如意。
_______________________________
本文作者:追溯(zhuisu2210),生物医药行业从业者。后台咨询,可接受一定量专业性资源对接合作,如项目融资,推广等.