
$恒瑞医药(SH600276)$ $药明康德(SH603259)$ $泰格医药(SZ300347)$
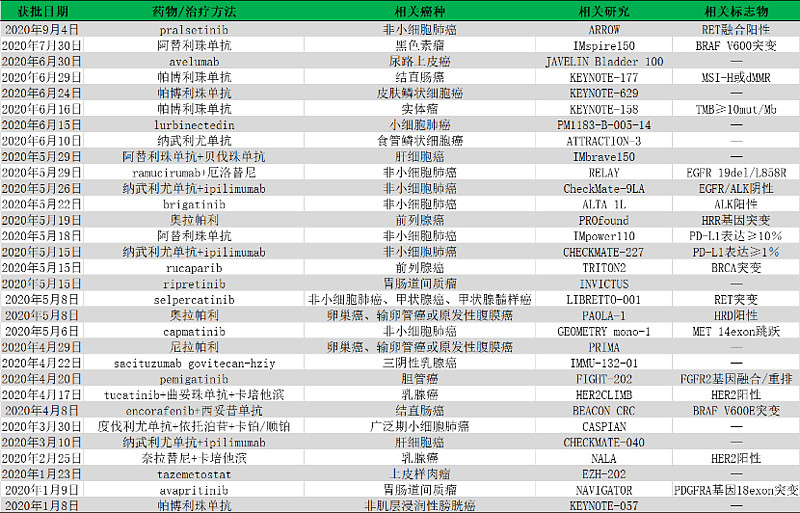
最近FDA(美国食品药品监督管理局)批准新药pralsetinib用于RET融合非小细胞肺癌,2020年截至目前FDA已批准实体瘤靶向治疗/免疫治疗药物及相关适应症共31个,涉及非小细胞肺癌、小细胞肺癌、尿路上皮癌、前列腺癌、卵巢癌、肝癌和乳腺癌等多个癌种,小编整理了所有药物适应症以及疗效数据,分享如下:
九月
01、pralsetinib--非小细胞肺癌(RET融合阳性)
2020年9月4日,基石药业合作伙伴Blueprint Medicines宣布,FDA已批准RET抑制剂pralsetinib(GAVRETO)用于治疗经FDA批准的检测方法证实为RET融合阳性的转移性非小细胞肺癌(NSCLC)成人患者。9月7日,基石药业发布公告,中国国家药品监督管理局(NMPA)也已受理普拉替尼(Pralsetinib)作为国家1.1类新药的上市申请并纳入优先审评!
获批基于I/II期ARROW研究,RET融合阳性NSCLC患者接受pralsetinib,每日一次400mg治疗。在87例曾接受过含铂化疗的患者中,客观缓解率(ORR)为57%(95%CI:46,68),完全缓解率(CR)为5.7%,中位缓解持续时间(DOR)未达到(95%CI:15.2个月,不可估计)。在27例未接受过含铂化疗的初治患者中,ORR为70%(95%CI:50,86),CR为11%、中位DOR为9.0个月(95%CI:6.3个月,不可估计)。
七月
01、阿替利珠单抗--黑色素瘤( BRAF V600)
2020年7月30日,FDA批准阿替利珠单抗(atezolizumab,TECENTRIQ)与cobimetinib(COTELLIC)和维莫非尼 (vemurafenib,ZELBORAF) 联合用于BRAF V600突变阳性,无法切除或转移的黑色素瘤患者。
获批基于IMspire150研究(NCT02908672),纳入514名患者,评估了atezolizumab或安慰剂与cobimetinib和vemurafenib联合使用的疗效。分为两组:① PDL1单抗+双靶组:在第1-21天接受维莫非尼(960mg,2次/天)+Cobimetinib(60mg/天)治疗,第22-28天接受维莫非尼+安慰剂,之后在此基础上再加上阿替利珠单抗840mg(2周1次),治疗直至疾病进展或不耐受。②双靶组:在第1-21天接受维莫非尼(960mg,2次/天)+Cobimetinib(60mg/天)治疗,第22-28天接受维莫非尼,之后再加上安慰剂(2周1次),治疗直至疾病进展或不耐受。主要终点为研究者评估的无进展生存期 (PFS)。Atezolizumab组的中位PFS为15.1个月(95%CI:11.4,18.4),安慰剂组为10.6个月(95%CI:9.3,12.7)。
六月
01、avelumab--尿路上皮癌
2020年6月30日,FDA批准avelumab(BAVENCIO)用于维持治疗局部晚期或转移性尿路上皮癌 (UC) 患者,这些患者的一线含铂化疗没有进展。
获批基于JAVELIN Bladder 100研究(NCT02603432),分析了avelumab对UC维持治疗的疗效,该试验是一项随机,多中心,开放标签的试验,纳入700例无法切除、局部晚期或转移性尿路上皮癌的患者,这些患者均接受了4-6个周期的一线含铂化疗。患者随机接受avelumab+BSC或BSC方案。主要终点是所有患者和PD-L1阳性肿瘤患者的总生存期(OS)。所有患者的中位OS在avelumab+BSC组为21.4个月,在BSC组为14.3个月(HR:0.69;95%CI:0.56,0.86;p = 0.001)。在PD-L1阳性肿瘤患者中(51%),OS HR为0.56(95%CI:0.40,0.79; p <0.001)。在对PD-L1-阴性肿瘤患者(39%)进行的探索性分析中,OS风险比为0.85(95%CI:0.62,1.18)。
02、帕博利珠单抗--结直肠癌(MSI-H或dMMR)
2020年6月29日,FDA批准帕博利珠单抗(pembrolizumab,KEYTRUDA)用于不可切除或转移性微卫星不稳定性高 (MSI-H) 或错配修复缺陷(dMMR)结直肠癌患者的一线治疗。
批准基于KEYNOTE-177研究(NCT02563002),纳入了307名先前未经治疗的不可切除或转移性MSI-H或dMMR结直肠癌患者。使用PCR或IHC分别确定MSI和MMR肿瘤状态。患者被随机分配接受帕博利珠单抗或mFOLFOX6 / FOLFIRI±贝伐珠单抗或西妥昔单抗。疾病进展时,随机接受化疗的患者接受了pembrolizumab治疗。主要终点为无进展生存期(PFS)和总体生存期(OS)。帕博利珠单抗组中位PFS为16.5个月(95%置信区间[CI]:5.4,32.4),化疗组中位PFS为8.2个月(95%CI:6.1,10.2)。在进行PFS分析时,OS数据尚未成熟。
03、帕博利珠单抗--皮肤鳞状细胞癌
2020年6月24日,FDA批准帕博利珠单抗(pembrolizumab,KEYTRUDA)用于不能通过手术或放疗治愈的复发或转移性皮肤鳞状细胞癌 (cSCC) 患者。
获批基于KEYNOTE-629研究(NCT03284424),该试验排除了先前接受过抗PD-1,抗PD-L1或抗CTLA-4抗体治疗的患者,以及患有自身免疫性疾病或需要免疫抑制的患者。主要终点是根据RECIST 1.1评估的客观反应率(ORR)和反应持续时间,ORR为34%(95%CI:24,44),未达到中位缓解持续时间(范围:2.7,13.1+个月)。
04、帕博利珠单抗--实体瘤(TMB-H)
2020年6月16日,FDA批准帕博利珠单抗(pembrolizumab,KEYTRUDA)单药治疗TMB-H(TMB≥10mut / Mb)且既往治疗后疾病进展的无法切除或转移性实体瘤患者,无需考虑癌症类型。
获批基于KEYNOTE-158研究(NCT02628067),102例(13%)TMB-H(TMB≥10mut / Mb)患者,ORR为29%(95%CI:21,39),完全缓解率为4%,部分缓解率为25%。未达到中位DoR,缓解持续时间≥12个月的患者占57%,持续时间≥24个月的患者占50%。
05、lurbinectedin--小细胞肺癌
2020年6月15日,FDA加速批准lurbinectedin(ZEPZELCA)用于铂基化疗期间或之后疾病进展的成年转移性小细胞肺癌(SCLC)患者。
获批基于PM1183-B-005-14研究(Study B-005;NCT02454972),纳入了105例转移性小细胞肺癌的患者,这些患者在铂类化疗或后疾病进展。主要终点为经研究者采用RECIST 1.1评估确定的客观缓解率(ORR)和缓解时间。在105例患者中,ORR为35%(95%CI:26%,45%),中位缓解持续时间为5.3个月(95%CI:4.1,6.4)。根据独立审查委员会的报告,ORR为30%(95% CI: 22%, 40%),中位缓解持续时间为5.1个月(95% CI: 4.9, 6.4)。
06、纳武利尤单抗--食管鳞状细胞癌
2020年6月10日,FDA批准了纳武利尤单抗(nivolumab,OPDIVO)用于先前接受基于氟嘧啶和铂类化疗治疗的无法切除的晚期,复发或转移性食管鳞状细胞癌(ESCC)患者。
获批基于ATTRACTION-3研究(NCT02569242),对419例无法切除的晚期,复发或转移性ESCC患者进行了研究。该试验表明OS显着改善。接受nivolumab治疗的患者的OS中位数为10.9个月(95%CI:9.2,13.3),而接受紫杉烷化疗的患者的OS中位数为8.4个月(95%CI:7.2,9.9)(HR:0.77; 95%CI:0.62, 0.96;p = 0.0189)。无论肿瘤PD-L1表达水平如何,均观察到OS获益。nivolumab组的ORR为19.3%(95%CI:13.7,26),而紫杉烷化疗组为21.5%(95%CI:15.4,28.8),中位反应时间分别为6.9个月(95%CI:5.4, 11.1)和3.9个月(95%CI:2.8,4.2)。该试验未证明PFS有改善(HR:1.1;95%CI:0.9,1.3)。
五月
01、ramucirumab--非小细胞肺癌(EGFR 19del或L858R)
2020年5月29日,FDA批准雷莫芦单抗 (ramucirumab,CYRAMZA) 联合厄洛替尼一线治疗EGFR 19外显子缺失或21外显子 (L858R)突变的转移性非小细胞肺癌 (NSCLC) 。
获批基于RELAY研究(NCT02411448)449例患者被随机分配接受ramucirumab或安慰剂,与厄洛替尼联用。雷莫芦单抗联合厄洛替尼组与安慰剂联合厄洛替尼组相比,中位PFS为19.4个月和12.4个月,ORR为76%和75%,中位DoR分别为18.0个月和11.1个月。
02、阿替利珠单抗+贝伐珠单抗--肝细胞癌
2020年5月29日,FDA批准atezolizumab与贝伐珠单抗 (TECENTRIQ和AVASTIN) 联合用于无法切除或转移性肝细胞癌的患者,这些患者之前没有接受过全身治疗。
获批基于IMbrave150研究(NCT03434379),接受atezolizumab加贝伐珠单抗与接受索拉非尼的患者相比,中位OS分别为未达到和13.2个月,中位PFS分别为6.8个月和4.3个月。根据RECIST 1.1评估,ORR分别为 28%和12%;根据mRECIST评估,ORR分别为 33%和13%。
03、纳武利尤单抗+ipilimumab--非小细胞肺癌(EGFR或ALK阴性)
2020年5月26日,FDA批准纳武利尤单抗(nivolumab,OPDIVO)联合伊匹木单抗(ipilimumab,YERVOY)联合2周期含铂双药化疗用于一线治疗转移性或复发性非小细胞肺癌(NSCLC)且无EGFR或ALK基因变异的患者。
获批基于3期CheckMate-9LA临床试验的结果,在该试验中,nivolumab联合小剂量的ipilimumab伴随2周期化疗,与单独化疗最多4周期后联合可选择的维持治疗相比,有更长的总生存期(OS)。中期分析中,Nivolumab联合Ipilimumab组的中位OS为14.1个月,含铂双药化疗组为10.7个月,中位PFS分别为6.8个月和5个月,ORR为38%vs.25%,中位DOR分别为10个月vs.5.1个月。
04、brigatinib--非小细胞肺癌(ALK阳性)
2020年5月22日,FDA批准brigatinib(ALUNBRIG)治疗ALK基因突变阳性的转移性非小细胞肺癌一线治疗。
III期ALTA 1L研究评估了brigatinib(n=137)与克唑替尼(n=138)治疗既往未接受过ALK抑制剂的局部晚期或转移性成人NSCLC患者的安全性和疗效差异。对于所有意向治疗人群,brigatinib相比克唑替尼显著延长了中位PFS(24 vs 11个月),使疾病进展风险降低了51%,延长了ORR(74% vs 62% ) ;对于脑转移的患者,brigatinib相比克唑替尼可使颅内进展或死亡风险降低69%,延长了ORR(78% vs 26%)。
05、奥拉帕利--前列腺癌(HRR阳性)
2020年5月19日,FDA批准奥拉帕利 (olaparib,LYNPARZA) 用于先前接受恩扎卢胺或阿比特龙治疗后出现进展的携带有害或疑似有害胚系或体系同源重组修复 (HRR,Homologous Recombination Repair)基因突变的转移性去势抵抗性前列腺癌(mCRPC)成年患者。
获批基于PROfound研究(NCT02987543),256例患者接受olaparib治疗,131例患者进行研究者选择的恩扎卢胺或阿比特龙的治疗。所有患者均接受了GnRH类似物或先前进行过双侧睾丸切除术。根据患者的HRR基因突变状态将其分为两个队列。BRCA1,BRCA2或ATM突变的患者被随机分组到队列A中(N = 245);在HRR通路中涉及其他12个基因突变的患者被分组到队列B中(N = 142);具有共突变的纳入队列A。奥拉帕利组与恩扎卢胺或阿比特龙组相比,队列A中,rPFS有统计学意义上的显着改善(中位数为7.4个月 vs 3.6个月),中位OS为19.1个月和14.7个月,ORR分别为33%和2%。队列A + B中的rPFS也显示出统计学显着改善(中位数为5.8个月 vs 3.5个月)。
06、阿替利珠单抗--非小细胞肺癌(PD-L1表达≥10%)
2020年5月18日,FDA批准atezolizumab(TECENTRIQ)单药用于一线治疗经FDA批准的检测确定其肿瘤PD-L1高表达且无EGFR或ALK基因突变的转移性非小细胞肺癌(NSCLC)成人患者。PD-L1高表达定义为肿瘤细胞PD-L1表达≥50%(TC≥50%)或肿瘤浸润免疫细胞PD-L1表达≥10%(IC≥10%)。
获批基于IMpower110研究(NCT02409342),试验结果表明,与接受铂类化学疗法治疗的患者相比,接受阿替利珠单抗治疗的PD-L1高表达患者的OS具有显着改善(中位OS为20.2个月 vs 13.1个月),阿替利珠单抗组中位PFS为8.1个月,铂类化疗组为5.0个月,ORR分别分别为38%和29%。
07、ripretinib--胃肠道间质瘤
2020年5月15日,FDA批准ripretinib(QINLOCK)用于晚期胃肠道间质瘤(GIST)成年患者,这些患者先前接受过3种及以上激酶抑制剂(包括伊马替尼)的治疗。
获批基于INVICTUS研究(NCT03353753)。该试验表明,与安慰剂组相比,ripretinib组患者的PFS有统计学显着性改善(HR 0.15;95%CI:0.09,0.25;p <0.0001)。ripretinib组的中位PFS为6.3个月(95%CI:4.6,6.9),而安慰剂为1.0个月(95%CI:0.9,1.7)。ripretinib组的ORR为9%(95%CI:4.2,18),而安慰剂组为0%(95%CI:0,8)。ripretinib组的中位OS为15.1个月(95%CI:12.3,15.1),而安慰剂组为6.6个月(95%CI:4.1,11.6),HR为0.36(95%CI:0.21,0.62)。
08、rucaparib--前列腺癌(BRCA突变)
2020年5月15日,FDA加速批准rucaparib(RUBRACA),用于已接受雄激素受体和基于紫杉醇的化疗治疗的具有BRCA有害突变(生殖细胞和/或体细胞)的转移性去势抵抗性前列腺癌(mCRPC)的患者。
获批基于TRITON2研究(NCT02952534),一项多中心,单臂的临床试验,入组115例经雄激素受体和基于紫杉烷类化疗治疗的BRCA突变(生殖细胞和/或体细胞)的mCRPC患者。患者每天两次口服600mg rucaparib并伴GnRH类似物,或曾接受双侧睾丸切除术。评估了62例可测量病灶患者的客观缓解率(ORR)和缓解持续时间(DOR)。ORR为44%(95%CI:31,57)。中位DOR无法评估(NE;95%CI:6.4,NE)。在确认为客观缓解的27例患者中,有15例(56%)的DOR≥6个月。
09、纳武利尤单抗+ipilimumab--非小细胞肺癌(PD-L1表达≥1%)
2020年5月15日,FDA批准纳武利尤单抗(nivolumab,OPDIVO)联合伊匹木单抗(ipilimumab,YERVOY)用于EGFR和ALK阴性、PD-L1表达(≥1%)得转移性非小细胞肺癌患者的一线治疗。
获批基于CHECKMATE-227研究(NCT02477826)。在该试验的第1a部分,793名PD-L1表达≥1%的患者随机接受nivolumab联合ipilimumab(n = 396)或铂类双药化疗(n = 397)。结果表明,nivolumab联合ipilimumab组与铂类双药化疗组相比,OS有统计学意义的改善(中位OS为17.1个月 vs 14.9个月),中位PFS分别为5.1个月和5.6个月,ORR分别为36%和30%。联合组的中位反应持续时间为23.2个月,化疗组为6.2个月。
10、奥拉帕利--卵巢癌(HRD阳性)
2020年5月8日,阿斯利康(AstraZeneca)和默沙东(MSD)联合宣布,FDA批准奥拉帕利(olaparib,LYNPARZA)与贝伐珠单抗联合用于HRD阳性的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者的一线维持治疗,这些患者对一线铂类化疗具有完全或部分响应。
获批基于PAOLA-1研究,对387例HRD阳性患者的亚组分析显示,奥拉帕利联合贝伐珠单抗可将疾病进展或死亡风险降低67%。在HRD阳性的晚期卵巢癌患者中,奥拉帕利+贝伐珠单抗与单独使用贝伐珠单抗相比,显著提高了患者的无进展生存期(中位PFS为37.2 vs 17.7个月)。
11、selpercatinib--非小细胞肺癌、甲状腺癌、甲状腺髓样癌(RET突变)
2020年5月8日,selpercatinib(RETEVMO,LOXO292)获得FDA批准用于RET变异的“泛癌种”,包括RET融合非小细胞肺癌、RET融合甲状腺癌,RET突变甲状腺髓样癌。Selpercatinib是FDA批准的第一个专门针对RET基因突变的靶向疗法。
获批基于LIBRETTO-001研究( NCT03157128),评估了RET融合阳性患者使用selpercatinib的疗效。主要重点为客观缓解率(ORR)和反应持续时间(DOR)。105例曾接受过铂类化疗的RET融合阳性非小细胞肺癌转移患者ORR为64%,中位DOR为17.5;39例初治RET融合阳性NSCLC患者ORR为85%。55例RET突变的、先前曾接受过卡博替尼或凡德他尼治疗晚期MTC患者ORR为69%,其中DOR超过6个月的患者比例为76%;88例RET突变的MTC初治患者ORR为73%,中位DOR为22个月;19例放射性碘难治且接受过其他系统治疗的RET融合阳性甲状腺癌患者中,ORR为79%,其中DOR超过6个月的患者比例为87%;8例仅接受过放射性碘治疗的RET融合阳性甲状腺癌患者的ORR为100%,其中DOR超过6个月的患者比例为75%。
12、capmatinib--非小细胞肺癌(MET 14外显子跳跃)
2020年5月6日,FDA 加速批准了capmatinib(TABRECTA),用于携带MET14外显子跳跃的转移性非小细胞肺癌(NSCLC)患者。
获批基于GEOMETRY mono-1试验(NCT02414139),该试验是一项多中心,非随机,开放标签,多队列研究,纳入97例携带MET14外显子跳跃的转移性NSCLC患者,患者每天两次口服capmatinib,直至疾病进展或出现不可接受的毒性。在28名未接受过治疗的患者中,ORR为68%,持续缓解时间为12.6个月。在之前接受治疗的69位患者中,ORR为41%,持续缓解时间为9.7个月。
四月
01、尼拉帕利--卵巢癌
2020年4月29日,FDA批准尼拉帕利(niraparib,ZEJULA)用于维持治疗对一线铂类化学疗法有完全或部分反应的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成年患者。
获批基于PRIMA研究(NCT02655016),共纳入733名晚期卵巢癌、原发性腹膜癌或输卵管癌,且在一线含铂化疗后达到完全缓解或部分缓解的患者,随机接受尼拉帕利或安慰剂治疗,主要终点为无进展生存期(PFS)。结果显示,与安慰剂相比,接受尼拉帕利治疗的患者,在同源重组缺陷亚组和总人群中PFS有统计学意义的改善。在同源重组缺陷人群中的中位PFS为21.9 vs 10.4个月,总人群的中位PFS为13.8 vs 8.2个月。
02、sacituzumab govitecan-hziy--三阴性乳腺癌
2020年4月22日,FDA加速批准抗体偶联药物(ADC)sacituzumab govitecan-hziy(TRODELVY)用于治疗转移性三阴性乳腺癌(TNBC)成年患者,这些患者先前已接受至少两种针对转移性疾病的疗法。Trodelvy是FDA批准的第一个针对复发或难治的转移性TNBC的ADC,同时也是FDA批准的第一个抗Trop-2的ADC药物。
获批基于IMMU-132-01研究(NCT 01631552),共纳入了108名先前至少接受过两次治疗的转移性三阴性乳腺癌患者(mTNBC), 接受sacituzumab govitecan-hziy治疗,主要终点为客观缓解率(ORR)。结果显示ORR为33.3%,缓解持续时间为7.7个月。
03、pemigatinib--胆管癌(FGFR2基因融合/重排)
2020年4月20日,FDA加速批准pemigatinib (PEMAZYRE)用于既往接受过治疗、采用FDA批准方法检测的具有FGFR2基因融合或其他重排且不可手术切除的局部晚期或转移性胆管癌成人患者。目前在约9%-14%的胆管癌患者中发现了FGFR2融合,Pemazyre是第一个也是唯一一个被FDA批准用于此适应症的治疗药物。
获批基于临床试验FIGHT-202(NCT02924376),队列A中107例(该实验共纳入146例患者,107例FGFR2融合或重排,20例有其他FGF/FGFR突变,18例没有FGF/FGFR突变,1名未确定FGF/FGFR突变情况)先前接受过治疗的局部晚期或转移性FGFR2融合或重排的胆管癌患者,其中最常见的为FGFR2-BICC1融合。主要终点总体缓解率(ORR)为36%,其中2.8%的患者完全缓解,33%的患者部分缓解。
04、tucatinib+曲妥珠单抗+卡培他滨--乳腺癌(HER2阳性)
2020年4月17日,FDA批准tucatinib(TUKYSA)联合曲妥珠单抗和卡培他滨用于治疗晚期不可切除或转移性HER阳性乳腺癌的成年患者(包括脑转移),这些患者先前接受过一种或多种抗HER2的治疗。FDA与澳大利亚治疗产品管理局(TGA)、加拿大卫生部、新加坡卫生科学局(HSA)和Swissmedic(瑞士,SMC)合作进行了此次审查。尽管FDA批准了Tukysa,但其他机构仍在审查该申请。
获批基于临床试验HER2CLIMB(NCT02614794),共纳入612例HER2阳性晚期不可切除或转移性乳腺癌患者,这些患者曾接受曲妥珠单抗、帕妥珠单抗和恩美曲妥珠单抗(T-DM1)治疗,主要终点为无进展生存期(PFS)。Tucatinib+曲妥珠单抗+卡培他滨组对比安慰剂+曲妥珠单抗+卡培他滨组,中位PFS为7.8个月 vs 5.6个月,中位OS为21.9 vs 17.4个月,基线脑转移患者的中位PFS为7.6个月 vs 5.4个月。
05、encorafenib+西妥昔单抗--结直肠癌(BRAF-V600E突变)
2020年4月8日,FDA批准encorafenib(BRAFTOVI)与西妥昔单抗联合,用于先前接受过治疗的、BRAF V600E突变的转移性结直肠癌的成年患者。这是FDA批准的第一个也是唯一一个针对先前治疗过的、BRAF V600E突变的mCRC靶向治疗方案。
获批基于BEACON CRC研究(NCT02928224),评估了encorafenib、binimetinib和西妥昔单抗在BRAF-V600E突变型mCRC患者中的疗效和安全性,共分为三组:三药联合组(encorafenib+binimetinib+西妥昔单抗),双药联合组(encorafenib+西妥昔单抗),对照组(基于伊立替康的化疗+西妥昔单抗)。2020 ASCO-GI最新结果显示,三药和双药联合治疗与对照组相比,均显著延长患者的总生存期(mOS:9.3 vs 9.3 vs 5.9个月),ORR也有明显提高(27% vs 20% vs 2%),并且三药和双药治疗效果相当。
三月
01、度伐利尤单抗--广泛期小细胞肺癌
2020年3月30日,FDA批准度伐利尤单抗(durvalumab ,IMFINZI)与依托泊苷+卡铂或顺铂联合,用于广泛期小细胞肺癌(ES-SCLC)成人患者的一线治疗。在此之前,已经获批用于小细胞肺癌的免疫检查点抑制剂还包括:阿替利珠单抗、纳武利尤单抗、帕博利珠单抗。
获批获批基于CASPIAN研究(NCT03043872),度伐利尤单抗+依托泊苷+卡铂或顺铂使死亡风险降低了27%,与标准化疗相比,总生存期延长(中位OS:13.0个月 vs 10.3个月),客观响应率也有所提高(68% vs 58%)。该数据发表在《柳叶刀》杂志。2019 ESMO ASIA中, Makoto Nishio教授口头报告了CASPIAN研究亚洲亚组分析数据,共纳入76例患者(其中日本34例、韩国28例、中国台湾12例、中国大陆2例),探索性OS分析显示:两组OS获益与总体人群一致(中位OS:14.8个月 vs 11.9个月),安全性可控。
02、纳武利尤单抗+伊匹木单抗--肝细胞癌
2020年3月10日,FDA批准纳武利尤单抗(nivolumab,OPDIVO)+伊匹木单抗(ipilimumab,YERVOY),联合用于治疗先前接受索拉非尼治疗的肝细胞癌患者。
获批基于CHECKMATE-040研究(NCT01658878)中队列4的数据,共纳入49例患者接受武利尤单抗+伊匹木单抗的联合疗法。结果显示,主要终点总体反应率(ORR)为33%,有4例完全缓解和12例部分缓解。响应持续时间从4.6到30.5+月,其中31%的响应持续至少24个月。
二月
01、奈拉替尼+卡培他滨--HER2阳性乳腺癌
2020年2月25日,FDA批准奈拉替尼(neratinib,NERLYNX)+卡培他滨用于治疗先前在远处转移背景下接受过≥2种以抗HER2为基础的方案治疗的晚期或转移性HER2阳性乳腺癌成年患者。
获批基于NALA研究(NCT01808573),共纳入621例转移性HER2阳性转移性乳腺癌患者,随机分配接受奈拉替尼+卡培他滨或拉帕替尼+卡培他滨治疗,主要终点为无进展生存期(PFS)、总体生存期(OS)。关键的次要终点是客观缓解率(ORR)和缓解持续时间。奈拉替尼+卡培他滨组对比拉帕替尼+卡培他滨组,中位PFS为5.6 vs 5.5个月,12个月PFS率为29 vs 15%,中位OS为21 vs 18.7个月,ORR为32.8% vs 26.7%,中位反应持续时间为8.5 vs 5.6个月。
一月
01、tazemetostat--上皮样肉瘤
2020年1月23日,FDA加速批准EZH2抑制剂tazemetostat(TAZVERIK)上市,用于治疗16岁及以上、不符合完全切除条件的转移性或局部晚期上皮样肉瘤儿科和成人患者。
获批基于EZH-202研究(NCT02601950)队列5的数据,对经组织学证实,转移性或局部晚期上皮样肉瘤的患者进行了疗效研究。患者INI1缺失,并且ECOG状态评分0-2,口服tazemetostat,直至疾病进展或出现不可接受的毒性。主要终点为总体缓解率(ORR)和缓解持续时间。结果显示,队列5中62位患者的ORR为15%,其中1.6%的患者完全缓解,13%的患者部分缓解,其中67%缓解的患者持续响应6个月或更长时间。
02、avapritinib--胃肠道间质瘤(PDGFRA基因18号外显子突变)
2020年1月9日,FDA批准新药avapritinib(AYVAKIT)上市,用于治疗携带PDGFRA基因18号外显子突变(包括PDGFRA D842V突变)的不可切除性或转移性胃肠道间质瘤(GIST)成人患者。Avapritinib是首个被批准用于具有PDGFRA外显子18突变的GIST患者的疗法。
获批基于NAVIGATOR研究(NCT02508532),共纳入43例携带PDGFRA基因18号外显子突变的GIST患者(包括38例PDGFRA D842V突变),患者接受Ayvakit治疗直至疾病进展或出现不可接受的毒性。主要终点为总缓解率(ORR)。对于具有PDGFRA基因18号外显子突变的患者,ORR为84%,完全缓解率为7%,部分缓解率为77%。在具有PDGFRA D842V突变的亚组中,ORR为89%,完全缓解率为8%,部分缓解率为82%。所有患者的中位随访时间为10.6个月,未达到中位反应持续时间。61%缓解患者持续了6个月或更长时间的响应。
03、帕博利珠单抗--非肌层浸润性膀胱癌
2020年1月8日,FDA批准帕博利珠单抗(pembrolizumab,KEYTRUDA)用于治疗对卡介苗(BCG)无反应、高风险、伴原位癌(CIS)、伴或不伴乳头状肿瘤的非肌层浸润性膀胱癌(NMIBC)患者。
获批基于KEYNOTE-057研究,该研究共纳入148例高危NMIBC患者,其中96例为对BCG无反应、伴CIS、伴或不伴乳头状肿瘤。患者接受帕博利珠单抗治疗,这96例患者的完全缓解率为41%,中位缓解时间为16.2个月,46%的缓解患者至少持续12个月的完全缓解。
主要参考来源:网页链接