提示:周三美国生物技术公司Merrimack Pharma($Merrimack制药(MACK)$ )的法国癌症治疗合作伙伴Ipsen S.A.宣布,其药物Onivyde作为一种组合疗法,在一种胰腺癌的后期试验中达到了主要终点,本次是作为一线治疗的三期临床。截至发稿,Merrimack Pharma盘前涨238.75%,报13.55美元。
彪悍吧!不妨看看Onivyde治疗胰腺癌的二线三期临床数据,本质是化疗,不怕不识货,就怕货比货。
Onivyde这项随机、开放标签的3期试验在770例未经治的转移性胰腺导管腺癌(mPDAC)患者中比较了Onivyde治疗方案(Nalirifox)与化疗白蛋白结合型紫杉醇联合吉西他滨的疗效。 一个月进行两次的实验治疗达到了主要终点,表明总体生存率有临床意义和统计上的显著改善,这是衡量癌症药物疗效的金标准。 该试验被称为NAPOLI 3,与化疗方案相比,Nalirifox方案也达到了一个关键的次要疗效结果,导致无进展生存期的显著改善。
伊立替康脂质体的发展历史:
CPT-11最早在1981年首先由日本学者合成。1994年盐酸伊立替康注射液在日本上市,1995年在美国上市,2001年在中国上市,目前为国家医保乙类药品。临床上广泛应用于转移性结直肠癌、小细胞肺癌的一/二线、胰腺癌的一/二线治疗。
Onivyde®目前由三家公司持有,分别是智擎生技(中国台湾地区)、Servier(欧亚区)及Ipsen(美洲区)。其中Onivyde®在美国的专利将于2025年到期。
伊立替康的作用机理与不足
伊立替康( Irinotecan,CPT-11)为半合成水溶性喜树碱衍生物,CPT-11为前体药,需要在肝脏内通过羧酸酯酶转化成具有活性的代谢物7-乙基-10-羟基喜树碱( SN-38) 。
当伊立替康注射液经静脉途径进入人体后,在生理条件(pH 7.4)下,由于血清蛋白优先与羧酸盐络合而使平衡偏向活性低的羧酸型,造成有效的内酯型比例过低,达到平衡时,“低效高毒”的羧酸盐形式化合物所占比重高达90%,抗肿瘤活性受到影响,且产生严重的毒副作用。
这里不妨看看Onivyde前面的临床数据:
2015年Merrimack公司的伊立替康脂质体注射剂Onivyde®(安能得®)在美国以孤儿药及优先审评身份获批上市,适应症为与氟尿嘧啶和亚叶酸合用用于治疗已经使用吉西他滨化疗不佳的晚期胰腺癌患者。
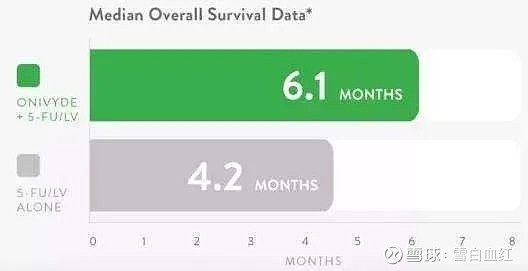
美国FDA的批准是基于一项14个国家/地区的76个设施进行的全球III期试验的结果。本次临床试验收录了417例已接受吉西他滨化疗治疗后的转移性胰腺癌患者,临床试验结果显示:
1. 对于已接受吉西他滨治疗后复发转移的晚期胰腺癌患者,接受伊立替康脂质体注射液联合氟尿嘧啶/亚叶酸钙治疗后的平均生存时间为6.1个月,仅接受氟尿嘧啶/亚叶酸钙治疗后的平均生存时间为4.2个月。
2. 与接受氟尿嘧啶/亚叶酸钙治疗的患者相比,仅接受伊立替康脂质体注射液治疗者的生存期(4.9个月)无改善。
3. 伊立替康脂质体注射液联合氟尿嘧啶/亚叶酸钙治疗者的肿瘤进展时间较氟尿嘧啶/亚叶酸钙治疗者延长,为3.1个月 vs 1.5个月。
此外,2020年2月公布的NAPOLI-1亚洲亚组研究结果显示,亚洲人群生存获益比整体人群更明显,中位OS延长5.2个月,中位PFS延长2.6个月。
因此基于NAPOLI-1整体人群及亚洲人群的积极数据,2020年CSCO指南将纳米脂质体伊立替康+5-FU/LV调整为Ⅰ级推荐,1A类证据,这也是目前二线治疗中推荐级别和证据等级最高、最明确的。

此外,其它肿瘤适应症的临床也正在开展中。2020年11月,FDA授予Ipsen的Onivyde®快速通道,用于小细胞肺癌(SCLC)患者在铂化疗方案后病情进展的二线单一治疗选择。国内包括恒瑞医药也公告了伊立替康脂质体治疗晚期食管癌的临床研究试验。
目前国内已上市的伊立替康脂质体为Servier按进口申报的易安达®,于2022年4月获批上市。
国内药企正在申报上市的有两家,分别是石药欧意按4类仿制申报上市和恒瑞医药按2.2类新药申报上市。网页链接
具体三期新数据后面值得关注,但毕竟是2015年的老药了。
正在胰腺癌三期临床的$康宁杰瑞制药-B(09966)$ 的kn046的临床数据值得好好的期待。
多中心、随机、双盲III期临床研究ENREACH-PDAC-01:KN046联合白蛋白紫杉醇和吉西他滨在晚期胰腺癌中的应用
研究背景
胰腺癌的侵袭性较强,大多数患者诊断时疾病已发展为局部晚期或晚期阶段。白蛋白紫杉醇联合吉西他滨(AG方案)是晚期胰腺癌常用的治疗方案,但化疗的耐药性是临床中亟需解决的问题。免疫治疗联合化疗或可解决耐药性问题,但在胰腺癌中这一策略尚未获得公认。既往的II期临床研究(NCT04324307)提示,对于31例无法切除的晚期胰腺癌患者,KN046联合AG方案的ORR为45.2%(95%CI 27.3%-64.0%),DCR为93.5%(95%CI 78.6%-99.2%),方案疗效较好。基于此,研究者进行了这项中国的III期关键性研究(ENREACH-PDAC-01),以验证KN046联合AG方案在晚期胰腺癌一线治疗中的疗效和安全性。
研究方法
研究纳入标准为经组织学或细胞学证实的不可切除局部晚期或转移性胰腺导管腺癌患者,患者WHO表现评分为0或1,预期生存期超过3个月。患者按1:1随机分配至干预组或对照组,分别接受4-6个周期KN046(5 mg/kg Q2W)联合AG方案或安慰剂联合AG方案的治疗,并序贯KN046(5 mg/kg Q2W)联合吉西他滨或安慰剂联合吉西他滨的维持治疗。治疗持续至疾病进展,或毒性不可耐受,或患者撤回知情同意、失访或死亡,或研究结束。研究主要终点为OS,关键性次要终点为ORR和PFS。