研究完泽璟制药,对于我来说,属于难判断类型,很多逻辑点都不够扎实。
一、从公司现有的研究管线来看,多纳非尼是公司目前最重要的产品。

在药物设计上,多纳非尼与已上市的索拉非尼与仑伐替尼都是抗血管生成,VEGFR小分子抑制剂。合理地运用抗血管生成药物,能在血管消退之前修复异常的肿瘤血管系统,使肿瘤血管趋于正常,更有效地运输氧和药物到肿瘤细胞,从而提高化疗、免疫治疗的敏感性。通俗来讲,就是将肿瘤周围那些异常的血管修复成正常血管,与免疫治疗一样,都是改善肿瘤周围的微环境,从而使化疗、免疫治疗更好的行使他们的职责。
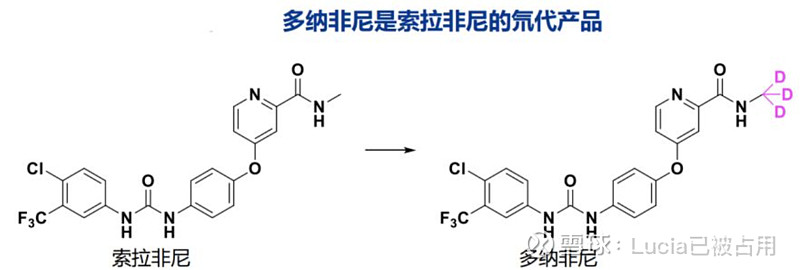
多纳非尼是拜耳的索拉非尼的氘代产品(如下图分子式)。市场对于氘代药物的创新性一直持有质疑,毕竟用一个同位素替换原来的原子,本质上分子还是那个分子。但是同位素确实存在一个“动力同位素效应”,可以让含有氘代的分子相比于含有普通氢原子的分子在参与某些化学反应时反应速度降低,因而改变一些药物动力学性质。所以我认为多纳非尼属于新衍生物,是在原药物进行化学上的改良,可视为全新的化学分子,但因为有旧分子可为参考,所以比摸索一个全新分子的风险小些。
二,从病源看空间。
我国是名符其实的肝癌大国,全世界50%以上的新发和死亡肝癌患者发生在中国。肝癌起病隐匿,进展迅速,等到发现时往往已经到了肝癌晚期,失去了手术机会,而且肝癌对放化疗并不敏感,因此,靶向药治疗就成了晚期肝癌患者的标准治疗手段。虽然肝细胞癌的小分子靶向药疗法虽然相较化疗有了较大的进步,但相比于其他实体瘤, 带给患者的生存获益仍然较小,在肺癌、结直肠癌、淋巴癌等恶性肿瘤当中,小分子靶向药带来的中位生存获益已经达到了十几个月到数年,而已经上市的索拉非尼和仑伐替尼在肝细胞癌当中的中位生存获益仅为数月,9成以上一经发现就已是晚期,此时已失去了手术治疗的机会,致使5年生存率仅为12%,中晚期肝癌患者的5年生存率更是低至3%。在这一点是否对肝癌的用药量上造成不高的天花板?因为对于患者来说获益太小而经济上不划算。
三,从现有竞品看格局。
在肝癌的一线治疗上,德国拜耳公司的索拉非尼于2007年获批用于治疗晚期肝细胞癌,由此改变了肝癌无药可治的状况。而在此后的十年,许多药物都曾尝试挑战索拉非尼,但是在与索拉非尼一线治疗肝癌的单药头对头比较研究中均告失败。因此,很多年里晚期肝癌的一线标准治疗药物一直都只有索拉非尼。
2018年,日本卫材公司的仑伐替尼首次打破这个僵局,在一项与索拉非尼的头对头比较的临床试验中,仑伐替尼以非劣效结果获准上市。
根据索拉非尼开发厂家德国拜耳公司年报显示,索拉非尼2019年前三季度全球销售额5.42亿欧元(约合41.8亿人民币)。而在中国市场,根据Frost & Sullivan数据,索拉非尼2019年前三季度销售额约9.6亿人民币,全年预计销售额可以达到12.8亿人民币, 相比于2018年全年销售额7.1亿人民币,增长率80.3%。(索拉非尼作为一个10多年的药,到2019年销售才12.8亿,可见随着之后竞品的陆续上市,他的市场份额会进一步下降。)
根据仑伐替尼开发厂家日本卫材公司财报显示,截止2019年第三季度仑伐替尼一线治疗肝癌的前三季度2019年全球销售额698亿日元(约合46.2亿人民币),相比于2018 年前三季度销售额331亿日元,增长率110%。而在中国市场,仑伐替尼一线治疗肝癌的 2019年前三季度销售额5.4亿人民币,全年预计销售额可以到达到7.2亿人民币,相比于 2018年全年销售额1亿人民币,增长率620%。
而在中国,中国是一个乙肝大国,乙肝(HBV)感染引起的肝癌占总病例的90%以上。而仑伐替尼对HBV相关肝癌的有效性明显优于索拉非尼,更适合中国的肝癌患者。针对中国患者,仑伐替尼组的中位总生存期(mOS)高达15个月,而索拉非尼组只有10.2个月,足足提高了4.8个月(针对全球总人群的mOS两者差别则相差不大,分别为13.6个月和12.3个月)。在药物设计上,仑伐替尼与索拉非尼都能抗血管生成,但仑伐替尼作用的靶点更集中、抑制作用更强,副作用也更少,所以仑伦替尼一年内可以增长6倍多,抢占了不少索拉非尼的市场,打破了索拉非尼在肝癌市场中的垄断地位。
2017年CSCO年会中,多纳非尼治疗晚期不可手术的肝细胞癌II期临床试验的总生存期(OS)随访结果公布:多纳非尼0.2g和0.3g组的位OS分别长达12.6和11.8个月。三期情况不明。
从现有同类竞品来看,多纳非尼最大的对手是仑伐替尼而不是索拉非尼,但多纳非尼头对头都是跟索拉非尼,但对于它有多大优势于仑伐替尼至少目前还不明朗。
四,从未来的仿制药、VEGFR大分子抑制剂、免疫疗法看竞争
索拉非尼的化合物专利保护期至2020年1月、晶型专利保护期至2025年9月;仑伐替尼的化合物专利保护期至2021年10月、晶型专利保护期至2024年12月。
2019年6月30日已经有石药集团、山香药业、药友制药等多家公司完成了索拉非尼的生物等效性实验。截至2019年6月 30 日已经有正大天晴、科伦制药等多家公司完成或正在进行仑伐替尼的生物等效性实验。这两类药物的专利到期后,预计将会有部分仿制药产品上市。参考于 2013 年到期的抗肿瘤小分子靶向药伊马替尼,其专利到期后,原研药价格并未出现大幅下降,仿制药价格约为原研药五分之一到二十分之一左右。预计这样的价格下降会加速肝癌靶向药市场的进一步渗透,但同时也会加剧竞争。
除了仿制药的竞争,免疫联合疗法也加入了肝癌一线用药的竞争行列。根据罗氏最新披露的数据,其PD-L1+VEGF二联用药组合,在临床一线头对头用药中效果好于索拉非尼,具体数据(中位总生存期)将在之后公布,但在罗氏的表述中显示效果显著。
除上述产品以外,一些针对晚期肝细胞癌一线治疗的创新靶向疗法正处于临床开发过程中,包括帕博利珠单抗、卡瑞利珠单抗联合阿帕替尼或化疗、替雷利珠单 抗和阿特珠单抗联合贝伐珠单抗。帕博利珠单抗联合仑伐替尼一线治疗晚期肝细胞癌于 2019年3月开始III期临床试验;卡瑞利珠单抗联合阿帕替尼对比索拉非尼一线治疗晚期肝细胞癌2019年1月开始III期临床试验,卡瑞利珠单抗与化疗联用于2019年6月开始临床III期试验;替雷利珠单抗2018年1月开始III期临床试验,氨基酸序列专利保护期至2033年9月; 阿特珠单抗联合贝伐珠单抗2018年5月开始III期临床试验。
从以上各部份的分析来看,都显示对肝癌治疗这一块竞争会加剧,又因病种的的特殊性,空间上又不容易确定,只能归为难判断的类型。
五、每二个进入NDA的应该是外用重组人凝血酶,公司反馈:相比其他止血药物有比较显著的优势,它主要用于各种外科手术过程中小血管出血和渗血的止血,相比其他止血药物纯度更高,疗效更好,安全性更高。Ⅱ期临床试验已经证明了它的安全性和有效性的优势。另外,公司外用重组人凝血酶是利用大型的生物反应器来进行工业化生产的,成本更加可控,在临床推广上也具有更大的潜力。这个其实是想对其它凝血酶的替代,但是这功能效果上有多大的明显区别,我认为这对医生来说,是一个很主观的感受。只能靠公司的销售能力有多强去观察是否能起量,但对新上市的公司,销售能力也不是可以客观评价的。
公司的子公司GENSUN主要研发的有多个双/三靶点抗体新药,但对于它的资料少之又少,都是对它的溢美之词,可能跟他的产品都还是在临床前研究,也没什么可说的。

(下面这段文字投资者要细品)根据公司、GENSUN、JACKIE ZEGI SHENG(盛泽琪)及香港泽璟签署的《股权购买与认购协议》及相关补充协议,GENSUN向公司授予四个大分子候选药物在大中华区(包括中国大陆、香港、澳门和台湾)开发和商业化的永久、排他许可,公司有权从GENSUN的产品管线中选定四个大分子候选药物并于四年内向GENSUN支付共计2,000万美元的固定款项,公司应就包含该等大中华区许可的产品在大中华区的销售向 GENSUN 支付该等销售额的 6%作为许可费,支付直至相关专利权到期日或相关产品 在大中华区的首次商业销售起8年孰早者为止。截至 2019年6月30日,公司已通过取 得 GENSUN 独家授权许可的方式选定其2个大分子候选药物产品(ZG005、ZG006)。 公司将于2019年12月31日前及2020年12月31日前分别向 GENSUN 支付500万美元的固定款项,公司未来亦将按照上述约定在相应期限内支付相应产品大中华区年销售额的6%作为许可费。
总结:创新药是一个风险比较大的行业,一定要有风险意识,就算一切都明朗了再进行布局都不晚。对于科创板来说,战略上要乐观,战术上要谨慎,做个谨慎的乐观派,毕竟,现在都还是靠想象力估值阶段。