国际化是医药的长期主义,在近两年的实践下,这句话已经成为行业的一大共识。而将出海浪潮推向新高的,来自两家Biotech,和黄医药、海和药物。
6月,和黄医药向西,重磅产品呋喹替尼获得欧盟委员会批准,用于治疗经治转移性结直肠癌;海和药物向东,更加罕见的,MET抑制剂谷美替尼成为首个由中国公司在日本上市(而非授权转让)的产品。
如果细数今年以来的成功案例,在3月,百济神州也宣布,去年登陆欧洲市场的雷利珠单抗获得FDA批准。
现实再清楚不过了。2024年,资本市场并没有迎来明显回暖,与之相反,裁员、破产的案例比比皆是,这样的语境下,进入庞大的海外市场,才能拯救本土创新。问题是,这并不是一条好走的道路,“和黄医药”们仍是少数派。
曲折与机会同样多,唯有看清方向、找准时机,国产创新药才有望抵达彼岸。
01
尖子生们
弄清楚出海的成功之路,从最近的代表说起。
目前,和黄医药已在国内推出呋喹替尼、索凡替尼、赛沃替尼三款1类新药。其中,呋喹替尼的国际化之路已经取得了阶段性胜利。
高效的“借船出海”模式功不可没。2023年,为尽快将呋喹替尼推向全球市场,和黄医药与武田达成合作开发协议,并且收获了总额高达11.3亿美元的付款,包括协议完成时4亿美元的首付款,以及潜在的监管注册、开发和商业销售里程碑付款,并外加基于净销售额的特许权使用费。
对于呋喹替尼在美国和中国获批上市后,能够快速在欧洲获批,和黄医药首席执行官兼首席科学官苏慰国肯定了武田的关键作用。
但回过头说,登陆欧盟的前提还得是呋喹替尼自身实力过硬。一位创新药领域的投资人表示,呋喹替尼出海是意料之中,本身临床数据就很详实。
支持呋喹替尼出海的FRESCO‑2研究,是一项在美国、欧洲、日本及澳洲开展的国际多中心临床试验,研究结果达到了所有主要终点及关键次要终点,在总生存期和无进展生存期方面均显示出达到具有统计学意义和临床意义的显著改善,并在接受呋喹替尼治疗的患者中展现出一致的获益,无论患者既往接受过何种治疗。
2023年末,苏慰国在接受媒体采访时,回答了“呋喹替尼为什么能够成为最早出海的国产小分子创新药之一”这一问题。
他将和黄医药能够跑出如此速度主要归功于三个一致性,即FRESCO-2国际多中心研究的结果几乎完美得复刻了在中国开展的大型临床III期研究FRESCO;在美国获批的适应证与中国获批的适应证完全一致,进一步明确了呋喹替尼作为三线标准治疗方案地位;不同人种使用的剂量完全一致,说明呋喹替尼的结构和疗效的稳定性非常一致。
实际上,像这类临床试验数据极具说服力,且在出海方面有成功实践的国内创新药企,除了和黄医药,不得不提的还有百济神州和传奇生物。
2019年,百济神州的泽布替尼成为首个获FDA批准的中国创新抗肿瘤药物,其首个适应症被批准用于治疗经治的成年套细胞淋巴瘤患者。
传奇生物则用中国首个自主研发的CAR-T细胞治疗产品,敲开了FDA的大门。2022年,西达基奥仑赛获得FDA批准,用于治疗复发或难治性多发性骨髓瘤患者。在美国成功上市之后,西达基奥仑赛在2022年5月,获得欧盟上市许可,同年9月,在日本获批上市。
回顾2022年,尽管有百济神州和传奇生物的成功打样,但总的来说,这一年国内biotech的出海之路并非一帆风顺,观望者、受挫者众多。
由于受到FDA对于单一国家临床数据的质疑,2022年,信达生物的信迪利单抗与和黄医药的索凡替尼申请遭拒,引发行业对FDA审评标准的探讨,成为了国内Biotech出海的标志性事件,一度令本土创新的国际化之路蒙上阴霾。
好在,经过这些探索者的重新调整,转折发生在2023年。
这一年9月,百济神州替雷利珠单抗在欧盟获批,成为首款在海外上市的国产PD-1抑制剂;10月,君实生物紧随其后,旗下特瑞普利单抗打入美国市场;11月,亿帆医药的第三代白细胞生长因子艾贝格司亭α注射液获得FDA批准上市。
02
海到那边
如果说2022年大家还在讨论要不要出海,那么到2024年,国际化已经成为了国内创新药企制定战略的必选项。
“现在国内企业有点实力的基本是临床阶段就选择海内外双报。”上述创新药领域的投资人说。国内创新药企出海,是为了获取更多的发展机会和市场份额,毕竟美国在创新药市场中占据着重要地位。
根据IQVIA的统计测算,全球药品的市场份额由美、日、德、法、意、英、西、加、韩等发达国家占据主导地位,其中美国的药品市场空间在全球市场中占有份额比例最高,2016年和2021年均为41%,预计2025年仍将占有39%的份额。中国的市场份额在2016年和2021年稳定在11%-12%,2025年的预计市场份额为12%。
这尤其体现在创新药的定价上,例如,在美国上市以后,一盒5mg*21粒的呋喹替尼定价为2.52万美元,这一价格是国内价格的24倍。
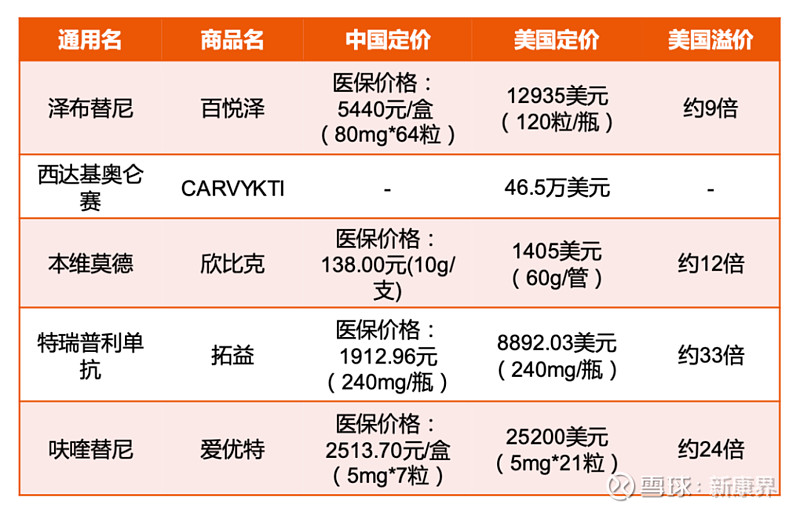
平安证券《中国创新药出海深度报告》
有数据显示,2022年,百济神州的BTK抑制剂泽布替尼的全球销售额总计5.65亿美元,其中美国市场的销售额就达到3.90亿美元。而在中国市场,泽布替尼销售额为1.5亿美元,不及美国市场销售额的一半。
在上述投资人看来,选择出海目的地应该具体问题具体分析,要看相应药物的数据,适应症和流行病学。比如,疫苗和医疗器械会尽量避免和MNC竞争,去找发展中国家的市场。肿瘤药、罕见病药会找保险支付体系成熟的国家。
从监管到资本各环节,美国的环境对新药的引进有更为成熟的体系。
值得注意的是,FDA与多个国家的监管机构都建立了合作机制,包括澳大利亚、加拿大、新加坡、英国等。作为全球医药监管的标杆,已在美国上市的药物,意味着在其他国家获批周期会大大缩短。
为了搭上这趟“快车”,尤其在出海和商业化环节,企业需要早日完成从形成认知、达到标准到各环节逐渐实现行业共识的转变。例如,有国内Biotech刚开始与MNC洽谈交易时,并不习惯被问及过多细节问题,但随着与外企合作经验的变多,对合作的规范化流程也就驾轻就熟。
出海的成功与否,还要看Biotech是否解决临床未被满足的需求,以及其海外临床推进的实力,其中不乏临床开发策略的合理性,以及对时机的把握。
在一次行业分享会上,有从业者表示,想走license out出海这条路的Biotech,为了被MNC选中,瞄准前沿之外,要着重看他们的产品管线和关注重点,思考自己的项目能否丰富MNC的整体管线,或者是否与MNC已有药物形成联用。
受市场整体低迷影响,生物医药领域投融资变难,但创新药企的国际化战略并不会动摇,中国与海外差距会进一步缩小。甚至有观点认为,越是新技术新疗法,由于海外监管严格,企业出海就更要趁早。
参考文献:
1、《中国创新药出海深度报告》;平安证券
2、全球III期完美复刻中国结果,零瑕疵通过FDA现场核查,如何48小时开出处方?一星期纳入NCCN指南?让国产创新共享和黄经验;E药经理人
3、和黄医药公告
—END—
往期精选:
国谈在即,14亿品种降价超50%,多款重磅药踩点冲刺
大卖91亿!超越眼科“神药”拿下第一,18亿品种后来者居上
13亿美元!亚盛医药出售“耐立克”海外销售权
54亿!复宏汉霖正式宣告私有化
点击下面,关注新康界,获取更多热点分析/行研报告/蓝皮书。
◆新康界广泛征集投稿,内容可涉及医药政策、研发动向、资本市场等产业相关话题,投稿请发送至(hejing@sinohealth.cn),请注明联系方式;
◆商务合作/转载开白,请联系13610303540(微信同号)。