5月24日,美国FDA正式批准Dermavant Sciences开发的VTAMA (tapinarof,1%)上市,用于外用治疗斑块状银屑病成人患者。
此次的批准治疗包括所有银屑病患者,不论其严重程度如何,且没有使用持续时间和使用身体部位的限制。这一批准使Vtama成为同类产品中第一个及唯一一个经FDA批准的不含类固醇的外用药,填补了银屑病领域25年无外用新药上市的空白。

来源:Dermavant Sciences官网
Tapinarof在2019年首先在中国获批上市,中文名名为本维莫德,是一种“first-in-class”的芳香烃受体调节剂,最初由Welichem Biotech公司进行开发,是一种从土壤线虫的共生细菌代谢产物中分离出的天然化合物。
Tapinarof在调节自身免疫反应方面发挥重要的作用,作为一种小分子芳香烃受体激动剂,Tapinarof的分子量只有254 Da,具有良好的皮肤渗透性。本维莫德激活AHR可以促进皮肤屏障基因的表达,修复皮肤屏障,并维持皮肤屏障稳态。
Tapinarof还可解决皮肤免疫系统异常的问题,可以促进调节性T细胞生成,维持自身免疫稳态,增强LC细胞的免疫耐受度,降低ROS水平,降低炎症因子IL-17和IL-4的水平。
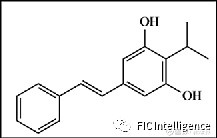
Tapinarof的分子结构式
在两项关键性3期临床试验PSOARING1和PSOARING2中,Tapinarof达到所有的主要和次要终点,大约五分之一的患者在治疗12周后,达到银屑病面积和严重程度指数改善90%以上(PASI 90)的标准。
在PSOARING 3试验中,参加过PSOARING 1和PSOARING2的患者继续接受为期40周的Tapinarof治疗。中期结果表明,57.3%具有皮肤症状的受试者在接受治疗后达到医生整体评估(PGA)评分为0(皮肤症状完全清除),或1(皮肤症状几乎完全清除)的标准。此外,患者停药后治疗效果能够维持4个月。
2012年,葛兰素史克花费2.3亿美元购得本维莫德除中国大陆、台湾、香港和澳门市场以外的市场开发权。2018年7月,葛兰素史克以3.3亿美元的价格向Dermavant出售了这一权益。
2019年,本维莫德(benvitimod)乳膏(商品名:欣比克®)经药监局优先审评审批程序已率先获批上市,上市许可持有人为冠昊生物控股子公司广东中昊药业有限公司。
截图来源:NMPA官网
本维莫德在治疗炎症性皮肤病方面拥有广阔的应用前景。根据冠昊生物官网信息,本维莫德用于治疗特应性皮炎的临床试验,目前已进入Ⅲ期试验阶段,相信未来会有更多适应症获批上市。
参考来源:
网页链接
中康FIC Intelligence是一款辅助企业进行品种改良和创新决策的分析型数据库。该库重点围绕全球上市的1类新药及临床管线进行信息整理,并基于药物的通用名,适应症,靶点,公司4类核心属性进行数据体系的打造,旨在成为“一键检索,全景分析”的高效项目评估工具。
【免责声明】
1.“新康界”部分文章信息来源于网络转载是出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如对内容有疑议,请及时与我司联系。
2.“新康界”致力于提供合理、准确、完整的资讯信息,但不保证信息的合理性、准确性和完整性,且不对因信息的不合理、不准确或遗漏导致的任何损失或损害承担责任。
3.“新康界”所有信息仅供参考,不做任何商业交易及或医疗服务的根据,如自行使用“新康界”内容发生偏差,我司不承担任何责任,包括但不限于法律责任,赔偿责任。
4.本声明未涉及的问题参见国家有关法律法规,当本声明与国家法律法规冲突时,以国家法律法规为准。