本文是肿瘤靶点系列之一,肿瘤靶点大概分为5大类:1、肿瘤形成的靶点(形成/调控机制);2、肿瘤生长的靶点(微环境);3、发现肿瘤的靶点(特异性标志物);4、消灭肿瘤的靶点(免疫调节);5、找到肿瘤父亲的靶点(肿瘤干细胞)。
CD47是属于第4类免疫调节中的一个重要靶点,主要内容小结如下:
1、肿瘤免疫疗法领域最受关注的靶点之一,后起之秀,全球尚无上市药物,已有多起大额交易;
2、失败的案例也多,而BD交易的案子也多;
3、CD47是细胞表面一个重要的“自我”标记,会向巨噬细胞释放“不要吃我”信号,保护正常细胞免受免疫系统的损害;而癌细胞也表达出高于正常水平的CD47,以逃脱巨噬细胞的吞噬;
4、CD47和PD-1分别靶向肿瘤免疫治疗中发挥主要作用的两大免疫细胞类群,CD47抗体主要调节巨噬细胞,PD-1抗体主要调节T淋巴细胞,在肿瘤组织里面巨噬细胞的数量占20%到40%,T细胞占10%到20%,由此可见CD47抗体可能更具优势;CD47通路药物理论上可以与PD-1药物一样用于多类型癌症治疗,与PD-1一样具备成为“神药”的潜质;
5、CD47抗体在血液肿瘤中应用广泛,研究主要集中于急性髓细胞白血病(AML)及骨髓增生异常综合征(MDS)、非霍奇金淋巴瘤(NHL)及多发性骨髓瘤(MM)等。从目前数据来看,CD47靶点在高风险骨髓增生异常综合征表现出优异响应,但在非霍奇金淋巴瘤初步响应并不高,实体瘤(如非小、胃癌、头颈癌)早期响应不理想,头颈癌和胃癌早期响应在20%左右:头颈癌适应症,ALX148联合帕博利珠单抗,总体响应20%;胃癌适应症,ALX148联合曲妥珠单抗,总体响应21%。其中,缺乏有效治疗药物的AML及MDS是热点研究领域,早期临床试验表明联合用药策略更为有效。
6、成药的主要难点:CD47在正常红细胞、T细胞等细胞中的广泛表达,容易误伤友军,安全性难以控制;如何在保护红细胞的同时,最大程度地杀死肿瘤细胞,成为了CD47药物研发的核心问题。CD47抗体目前已经发展到第三代(天境、康方);
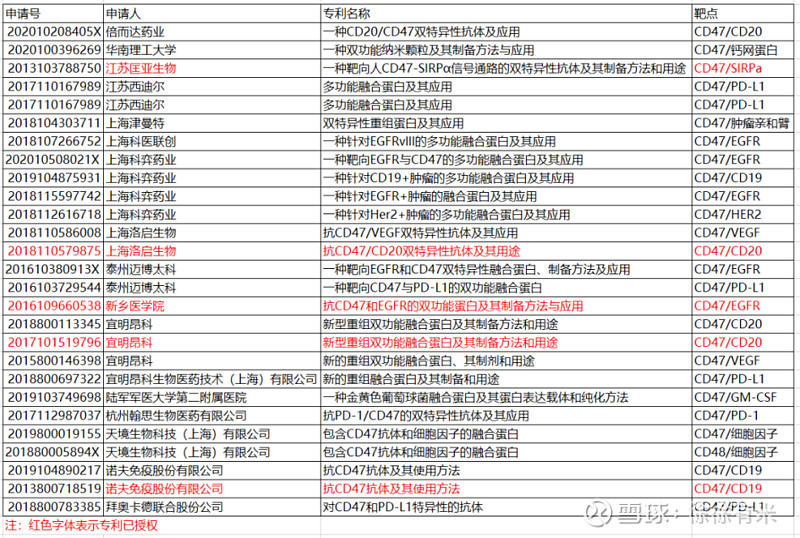
7、全球在研CD47产品共105款(包括临床前项目),其中94款为抗体药。国内企业的相关项目高达53个,已经超过半数,整体进度上和美国不相上下;
国内进度最快的是信达生物的letaplimab,处于临床3期;信达同时布局了3个研发方向:包括CD47单抗、PD-L1/CD47双抗(5个)、以及SIRP-α单抗(引进);
双抗最快的是翰思生物的CD47/PD-1双抗HX009,处于临床2期;
天境生物的明星管线TJC4有望成为全球同类最佳BIC;
宜明昂科是国内临床阶段CD47产品最多的公司(3个在研+1个出让);
8、全球格局:
三大巨头:吉利德/Forty Seven、艾伯维/天境生物、辉瑞/Trillium
重点单抗:吉列德的magrolimab(3期)、天境的Lemzoparlimab(3期)、信达的Letaplimab(3期)
重点双抗:信达生物的CD47/PD-L1双抗、翰思生物的PD-1/CD47双抗HX009、宜明昂科的CD47/CD20双抗IMM0306、辉瑞的PD-L1/CD47双抗PF-07257876
SIRPα-Fc融合蛋白:TTI-621和ALX148
下见详述。
一、历史:
1、发展历史:
1989年
首次被发现
1999年
CD47-SIRPα这一巨噬细胞免疫检查点通路被首次确认
2010年
宜明昂科(ImmuneOnco)创始人田文志博士(知名免疫学专家)开始针对CD47开发抗体药物,做了一系列研PoC(概念确证)研究,领先全球十多年
2015年
基于斯坦福大学著名科学家IrvWeissman教授的研究,FortySeven公司成立
中国著名免疫学家田文志的宜明昂科,成立
抗CD47抗体及阻断CD47-SIRPα通路的不同药物陆续进入临床试验
2018年
10月,信达CD47单抗IBI188就已经获得了FDA的临床批件
11月,《新英格兰医学杂志》(NEJM)发表了一项CD47抗体联合利妥昔单抗治疗非霍奇金淋巴瘤的Ib期临床试验结果,NEJM责任编辑(Deputy Editor)Dan Longo教授在同期配发的评论表示,若结果最终被证实,则意味着巨噬细胞免疫检查点抑制剂将成为肿瘤免疫治疗的新策略。
2019年
3月,20日,宜明昂科递交靶向CD47的融合蛋白药物IMM01的临床试验申请获得NMPA受理
12月,美国血液学会会议上,Forty Seven Inc发布Magrolimab对于MDS和AML患者的1b期研究,Magrolimab有望成为该领域的首创治疗方案。
2022年
全球已出现三类共超过30个同靶点抗体,其中CD47抗体发展至第三代
1月25日,吉列德相关试验被叫停,可能标志着将对热门靶点的审批收紧姿态。当时CD47进度最快的信达生物股价遭遇连续下跌,一周下跌超过26%,股价创出2020年4月以来新低,降至31.950港元。
2、失败史:
2017年底,Arch Oncology宣布终止CD47单抗Ti-061的一项实体瘤I/II期临床试验,因为首例患者在入组接受治疗的第二天,就因红细胞凝集死亡;
2018年7月,Celgene终止CD47单抗CC-90002的Ⅰ期临床,因为其用于治疗急性髓系白血病和高风险骨髓增生异常综合征的疗效和安全性均不佳;
2019年4月,恒瑞终止了CD47单抗的研究;
2022年1月25日,因研究者报告的疑似意外严重不良反应(SUSAR)在治疗组之间明显不平衡,吉利德CD47单抗magrolimab与阿扎胞苷(azacitidine)联合治疗的多项临床研究被FDA叫停。
自此,市场对CD47药物的商业价值产生了严重怀疑。
3、BD交易历史:
2018年
4月,勃林格殷格翰与OSE Immunotherapeutics 就针对髓样细胞的 SIRP-alpha 拮抗剂达成全球独家研究合作并签署专利许可协议。
2020年
3月,吉利德49亿美元收购CD47先驱Forty Seven,获得后者CD47抗体magrolimab格罗格单抗,其目前研究进展最快,用于治疗MDS的试验已经进入临床Ⅲ期,但副作用较大(贫血发生率高达40%左右);
3月,信达生物与Alector公司达成合作,获得后者用于治疗肿瘤的新型抗SIRP-alpha抗体 AL008在大中华区的开发和商业化权益。
7月,赛生药业1.2亿美元引进EpicentRx靶向CD47-SIRPα的小分子免疫疗法RRX-001,这是一款靶向CD47-SIRPα的小分子免疫疗法,目前正在进行针对小细胞肺癌适应症的Ⅲ期临床试验;
9月,天境生物与艾伯维就CD47单抗TJC4达成总价值29亿美元的全球合作;
同月,辉瑞2500万美元投资CD47明星公司Trillium,这而Trillium Therapeutics公司的重点品种即为CD47单抗的TTI 621和TTI 622;
10月,国内药企宜明昂科完成了礼来亚洲基金领投的2500万美元B轮投资,而融资的主要目的即主要用于推进IMM01(SIRPa-Fc)、IMM0306(CD47xCD20 mAb-Trap) 以及 IMM2510(VEGFxPD-L1 mAb-Trap) 三个项目的临床试验研究以及后续几个基于新靶点的单抗、双抗项目临床前研究。(前两个项目即为CD47)
2021年
3月,思路迪医药与ImmuneOncia Therapeutics公司签订一项独家许可协议,获得后者抗CD47单抗IMC-002在大中华区作为单药疗法或组合药物用于肿瘤适应症的开发、生产和商业化的独家权利。
8月,辉瑞将斥资约22.6亿美元,收购Trillium公司,获得其阻断CD47-SIRPα信号通路的两款在研疗法。
二、靶点情况:
1、CD47介绍:
是免疫球蛋白超家族成员(PD1、CTLA4也是),广泛表达于体细胞表面,介导凋亡、增殖、免疫等一系列的反应。
CD47是细胞表面一个重要的“自我”标记,会向巨噬细胞释放“不要吃我”信号,这些信号抑制巨噬细胞介导的吞噬作用,保护正常细胞免受免疫系统的损害。
癌细胞利用CD47的“不要吃我”的功能,表达的CD47水平高于非恶性细胞,得以逃脱巨噬细胞的吞噬,进而实现免疫逃逸(不同的研究表明,几乎所有的肿瘤细胞和组织都高表达 CD47,是对应正常细胞和组织的 3 倍);
大量研究表明,CD47在不同类型的肿瘤中过度表达,包括骨髓瘤、平滑肌肉瘤、急性淋巴细胞白血病、非霍奇金淋巴瘤,乳腺癌,骨肉瘤,头颈部鳞状细胞癌,且与更具侵袭性的疾病和较差的存活率相关;
CD47高表达水平与癌症恶化的治疗反应和预后相关,比如当CD47表达水平较高,影响了肿瘤微环境中的某些细胞因子浓度,将导致PD1药物有效性很低;
研究发现,靶向CD47-SIRPα轴的吞噬检查点在临床前和临床研究中具有显著的抗癌作用,表明CD47-SIRPα阻断剂在癌症治疗中的潜在应用。
2、CD47抗体抗肿瘤的机制:
抑制癌细胞中 CD47 能促进巨噬细胞对肿瘤细胞的吞噬,从而限制肿瘤生长,这提供了新的可行的免疫靶点;
CD47抗体可通过多种不同的机制发挥其抗肿瘤作用,主要是:
1)阻断CD47与SIRPα的结合,瓦解“别吃我”信号,促进吞噬细胞吞噬肿瘤细胞。可以通过2种方式:药物结合到CD47上,或者结合到SIRPα上使其无法被癌细胞结合;
2)CD47抗体通过促进DC细胞对肿瘤细胞的吞噬作用,随后将抗原呈递给T细胞,刺激抗肿瘤适应性应答(简单说,就是让T细胞更熟悉和了解该癌细胞,以后加大对它的杀伤作用);
3)CD47抗体通过NK细胞介导的ADCC和CDC作用杀伤肿瘤细胞(有点像ADC里的“旁观者效应”);
4)CD47抗体可激活肿瘤细胞凋亡途径,直接诱导肿瘤细胞凋亡;
5)CD47 阻断可促进适应性免疫反应;
6)抗 CD47 疗法可以抑制肿瘤细胞增殖。
3、CD47靶点的价值:
CD47和PD-1分别靶向肿瘤免疫治疗中发挥主要作用的两大免疫细胞类群,CD47抗体主要调节巨噬细胞,PD-1抗体主要调节T淋巴细胞,在肿瘤组织里面巨噬细胞的数量占20%到40%,T细胞占10%到20%,由此可见CD47抗体可能更具优势,另外,巨噬细胞是天然的抗原递呈细胞,激活以后可以直接攻击肿瘤,诱导肿瘤抗原特异性T细胞反应,提升疗效的持久性;
CD47在多种实体瘤细胞及恶性血液瘤细胞上呈现高表达,而且其表达水平与疾病进展呈正相关;
这一广泛表达性意味着CD47或将是继PD-1之后肿瘤治疗领域的下一个重要靶点,CD47通路药物理论上可以与PD-1药物一样用于多类型癌症治疗,与PD-1一样具备成为“神药”的潜质;
凭借与PD-1相似的广谱治疗特性,CD47药物一旦成功获批上市,其潜
在市场也将达到与PD-1接近的规模。
PD-1/PD-L1通路最突出的局限性是第一反应性,获益人群基本上30%~40%,经过PD-(L)1抗体治疗的患者,一年半或两年后10%-15%会出现复发耐药情况。这些问题怎么解决,CD47可能就是个切入点,不仅是对PD-L1抑制剂的补充和升级,而是兼顾了先天性和适应性抗肿瘤免疫反应,有望成为新一代广谱抗肿瘤疗法。
CD47可以与不同靶向药物联用,IMM01与康宁杰瑞的PD-L1单抗KN035联用完全清除了小鼠的肿瘤细胞;百济神州的PD-1抗体替雷利珠单抗本身效果也不错,一旦和IMM01联用也完全清除了小鼠的肿瘤细胞;IMM01与三生制药的HER2单抗赛普汀联用也是类似的情况,显示出很好的协同效应,完全清除了小鼠的肿瘤细胞。
CD47在免疫肿瘤里面有非常好的前景,特别在血液肿瘤里治疗最困难的TP53突变组,在髓系的肿瘤里,包括MDS和AML,迄今尚无一个针对多发性骨髓瘤获批的PD-(L)1抗体,但是CD47抗体可以成药。
是调节巨噬细胞吞噬功能的最有前景的靶点之一。
4、适应症和响应率:
CD47抗体在血液肿瘤中应用广泛,研究主要集中于急性髓细胞白血病(AML)及骨髓增生异常综合征(MDS)、非霍奇金淋巴瘤(NHL)及多发性骨髓瘤(MM)等。
从目前数据来看,CD47靶点在高风险骨髓增生异常综合征表现出优异响应,但在非霍奇金淋巴瘤初步响应并不高,实体瘤(如非小、胃癌、头颈癌)早期响应不理想,头颈癌和胃癌早期响应在20%左右:头颈癌适应症,ALX148联合帕博利珠单抗,总体响应20%;胃癌适应症,ALX148联合曲妥珠单抗,总体响应21%。
其中,缺乏有效治疗药物的AML及MDS是热点研究领域,早期临床试验表明联合用药策略更为有效。
5、市场规模:
海通证券研报显示,CD47药物对于多种血液瘤和实体瘤疗效优异,预计全球市场市场可达225亿美元。
宜明昂科的田文志认为从市场来讲,未来CD47靶向药物肯定比PD-(L)1抗体大。(PD1目前规模已达百亿美元)
6、CD47以往的成药困境:
技术门槛:
对于PD-1靶点,只要做出具有中和性、活性的抗体,成功概率基本可达百分之八九十,但是CD47不行,因其具有很多独特的不同之处(成药难度较大),前期工作如果做的不扎实,那么失败概率可达80%。
安全性:
由于CD47在正常红细胞、衰老红细胞和血小板等非恶性细胞中的广泛表达,不少初代药物没能走出脱靶效应的困境,出现了包括溶血性贫血在内的严重副作用;(最重要、最难克服)
T细胞毒性,CD47是到处都有的,T细胞也表达。如果抗体恰好与T细胞CD47的某个表位结合,就可能诱导T细胞凋亡;
血压毒性,有报道CD47抗体药物使用后引起低血压;
同时可能由于 “抗原沉没效应” 而影响药效;
以往的研究显示,抗体的Fc端是导致血红细胞凝集或者被巨噬细胞吞噬的主要原因;
如何在保护红细胞的同时,最大程度地杀死肿瘤细胞,成为了CD47药物研发的核心问题。
7、新一代CD47抗体的一些解决方案:
1)开发Fc端为IgG4型的CD47抗体,而不是能引发强烈ADCC和CDC效应的IgG1型抗体。因为IgG4亚型在血浆中含量较低,以该亚型为主体的CD47单抗,基本不会接触红细胞,毒副作用有限。(如Forty Seven的Magrolimab)
2)通过结构优化降低CD47抗体和红细胞CD47的结合,比如天境生物的TJC4、Trilium 的TTI-621和TTI-62。
3)彻底放弃CD47抗体强效ADCC作用,只利用CD47-SIRPα本身的生物学效应来释放吞噬细胞的抗肿瘤潜力,但往往需要联合用药。(如ALX Oncology的ALX148,目前正在开展与雷莫芦单抗联用的II期临床试验)。
4)抗体融合蛋白或者纳米抗体,前者比如中生尚健的SG404,后者比如洛启生物。
5)双抗: CD47的双抗思路在辉瑞、信达的探索下已经逐渐成熟,双抗将结合CD47或者SIRPα的结构域的亲合力降低(低于另外一个靶点的亲合力),从而使得抗体在目标细胞上聚集,减少抗体对红细胞等细胞的结合,从而增加安全性,提高治疗窗口。
6)条件激活性抗体:当抗体进入肿瘤微环境中,在肿瘤中特异性酶的切割下,即可被切割暴露结合表位并激活其结合活性。如天演药业的ADG153 SAFEbody,理论上在肿瘤微环境中利用肿瘤微环境中的特异酶酶切激活,从而可以避免脱靶效应。(简单说就是把单抗用东西包住,只有到了肿瘤环境内,当地的一种酶的存在,可以把单抗的外沿破坏掉,抗体才能暴露出来和靶点相作用)
7)在增强疗法的抗癌能力方面,多家公司采用了双特异性分子的策略,这些双特异性分子可以是抗体或者与抗体结构相似的融合蛋白。它们一方面可以阻断CD47-SIRPα信号通路,另一方面可以与另一个靶点相结合(类似双抗的原理,只是结构不仅限于抗体蛋白)
8)要密切关注肿瘤微环境(TME),将肿瘤的免疫抑制环境变为激活环境,即设法清除全部或90%以上的具有免疫抑制活性的细胞,比如说Treg、M2细胞,腾出空间给效应T细胞(Teff),只有在这种情况下使用PD-1抗体或者CD47抗体等才能达到最佳治疗效果;
案例:
Forty Seven选择了红细胞毒性较小的亚型抗体进行改良,在2019年12月的美国血液协会会议上,其CD47单抗Magrolima的1b期临床试验结果乐观;
天境生物则是筛选出红细胞的结合能力极低的CD47单抗TJC4,在保留肿瘤杀伤能力的同时,最大程度减少CD47药物的血液毒性;
ALX Oncology放弃了CD47药物的杀伤能力,采用联合治疗的方法应对上述问题。
8、CD47抗体介绍:
目前,靶向该通路的在研药物主要分为三大类,包括CD47抗体、SIRPα融合蛋白以及SIRPα抗体。
CD47抗体备受关注,其研发也经历了不同的阶段。
初代以magrolimab为代表,但其可引起红细胞凝集,同时由于与红细胞结合力较强,易引发贫血等副作用;
以上局限性催生了第二代CD47抗体,以CC9002、IBI188为代表,其避免了体外红细胞凝集,但仍然可与红细胞结合,临床上通常采用预激给药策略,以降低红细胞毒性;
第三代CD47抗体以TJC4(lemzoparlimab,来佐利单抗,天境生物)、AK117(康方生物)为代表,其最大特点为不引起红细胞凝集,且与红细胞的结合低。
目前,CD47 抗体治疗主要是通过 DC 细胞和 CD8+T 发挥肿瘤杀伤效应的。DC 细胞通过 CD47 抗体和亲吞噬分子协同作用,吞噬肿瘤细胞,并提呈肿瘤相关抗原给 CD8+T,进而发挥 CD8+T 对肿瘤的特异性杀伤作用。
三、在研现状:
全球在研CD47产品共105款(包括临床前项目),其中94款为抗体药。国内企业的相关项目高达53个,已经超过半数,整体进度上和美国不相上下;
国内进度最快的是信达生物的letaplimab,处于临床3期;
双抗最快的是翰思生物的CD47/PD-1双抗HX009,处于临床2期;
天境生物的明星管线TJC4有望成为全球同类最佳BIC;
宜明昂科是国内临床阶段CD47产品最多的公司(3个在研+1个出让),信达同时布局了3个研发方向:包括CD47单抗、PD-L1/CD47双抗(5个)、以及SIRP-α单抗(引进);
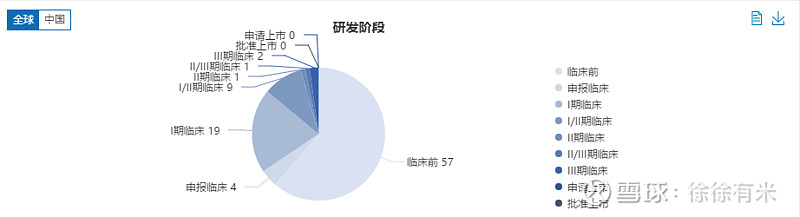
具体到类别,包括 14 款单抗、10 款双抗以及 2 款抗体融合蛋白,详见下图:
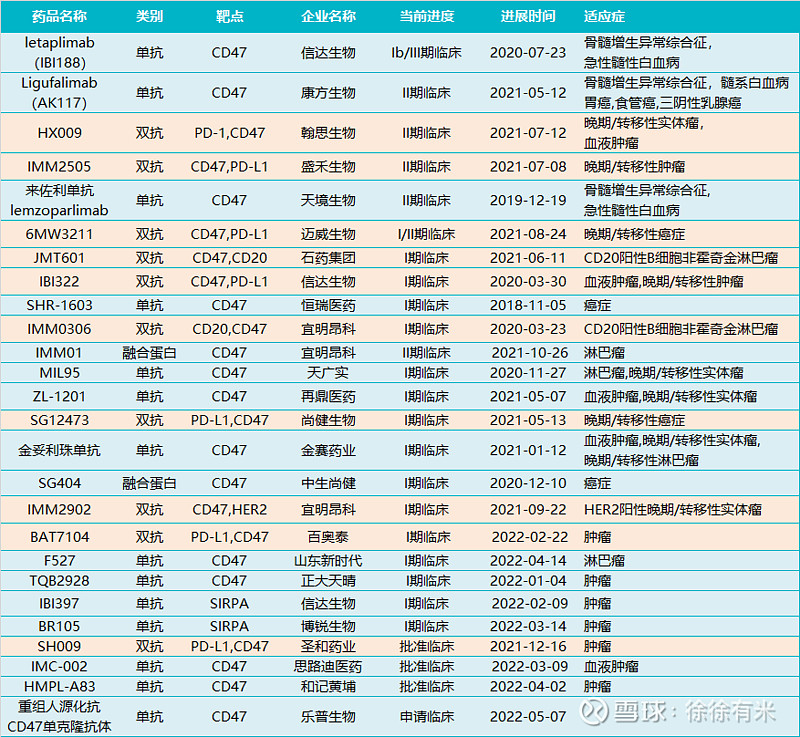
四、重点药物:
三大巨头:吉利德/Forty Seven、艾伯维/天境生物、辉瑞/Trillium
重点单抗:吉列德的magrolimab(3期)、天境的Lemzoparlimab(3期)、信达的Letaplimab(3期)
重点双抗:信达生物的CD47/PD-L1双抗、翰思生物的PD-1/CD47双抗HX009、宜明昂科的CD47/CD20双抗IMM0306、辉瑞的PD-L1/CD47双抗PF-07257876
SIRPα-Fc融合蛋白:TTI-621和ALX148
1、领军FIC:Magrolimab(前身为Hu5F9),Forty Seven/吉利德
特点:
一种人IgG4抗体,本身不具有ADCP活性,只是携带阻断CD47-SIRPa相互作用的活性,所以单药在临床上基本没有效果,必须通过与具有ADCC/ADCP活性的其它抗体药联用才具有较好疗效。
已获资格:
多个适应症获FDA授予的快速审批资格:骨髓增生异常综合症、急性髓性白血病以及两种形式的B细胞非霍奇金淋巴瘤(NHL)复发或难治的弥漫性大B细胞淋巴瘤和滤泡性淋巴瘤(FL)
罕见病资格:被FDA授予用于治疗骨髓增生异常综合症、急性髓性白血病罕见病药物资格、被欧洲药品管理局(EMA)授予用于治疗急性髓性白血病罕见病药物资格
进度:
一线治疗高危骨髓增生异常综合征和一线治疗急性髓系白血病适应症都已进入Ⅲ期临床试验阶段。
适应症上:
MDS骨髓增生异常综合征、AML急性髓系白血病和DLBCL漫大B细胞淋巴瘤三大适应症是magrolimab重点推进的领域;
治疗方法:
采用单药、和化疗药联用、和肿瘤靶向药联用以及和免疫疗法的联用四种方案:
单药主要是急性髓系白血病(AML)以及一些实体瘤方向的研究、和阿扎胞苷联用于一线治疗AML和骨髓增生异常综合征(MDS)、和治疗性肿瘤抗体;
联用于复发或者难治的非霍奇金淋巴瘤(r/r NHL)等方面;
免疫疗法联用则主要是和PD-1/L1的联合用药,如与默克PD-L1药物Bavencio(Avelumab)联用治疗卵巢癌。
临床数据:
在2019年ASH会议上,Forty Seven公布了Ib期临床试验结果。数据显示Magrolimab在联合阿扎胞苷的情况下对骨髓增生异常综合征(MDS)和急性髓系白血病(AML)患者进行治疗具有良好的效果:在24例MDS患者中,总缓解率(ORR)达到92%,50%(12例)达到完全缓解(CR),33%(8例)达到骨髓形态学CR;22例AML患者中,ORR达到64%,41%(9例)达到CR。
在2022ASCO会议上,报告了Magrolimab联合阿扎胞苷在一线TP53突变(TP53m)AML患者中的疗效。研究共纳入72例TP53m AML患者。结果显示:患者ORR为48.6%(其中33.3%为CR)。16.7%的患者疾病稳定,5.6%的患者出现疾病进展(PD)。30天和60天死亡率分别为8.3%和18.1%。72例患者的中位总生存期(OS)为10.8个月(95%CI:6.8-12.8),中位随访时间为8.3个月。常见不良事件为便秘(52.8%)、腹泻(47.2%)、发热性中性粒细胞减少(45.8%)等。 结果表明,在不适合强化化疗的高危TP53m AML患者的一线治疗中,Magrolimab+阿扎胞苷显示了持久的缓解和突出的OS。
安全性方面:
2022年1月,该药物因潜在安全性问题被FDA暂停部分临床,在回顾了每个试验的综合安全性数据后,FDA在4月解除了Magrolimab联合阿扎胞苷研究的临床暂停。
在使用低剂量预激剂量(priming dosing)策略后,即第一周使用低剂量(1mg/kg)、第二周再使用正常剂量(30mg/kg),在MDS(骨髓增生异常综合症)和AML(急性髓系细胞白血病)患者中,贫血、中性粒细胞减少、血小板减少的3级和4级治疗相关不良事件出现频率仍然很高。
2、BIC:Lemzoparlimab(TJC4),天境生物
独特优势:
第三代CD47抗体;
为规避血液毒性问题,公司通过独特的抗原结合表位,保留促进巨噬细胞活性和抗肿瘤药效的同时,降低药物与红细胞的结合,减少抗体注射后带来的贫血等副作用;
TJC4能够识别独特的CD47抗原表位,而该表位在红细胞上由于糖基化修饰作用使得其不能充分暴露,从而导致TJC4对红细胞的结合力微弱:
(A) 与Forty Seven公司的CD47单抗5F9相比与人红细胞结合更弱;
(B) TJC4不会引起凝血;
(C) 20mg/kg剂量单次注射,TJC4对食蟹猴红细胞计数的影响更小。
迄今为止,由 I-Mab 进行的临床研究表明,lemzoparlimab 不会引起显著的血液学毒性,也不需要剂量引发;
临床数据:
I/IIa期研究的初步结果表明(NCT04202003),在5名之前接受过2-4次治疗的R/R AML和MDS患者中,具有良好的耐受性安全性和一定的临床疗效。特别值得注意的是,一名原发性难治性AML患者在以1 mg/kg的剂量接受2个周期的lemzoparlimab治疗后,达到形态学无白血病状态( MLFS )
截至2021年12月31日,超过180名患者的治疗数据,来佐利单抗无需预激给药、无抗原“沉没效应”,在骨髓增生异常综合征(MDS)、急性髓细胞白血病(AML)、非霍奇金淋巴瘤(NHL)的治疗中显示出抗肿瘤活性。
未来空间:
根据天境生物年报,TJC4在临床中剂量已爬坡到30mg/kg。在GLP食蟹猴毒理实验中,TJC4在重复给药高达100mg/kg的高剂量下展现出良好的耐受性。理论上,TJC4的临床剂量未来还有上升的可能。(剂量越高将预示着疗效越好)
3、RRX-001,三期
目前全球涉及CD47信号通路产品中唯一一款小分子药物;
RRX-001可与化疗、其他免疫疗法、放疗和靶向药物联合使用。
临床数据:
一项II期临床试验显示,在26例小细胞肺癌患者三线治疗中,RRX-001联合化疗组的总生存期达到8.6个月,无进展生存期为7.5个月,较以往小细胞肺癌三线治疗结果有明显改善(总生存期4.7个月,无进展生存期<2个月)。 进度:
RRX-001正在进行一项名为REPLATINUM的III期临床试验,用于治疗三线及以上的小细胞肺癌患者。
4、Letaplimab(IBI188),信达,3期
一种以CD47为靶点的重组全人源IgG4单克隆抗体。
目前信达生物在美国和中国已先后完成了Ⅰa期至30mg/kg剂量组的安全性探索,观察到的letaplimab总体耐受性良好,连续给药4周,最高无严重毒性反应剂量为100 mg/kg,每周一次,具有较好的安全性。
公司目前正在中国开展评估IBI188联合阿扎胞苷治疗初诊中高危骨髓增生异常综合征以及急性髓系白血病受试者安全性及有效性的Ⅰb/Ⅱ期研究。
同时公司正在美国开展评估IBI188联合阿扎胞苷治疗初诊中高危骨髓增生异常综合症受试者安全性和有效性的Ⅰb期研究。
临床数据方面:在 2022 JPM 会议上,信达生物公布了IBI188针对骨髓增生异常综合征的Ib期PoC研究数据,ORR达到 83.3%,其中包括 2 例完全缓解(CR)、2 例细胞形态学完全缓解(mCR)+血液学改善(HI)、2 例 HI、4 例 mCR。
安全性方面:单药使用后整体贫血发生率为15%,3例3/4级不良反应。
5、TTI-621、TTI-622,Trillium/辉瑞,2期
Trillium的这两款候选药均为靶向CD47的SIRPα融合蛋白。这类疗法的最大特点在于一方面不与红细胞结合,另一方面亲和力低于CD47抗体,这使其安全性相对较好,从而可降低患者贫血风险。
融合蛋白的优势:单药治疗可以出现完全缓解(CR)
适应症:
临床研究中,TTI-622和TTI-621已证明作为单药治疗复发或难治性淋巴恶性肿瘤,包括弥漫性大B细胞淋巴瘤、外周T细胞淋巴瘤(PTCL)、滤泡性淋巴瘤和其他淋巴恶性肿瘤。
TTI-621的分子最早从加拿大一所大学引进,是没有经过任何基因修饰的IgG1,单药效果不错但早期出现了三级副作用血小板下降,最后确认这一副作用只持续72小时。
由于TTI-621对巨噬细胞的激活效果更强,理论上可产生更强的治疗效果。
但在初期数据中,TTI-621的缓解率不及TTI-622,且剂量仅爬坡至2mg/kg,而后者剂量已爬至18mg/kg,在不同治疗窗口下,TTI-622疗效与安全兼顾,预计未来辉瑞将重点布局TTI-662。
2020年ASCO大会上,Trillium公布TTI-622用于治疗复发难治性淋巴瘤的Ⅰ期临床数据:已经观察到1例部分缓解、1例完全缓解。此前,TTI-621单药治疗已经观察到完全缓解。
6、想法新奇:AO-176,Arch Oncology
主要用于实体瘤患者的治疗,同样是结合肿瘤细胞而不结合红细胞。
抗体具有高度差异化特征,有潜力提高其安全性和有效性。
具体来说,公司的想法非常直接,放弃CD47抗体的“杀伤力”,只要求它发挥“开关”作用,该疗法单药对于实体瘤的客观缓解率为0,也就是,该药物对患者没有疗效。
该药主要是关闭肿瘤细胞“别吃我”的信号通路,让肿瘤细胞暴露的同时,结合其他抗肿瘤药物治疗,以起到更好的效果。
ALXOncolog发布的ALX148与Rituximab联合治疗复发性/难治性非霍奇金淋巴瘤(NHL)患者的1期临床试验数据显示,该组合疗法使NHL患者达到了40.9%客观缓解率(ORR),并使患者的中位无进展生存期(PFS)达到7.4个月。
7、IMM2902,宜明昂科
CD47/HER2双抗,正准备启动临床,临床前研究显示在不同的肿瘤模型中,单药可以完全清除肿瘤细胞。同时,它对红细胞没有影响。
8、CD47/PD-L1双抗IBI-322,信达
既能刺激巨噬细胞产生吞噬作用,又能阻断PD-1信号通路,通过两种机制一起发挥作用,强化了对肿瘤细胞的杀伤力。
由于PD-L1的亲和力强于CD47,这意味着与抗CD47单抗相比,IBI322可以更有效地选择性结合肿瘤细胞,从而降低与红细胞上表达的CD47结合的可能性,降低抗CD47抗体相关的毒性。
根据IBI-322的临床前数据,CD47双抗比单抗具有更好的杀肿瘤功效,并且很好的降低了药物副作用。
已于2020年1月在中国获批临床,适应症为实体瘤和血液肿瘤。
9、IBI397,信达,融合蛋白(引入)
通过诱导巨噬细胞上SIRP-α的内吞和降解来降低SIRP-α/CD47通路信号,以达到解除免疫抑制的效果,而且该药还可通过Fc端结合激活性的Fc γ受体来进一步提高肿瘤免疫反应。
五、待面临的、可能的其他挑战:
1、CD47单抗的单药疗效并不亮眼:
大多数在研的CD47药物,由于需要规避红细胞毒性,导致单药效果都不尽如人意,先驱FortySeven 30mg/kg组的患者客观缓解率仅10%,TTI-622的客观缓解率虽然高达33%,但囿于血小板毒性因素,困难重重。而TTI-621目前的客观缓解率为18—29%,也不“够用”。
2、可能的非靶向效应(毒性)
最常见的可能是贫血。CD47 抗体治疗造成短暂性的贫血是其主要的不良反应;虽然该不良反应在临床上比较好控制,但是 CD47 抗体治疗是否真的对其他正常组织没有伤害,是目前最为重要的一个问题。
3、抗原沉默
CD47普遍表达意味着药物可能需要大剂量或频繁给药才能实现对CD47的有效治疗性阻断。临床前研究表明,诱导吞噬作用需要40-60%的受体占有率。Hu5F9-G4的临床试验中使用高治疗剂量便是出于这个考虑。
4、靶向SIRPα
除了CD47,现有管线不少是靶向SIRPα。与CD47相比,SIRPα的组织学分布更受限制,作为靶标可能会降低毒性。但SIRPα在髓样细胞以及中枢神经系统和外周神经系统细胞中高度表达,因此SIRPα疗法应考虑潜在的神经系统副作用。此外由于其序列相似性,其他SIRP家族成员(SIRPβ和SIRPγ)之间可能发生交叉反应。
六、未来展望:
将来以CD47为基础的临床开发是一个巨大工程:
宜明昂科的CD47和康宁的PD-L1单抗、百济神州的PD-1单抗、三生制药的HER2单抗在临床前的小鼠试验中都出现很有的协同效应,后期将继续确认联用效果和更多联用对象;
双抗或联用的开发:
以FortySeven的magrolimab为例,虽然其针对急性髓系白血病和骨髓增生异常综合征的客观缓解率仅为10%,但其与阿扎胞苷联合治疗的客观缓解率分别高达92%和64%。疗效不错的同时,安全性方面也是足够突出,目前并未有患者因不良反应而停止治疗。
信达的CD47/PD-L1双抗的临床前数据显示了更好的杀肿瘤功效,并且很好的降低了药物副作用。
这说明了选用其他药物联用或做成双抗,CD47将会使疗效大增,可用于提高肿瘤特异性和降低对表达CD47的非恶性细胞的靶向毒性。
临床的数据显示,未来更有前景的是药物的联合,包括跟阿扎胞苷的两药联合,以及跟阿扎胞苷和维奈克拉的三药联合,特别是只做一些亚群,比如TP53突变的亚群,可能会有潜在的更好的获益,当然还包括现在CD20和CD47的联合使用等等。