和黄医药引进的抗肿瘤新药「他泽司他」拟纳入优先审评
2024-06-27 07:58 上海
▎药明康德内容团队报道
中国国家药监局药品审评中心(CDE)官网近日公示,和黄医药申报的氢溴酸他泽司他片拟纳入优先审评,拟定适应症为EZH2突变阳性且既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。根据和黄医药公开资料,他泽司他是由益普生(Ipsen)旗下公司Epizyme开发的EZH2甲基转移酶抑制剂,和黄医药负责在中国大陆、香港、澳门和台湾地区进行他泽司他的研究、开发、生产以及商业化。
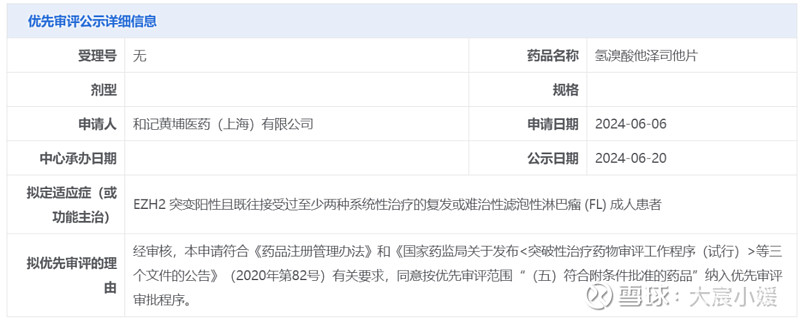 截图来源:CDE官网
截图来源:CDE官网滤泡性淋巴瘤(FL)是非霍奇金淋巴瘤的一种亚型,约占非霍奇金淋巴瘤的17%。他泽司他是一款“first-in-class”EZH2甲基转移酶抑制剂,它可通过抑制EZH2进而抑制H3K27的甲基化,恢复抑癌基因的表达,让B细胞继续分化或者产生细胞凋亡,从而控制肿瘤的生长。该药分别于2020年1月和6月获美国FDA加速批准用于治疗晚期上皮样肉瘤患者和某些复发/难治性滤泡性淋巴瘤患者。
2022年5月,他泽司他的临床急需进口药品申请获海南省卫生健康委员会和海南省药品监督管理局批准,于海南博鳌乐城国际医疗旅游先行区使用,用于治疗某些上皮样肉瘤和滤泡性淋巴瘤患者,与FDA已批准的标签一致。2023年3月,他泽司他于中国澳门地区获批上市。

2023年9月,和黄医药宣布他泽司他在中国的一项桥接研究已完成患者入组,该研究用以支持在美国获批的基础上寻求中国附条件批准。该项桥接研究是一项多中心、开放标签的2期临床试验,研究的主要目标是评估他泽司他用于治疗伴有EZH2突变的复发/难治性滤泡性淋巴瘤患者(队列一)的客观缓解率(ORR);其他次要目标是评估他泽司他用于治疗伴有或不伴有EZH2突变的复发/难治性滤泡性淋巴瘤患者(队列二)的缓解持续时间(DoR)、无进展生存期(PFS)及总生存期(OS),并评估安全性和药代动力学。
此外,和黄医药还正在参与益普生的SYMPHONY-1研究,并领导在中国进行的研究。在既往接受过至少两种治疗后复发或难治性滤泡性淋巴瘤患者中开展的SYMPHONY-1全球1b/3期研究的1b期部分已经公布了令人鼓舞的数据:ORR为90.9%;在使用3期临床试验推荐剂量的队列中,18个月的PFS和DoR估计分别为94.4%和100%,并且未出现剂量限制性毒性。