2024年加科思研究报告:小分子创新药黑马,突破不可成药靶点
来源:天风证券1. 加科思:攻克无成药性靶点,专注肿瘤创新疗法
公司于 2015 年 7 月成立,以“必须具有科学基础、未被满足的临床需求、进入临床时有 做到全球前三的潜力以及国际市场机会”为核心项目立项的三原则,在已验证的肿瘤信 号通路中针对难成药的靶点开发全球首创新药。公司以自有的诱导变构药物发现平台及 转化医学平台为基础,开展原创新药研发,主要针对包括 KRAS 信号通路、MYC 信号通 路、P53 信号通路、RB 信号通路、肿瘤代谢通路以及肿瘤免疫通路在内的六大肿瘤信号 通路,同时布局国内及海外市场。公司于 2020 年 12 月成功登录港交所,在北京、上海、 波士顿均设有研发中心,全球员工人数已达 300 人以上。
1.1. 卓越管理层积淀深厚,引领公司行稳致远
核心管理团队经验丰富,多年团队合作默契。公司核心团队成员在创新药领域拥有丰富 的研发、管理及商业化经验,引领公司业务向全球纵深拓展。公司首席执行官兼董事长 王印祥博士曾于耶鲁大学分子生物物理和生物化学系进行博士后研究,拥有三十余年肿 瘤药物研发经历,2003 年回国创建贝达药业,二次创业成立加科思。首席医学官、执行 副总裁王宜是消化道肿瘤学专家,在肿瘤临床和转化医学有二十多年的研究经验。加入 加科思之前,王宜博士是美国圣路易斯华盛顿大学医学中心的肿瘤科医生、消化道肿瘤 主任及早期临床实验中心的主任,在六十多个临床试验中担任主要研究者(PI);临床前 研发执行副总裁龙伟在北京大学完成医学免疫学专业的博士后研究,拥有超过 15 年一线 药物研发经历。
公司股权结构集中,一众知名投资机构重金布局。公司在 2020 年公开募股前已经完成五 轮融资,吸引礼来亚洲基金、高瓴资本、启明创投等知名风险投资机构。截至 2023 年 6 月 30 日,公司大股东主要包括王印祥、王晓洁、胡云雁等一致行动人(合计持股 27.82%)、 Fangyuan Growth SPC-PCJ(11.02%)、Center Venture Holding(10.01%)、高瓴资本 (6.84%)等。
1.2. 研发团队迅速扩大,创新推动高质量发展
公司所有管线产品仍处于临床试验阶段,尚未形成销售收入及盈利。2023H1 公司录得收 入 40.3 百万元,归因于与 AbbVie 签订以研发、制造及商业化 SHP2 抑制剂的许可及合作 协议所产生的研发成本报销;2023H1 归母净亏损为 1.66 亿元,主要由于公司持续加大临 床管线投入力度。公司员工人数从 2017 年 100 余人增加至 2023H1 300 余人,主要研发 团队成员具备多年新药研发或临床研究经验。
持续加大研发投入,现金流稳定充足。公司自成立以来持续加大研发支出,加速推进在 研产品临床开发进度,研发费用由 2020 年 1.86 亿元提升至 2022 年 4.46 亿元,CAGR 达 54.85%,2023H1 研发费用为 1.99 亿元。公司重视研发管线的知识产权保护,截至 2023H1,公司的全球专利或专利申请数量达 310 项,有效提升公司核心管线竞争力。公 司 2023 年获得多轮融资,2 月配售融资 1.59 亿港元,7 月获得亦庄国投 1.5 亿元资金。
1.3. 重点布局六大肿瘤信号通路及靶点,临床管线具备全球竞争优势
围绕六大肿瘤信号通路布局产品管线,覆盖多种主要癌症类型。公司的管线布局主要针 对六大肿瘤信号路,包括 KRAS 信号通路、MYC 信号通路、P53 信号通路、RB 信号通路、 肿瘤代谢通路以及肿瘤免疫通路,覆盖约 70-80%的癌症类型。KRAS 突变发生于约 25%的 非小细胞肺癌患者、40%的结直肠癌患者及 95%的胰腺癌患者中,包括 KRAS G12C、G12D、 G12V 等突变类型;MYC 基因家族包括 C-MYC、N-MYC、L-MYC、R-MYC,斯坦福医学 院和 Sarafan ChEM-H 的研究人员发表的《MYC-driven synthesis of Siglec ligands is a glycoimmune checkpoint》研究表明 MYC 与人类 70%以上的癌症有关;P53 基因是一种 肿瘤抑制基因,50%以上的恶性肿瘤都会出现该基因突变。公司专注于开发针对癌症中无 成药性靶点的新药,其中 SHP2、KRASmulti、P53 等项目的研发进展均处于全球前三,同时 基于六大肿瘤信号通路聚焦新一代的抗体偶联药物,包括 ATDC、ISAC 和 AOC,用靶向 药物分子、免疫刺激分子及寡聚核苷酸等新型载荷替代传统的毒素分子,以应对传统药 物无法解决的问题。
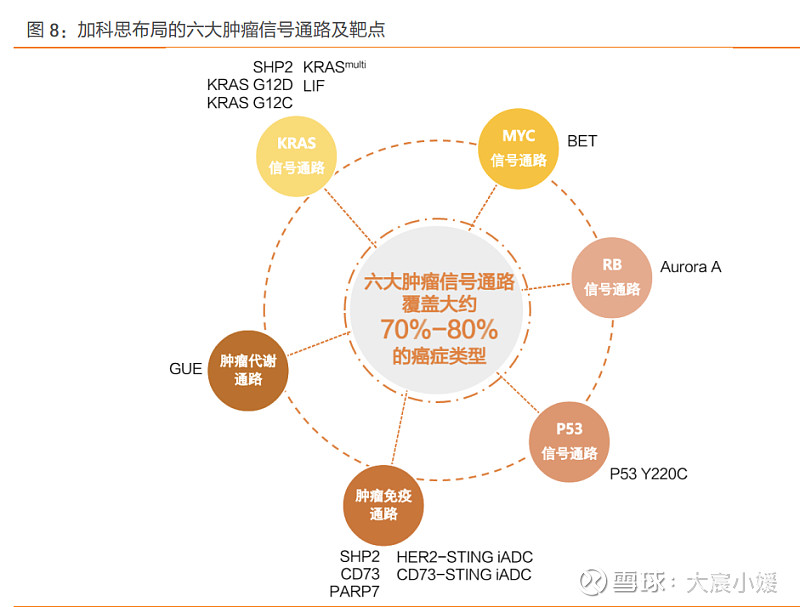
临床管线具备全球竞争优势,全球同步开发加速推进。公司以临床需求为导向,已构建起 核心项目全球前三的的丰富在研管线,分别靶向 KRAS G12C、SHP2、BET、CD73、Aurora A 等在肿瘤中广泛存在的突变位点。截至 2023 年 10 月,公司已有 8 个管线项目进入全球 临床阶段,并具有全球前三的产品潜力,分别为 KRAS G12C 抑制剂格来雷塞(适应症:NSCLC、CRC、PDAC 等实体瘤;国内临床状态:注册性临床)、SHP2 抑制剂 JAB-3312 (适应症:NSCLC 等实体瘤;国内临床状态:IIa 期)、BET 抑制剂 JAB-8263(适应症:实 体瘤; 国内临床状态:I 期)、CD73 单抗 JAB-BX102(适应症:实体瘤;国内临床状态:I 期)、Aurora A 抑制剂 JAB-2485 (适应症:实体瘤;国内临床状态:I 期)、GUE 抑制剂 JAB-24114(适应症:实体瘤,血液系统恶性肿瘤;国内临床状态:IND 获批)、LIF 单抗 JAB-BX300(适应症:实体瘤;国内临床状态:IND 获批)、PARP7 抑制剂 JAB-26766(适 应症:实体瘤;国内临床状态:IND 获批)。
临床前管线差异化优势明显。截至 2023 年 7 月,公司已公开 5 个临床前管线项目,分别 靶向 G12D,G12V,G13D 等多个 KRAS 位点,以及 P53、CD73、HER 等在肿瘤中广泛存 在的突变位点,预计将于 2023-2025 年启动 IND,分别为 JAB-23400(KRASmult,适应症: PDAC、CRC、NSCLC;临床状态:2024 年上半年提交 IND)、JAB-30300(p53 Y220C, 适应症:实体瘤;临床状态:2024 年 Q1 提交 IND)、JAB-X1800(CD73-STING iADC, 适应症:实体瘤;临床状态:2024-2025 年提交 IND)、JAB-BX400(HER2-STING iADC, 适应症:实体瘤;临床状态:2024-2025 年提交 IND)以及 JAB-22000(KRAS G12D,适 应症:PDAC、CRC、NSCLC;临床状态:先导化合物优化)。JAB-23400 可针对多种 KRAS 突变类型,JAB-X1800 为新一代 STING 免疫激动剂偶联的 ADC 药物,可将冷肿瘤 转变为热肿瘤,解决 PD-1 无效或者耐受的问题,极具 FIC 药物潜力,公司已于2023AACR 大会上公布 JAB-23400、JAB-2485 和 JAB-X1800 三条管线的临床前研究数据。
核心产品格来雷塞 NDA 在即,多个管线研发推进加速。公司 2023H2 至 2024H1 将有多 个催化剂事件:1)核心管线 NDA 申报:格来雷塞(JAB-21822)针对非小细胞癌症 (NSCLC)单药疗法计划于 2024H1 提交 NDA;2)推进 2 个关键性试验:格来雷塞针对 胰腺癌的单药注册性临床已于 2023 年 9 月启动;与西妥昔单抗联用治疗结直肠癌的注册 性临床将于 2023H2 获批;3)联合疗法项目 POC 数据读出:格来雷塞与 SHP2 抑制剂 (JAB-3312)针对非小细胞癌症的联合疗法将于 2023Q4 进入 POC 数据读出期;4)推进 5 个管线项目的重要临床进展:2023H2-2024 年公司将有 3 个在研管线(JAB-8263、 JAB-2485、JAB-BX102)进入 RP2D,2 个早期管线(JAB-23400、JAB-30300)获批 IND; 5)数据发表:JAB-3312 与 JAB-21822 联用初步临床数据已于 2023 年 10 月在 ESMO 大 会上作口头报告;JAB-21822 单药治疗胰腺癌及其他实体瘤临床数据计划于 2024 年 1 月 递交 ASCO GI。
2. JAB-21822:向不可成药靶点 KRAS 宣战,成功获批突破性 疗法
2.1. 非小细胞肺癌 KRAS 突变高发,KRAS G12C 难成药问题亟需解决
KRAS 与肿瘤发生发展通路密切相关。KRAS 是人类癌症中最常见的致癌基因之一。RAFMEK-ERK 通路是 KRAS 信号通路的经典下游靶点,激活的 KRAS-GTP 可将 RAF,一种丝 氨酸/苏氨酸特异性蛋白激酶,从细胞质招募到质膜,诱导 RAF 构象变化,并通过同源或异源二聚化促进 RAF 的激活。RAF 的 c 端催化结构域与 MEK1/2 结合并通过磷酸化激活 RAF。MEK1/2 磷酸化并激活 ERK1/2,激活的 ERK 磷酸化核糖体 S6 激酶(RSK)、血清反应 因子(SRF)、E26 转化特异性转录因子(ETS)和 ETS like-1 蛋白,调控相应靶基因的转录和翻 译,从而参与调控细胞增殖、分化、迁移等生命活动。KRAS 参与 PI3K-AKT-mTOR 通路, 该通路在细胞增殖、分化、凋亡和葡萄糖转运等细胞生命活动中发挥重要作用。激活的 KRAS 可以通过与 PI3K 的 p110 亚基结合来激活 PI3K。活化的 PI3K 催化的 4,5-二磷酸磷 脂酰肌醇(PIP2)转化为 3,4,5-三磷酸磷脂酰肌醇(PIP3)。PIP3 促进磷酸肌醇依赖激酶 1(PDK1)在 Thr308 位点磷酸化 AKT。mTOR 复合物 2 进一步磷酸化 AKT 的丝氨酸磷酸化 位点(Ser473),导致 AKT 完全激活,活化的 AKT 进入细胞核,进而激活或抑制许多下游通 路,调控细胞增殖、凋亡和代谢过程。
KRAS 突变介导肿瘤微环境中发生的免疫逃逸,进而引发 PD-1 耐药。KRAS 突变除影响 肿瘤细胞外,还通过影响 TME 中的免疫细胞发挥免疫逃逸作用,使得使用 PD-1 的免疫 治疗无法发挥作用。KRAS 突变通过促进相关细胞因子的分泌,诱导 TME 中的 CD4+ T 细 胞转化为免疫抑制的 Treg 细胞。KRAS (G12C)介导的 T 细胞表型转化是由 CRC 中 MEK/ERK/AP-1 信号通路介导的 IL-10 和 TGF-β1 分泌的结果。在 KRAS 转基因肺癌模型 中,Treg 细胞的基因功能抑制肺癌的发生和进展,表明了 Treg 细胞在肺癌肿瘤发展中的 必要性。此外,KRAS (G12V)和 KRAS (G12D)突变通过上调 PDAC 和 CRC 中的 GM-CSF 来 增强 TME 中 MDSCs 的浸润,从而导致抗肿瘤免疫逃逸;KRAS (G12D)可以抑制干扰素调 节因子 2 (IRF2)的分泌,从而促进 CXCL3 分泌增加,CXCL3 作用于 MDSCs 上的 CXCR2, 导致 MDSC 迁移到 TME,引起免疫逃逸和免疫治疗耐药。
多种癌症的主要 KRAS 突变类型为 KRAS G12C 突变。KRAS 突变以单碱基错义突变为主, 其中约 81%位于密码子 G12,14%位于密码子 G13,2%位于密码子 Q61,不同肿瘤类型之 间存在差异,在胰腺癌、结直肠腺癌和非小细胞肺癌中最为常见。胰腺癌的 KRAS 突变频 率最高,为 67.6%,KRAS (G12D)是最主要的突变亚型,突变频率为 26.84%,占 KRAS 突 变的 39.71%;在非小细胞肺癌中,KRAS 突变频率为 20.4%,KRAS (G12C)是突变频率最高 的亚型,突变频率为 8.38%,占 KRAS 突变的 41.04%;在结直肠腺癌中,KRAS 突变频率为 35.8%,突变频率最高的亚型是 G12D,突变频率为 9.87%,占 KRAS 突变的 27.58%。
KRAS G12C 突变阳性患者数量稳定增长,用药市场需求旺盛。KRAS G12C 突变阳性在肺 癌、结直肠癌和胰腺癌中较为常见。根据弗若斯特沙利文数据,2016 年至 2020 年,全 球主要 KRAS G12C 突变阳性癌症的发病人数从 27.0 万人增长至 30.0 万人,并预计于 2030 年增长至 38.5 万人。中国主要 KRAS G12C 突变癌种的发病人数从 2016 年的 3.8 万 人增长至 2020 年的 4.3 万人,并预计于 2030 年达到 5.8 万人。
KRAS 难与传统小分子结合,G12C 位点为 KRAS 成药的突破点。KRAS 在信号转导中起着 核心作用,KRAS 突变与肿瘤的发生和发展密切相关,传统具有“深口袋”结构的靶标蛋 白可以促使药物与位点结合,从而发挥药效,但 KRAS 基因结构处的蛋白体积小、表面光 滑,缺乏传统小分子药物可以结合的“深口袋”结构,一度被药学界公认为是“不可成 药”的靶标,此外,它在激活状态下与三磷酸腺苷 GTP 结合紧密,进一步增加了抑制激 活 KRAS 的难度。 KRAS G12C 成为改变这一格局的关键。KRAS 蛋白表面有 2 个开关即 switchⅠ和 switchⅡ, 当 KRAS 与 GTP 结合时,2 个开关处于闭合状态,此时 KRAS 蛋白处于活性构象;当 KRAS 与 GDP 结合时,switchⅠ和 switchⅡ处于开启状态,此时 KRAS 蛋白处于非活性构 象。在 KRAS G12C 突变蛋白中,突变后的半胱氨酸 cys12 提供 1 个潜在的共价位点,当 带有共价弹头的抑制剂与突变的 cys12 共价结合后,诱导 switchⅡ区域产生 1 个新的变构 口袋 S-ⅡP,并且小分子抑制剂延伸到该变构口袋与相应氨基酸发生相互作用,使 KRAS 蛋白构象发生改变,从而降低 GTP 与 KRAS 的亲和力,阻碍 GEF 催化 GDP 替换 GTP,进 而将 KRAS G12C 突变体锁定在失活状态。现有的 KRAS 抑制策略包括共价抑制剂和增加 突变蛋白降解,共价抑制剂如 AMG510 和 MRTX849 将 KRAS (G12C)锁定在灭活的 GDP 结合状态,从而降低 KRAS 功能;另一种策略是增加突变 KRAS (G12C)蛋白的降解,例如 在共价抑制剂基础上开发的内源性 KRAS (G12C)降解物 LC-2,可以促进 KRAS (G12C)降解。
2.2. 布局多种适应症,疗效安全性表现俱佳
JAB-21822 为不可逆 KRAS G12C 变构抑制剂,多种适应症与联合疗法全面布局。JAB21822 药物分子通过共价结合于 KRAS G12C 的 12 位突变的半胱氨酸残基上,使 KRASG12C 锁定在非活化状态,从而阻断 KRAS 依赖的信号转导,抑制肿瘤细胞的增殖,并诱 导细胞凋亡。JAB-21822 可作为单药用于治疗带有 KRAS G12C 突变的非小细胞肺癌、胰 腺癌、结直肠癌等实体瘤,与 SHP2i、EGFRi、PD-1 单抗联合用药有望实现更优疗效,以 及克服继发性耐药。其中研发进度最快的管线为非小细胞肺癌单药疗法,关键性临床研 究已于 2023 年 9 月完成全部患者入组,并且在 2022 年 12 月获得 CDE 突破性治疗药物 认定。
加速布局多个适应症,研发进度全球领先。截止 2023 年 10 月,JAB-21822 已在中国、美国及 欧洲多国启动多项针对晚期实体瘤患者的 I/II 期临床试验。2022 年 9 月,JAB-21822 单药用于治 疗二线及以上带有 KRAS G12C 突变的晚期或转移性非小细胞肺癌患者的二期关键性临床试验获 得 CDE 批准并完成首例患者入组,同年 12 月被 CDE 授予突破性治疗药物认定,并于 2023 年 9 月完成患者入组。2023 年 7 月 4 日,JAB-21822 单药在中国获批开展胰腺癌关键临床研究,成 为全球首个获批开展胰腺癌关键临床研究的靶向 KRAS G12C 的项目,并于同年 8 月被 CDE 授予 突破性治疗药物认定,并于 2023 年 10 月 27 日完成胰腺癌注册性临床研究首例患者给药。2023 年 2 月,JAB-21822 与西妥昔单抗针对结直肠癌患者的 IIa 期联合临床试验患者入组完成,公司 预计注册性临床将于 2023H2 获批。
JAB-21822 单药研究进展顺利,治疗 NSCLC 表现优异。JAB-21822 在晚期实体瘤的 I//II 期首次人体实验分为剂量爬坡和后续临床试验两个阶段。在剂量爬坡阶段,公司分别进 行 QD、BID 及 TID 的剂量探索,共入组 50 例晚期实体瘤患者,通过安全性、药代动力学 和初步疗效确定 2 期推荐剂量(RP2D),药代动力学结果显示 JAB-21822 的吸收良好, 达到血药浓度峰值中位时间为 2h 并且平均半衰期为 4.99~5.54 小时,根据 E-R 分析的结 果,最终选择 QD 给药进行扩展实验。在后续临床试验阶段,JAB-21822 在 NSCLC 中进行充分的剂量-疗效对比,在 400mg QD 和 800mg QD 两个剂量组中分别入组 30、40 例 NSCLC 患者。结果显示 JAB-21822 具有良好的疗效与安全性,在 400mg QD 剂量组中, ORR 为 36.7%,其中 20%(6/30)患者的肿瘤缩小>50%,mPFS 为 5.6 月,≥3 级 TRAE 为 15.6%;在 800mg QD 剂量组中,ORR 为 42.5%,其中 32.5%(13/40)患者的肿瘤缩 小>50%,mPFS 为 9.6 月,≥3 级 TRAE 为 23%,未发生 5 级药物相关 AE,导致药物停用 比例为 3.3%,消化道毒性低。
JAB-21822 单药疗效突出,联用西妥昔单抗更胜一筹。JAB-21822 单药在晚期结直肠癌 中具有很好的抗肿瘤效果,目前已入组 35 例既往接受过至少一线标准治疗的 KRAS G12C 突变的 CRC 患者,接受 800mg QD JAB-21822 治疗后,ORR 为 33.3%(11/33),DCR 为 90.9%(30/33),mPFS 为 6.9 个月。作为国内首个与西妥昔单抗进行联合治疗的 KRAS G12C 抑制剂,截至 2023 年 5 月 23 日,共入组 47 例已接受标准治疗失败或不耐受的 KRAS G12C 突变的晚期结直肠癌患者(既往治疗需包括包括氟尿嘧啶、奥沙利铂和/或伊 立替康)。JAB-21822 与西妥昔单抗联用疗效显著,安全性良好,结果显示在 43 例可评 估的患者中,ORR 为 62.8%(27/43),DCR 为 93%(40/43),中位无进展生存期数据尚未 成熟;相关性不良事件(TARE)主要为 1-2 级,4.3%(2/47)的患者因出现 TRAE 而终止 治疗,4 名患者(8.5%)出现与治疗相关的严重不良反应。
2.3. KRAS 突变市场广阔,涵盖新发患者和 PD-1 耐药双领域
JAB-21822 治疗非小细胞肺癌疗效优于竞品。截至 2023 年 6 月,海外获批上市的 KRAS G12C 抑制剂产品仅有安进的 Sotorasib 和 Mirati 的 Adagasib。Sotorasib 的 III 期数据表明 其针对 2L NSCLC 的 ORR 和 DCR 分别为 28.1%和 82.5%,mPFS 为 5.6 个月;Adagasib 的 ORR 为 42.9%,mPFS 为 6.5 个月。益方生物 D-1553 的 1/2 期数据显示其在全部剂量组中 的 ORR 和 DCR 分别为 40.5%和 91.9%,mPFS 达 8.2 个月。信达生物 IB1351 的 I 期数据显 示全部剂量组中 ORR 和 DCR 为 61.2%和 92.5%。罗氏的 GDC-6036 的 I 期数据显示单药治 疗的 mPFS 为 13.1 个月。公司的 JAB-21822 的 I/II 期结果显示 400mg QD 剂量组中 ORR 和 DCR 达 36.7%和 90%,PFS 为 5.6 个月;800mg QD 剂量组中 ORR 和 DCR 高达 42.5%和 95%,PFS 为 9.6 个月,显示出优异的疗效。
JAB-21822 安全性良好,不良反应多数为 1-2 级。在公司于 ASCO 2022 公布的 JAB-21822 安全 性数据中,所有剂量分组中最常见的不良反应(频率≥10%)有血胆红素升高、贫血、丙氨酸、转 氨酶和天冬氨酸盐转氨酶增加和蛋白尿。不良反应多为 1-2 级,QD 队列与 BID 或 TID 队列相比 拥有较低的 3-4 级 TRAEs。相对于其他组,800mg 组和 400mg 组拥有较低≥3TRAE,400mg 组 ≥3 级 TRAE 为 15.6%,800mg 组≥3 级 TRAE 为 23%,未发生 5 级药物相关 AE,导致药物停用 比例为 3.3%,消化道毒性低。已上市 KRAS G12C 抑制剂中,Sotorasib 有 98%患者出现治疗相关 不良反应,72%出现 3 不良反应,7%出现 4 级不良反应,停药率为 10%;Adagrasib 治疗相关不 良反应发生率为 97.4%,其中 53%为 1 或 2 级,43%为 3 级或以上(含 2 例 5 级),停药率为 6.9%。
JAB-21822 联合疗法针对晚期结直肠癌进展迅速,联合用药数据疗效优越。目前全球范 围内针对结直肠(CRC)的 KRAS G12C 抑制剂产品主要有公司 JAB-21822 单药/联用、安 进 Sotorasib 单药/联用、益方生物 D-1553 单药、信达生物 IBI351。JAB-21822 正在中美 两国同步开展单药及联合用药临床研究,均处于临床 I/II 期,单药疗法结果显示,在 33 例可评估的患者中,ORR 为 33.3%,确认 ORR 为 30.3%,DCR 为 90.9%,mPFS 为 6.9 个月; 联合疗法结果显示,在 43 例可评估的患者中,ORR 为 62.8%,确认 ORR 为 51.2%,DCR 为 93%,中位无进展生存期数据尚未成熟。Sotorasib 的 II 期数据表明其 ORR 和 DCR 分别 为 9.7%和 82.3%,mPFS 为 4.0 个月;Adagasib 的 ORR 为 19%,DCR 为 86%,mPFS 为 5.6 个月;益方生物 D-1553 的 I/II 期数据显示其 ORR 和 DCR 分别为 20.8%和 95.8%,mPFS 为 7.62 个月;信达生物 IB1351 的 I 期数据显示全部剂量组中 ORR 和 DCR 为 47.5%和 85.00%。
JAB-21822 研发进度处于全球 KRAS G12C 抑制剂第一梯队。截止 2024 年 1 月,全球有多款在 研 KRAS 抑制剂,除已在海外上市的 Sotorasib 和 Adagrasib,益方生物 D-1553、信达生物 IBI351 处于申请上市阶段,公司 JAB-21822 处于注册性临床阶段。KRAS G12D 抑制剂、KRAS G12V 抑制剂在研药物相对较少,在研 KRAS G12D 抑制剂中,Mirati 公司 MRTX1133 和恒瑞医药 HRS-4642 进展相对较快,目前已进入临床试验阶段。公司管线布局覆盖多种 KRAS 抑制剂,包 括 KRAS G12C 抑制剂 JAB-21822,KRAS G12D 抑制剂 JAB-22000,KRAS G12V 抑制剂 JAB23000,以及口服泛 KRAS 抑制剂 JAB-23400,其中 KRAS G12C 抑制剂 JAB-21822 进展最快,处 于 II 期关键临床试验;泛 KRAS 抑制剂 JAB-23400 可同时抑制 KRAS 的活性及非活性状态,并对 HRAS、NRAS 具有选择性,公司预计将于 2024H1 年提交 IND 申请。
2.4. 格来雷塞全球销售收入测算
格来雷塞是加科思自主研发的 KRAS G12C 变构抑制剂,初步临床效果积极,是潜在的同 类最佳分子之一。格来雷塞可作为单药用于治疗带有 KRAS G12C 突变的非小细胞肺癌、 胰腺癌、结直肠癌等实体瘤,与 SHP2i、EGFRi、PD-1 单抗联合用药,有望实现更优疗效, 以及克服继发性耐药,首个进入注册性临床的适应症为 NSCLC 的单药治疗。我们预计格 来雷塞于中国上市后前三年即 2025-2027 收入 5.94 亿元/7.02 亿元/11.38 亿元,于海外地 区上市后前三年即 2027-2029 收入 1.72 亿元/3.43 亿元/5.98 亿元,我们预计 2025-2027 格来雷塞全球市场收入 5.94 亿元/7.02 亿元/13.11 亿元。
NSCLC 适应症关键假设: (1)NSCLC 患者人数:根据弗若斯特沙利文预测中国 NSCLC 患者人数于 2019 年达到 76.1 万人,将于 2024 年达到 88.4 万人,2019-2024 年 CAGR 为 3.05%,2030 年达到104.2 万人,2024-2030CAGR 为 2.77%。其中约 55%的患者初诊时为晚期,KRAS G12C 突 变占 NSCLC 患者比例约为 11%。 (2)上市时间:格来雷塞针对非小细胞癌的 II 期关键性临床试验已于 2022 年 9 月在中 国获批并启动,并于 2023 年 9 月完成全部患者入组,针对非小细胞癌症单药疗法计划于 2024H1 提交 NDA,一般上市审批需要半年到两年左右时间,我们预计格来雷塞针对 NSCLC 适应症的上市申请将于 2025 年获批。 (3)市占率:目前国外已上市两款 KRAS G12C 抑制剂,分别为安进的 Sotorasib 和 Mirati Therapeutics 的 Adagrasib。国内尚无 KRAS G12C 抑制剂上市,包括公司格来雷塞 在内的多款 KRAS 抑制剂正处于临床试验状态,公司格来雷塞有望凭借良好的疗效和安全 性成为 KRAS G12C 抑制剂领域的有力竞争者,我们预计国内市占率峰值有望达到 20%。 (4)治疗费用:目前已上市的 Adagrasib 美国售价为 13.5 万元/月,Sotorasib 美国售价 为 14.5 万元/月,假设格来雷塞中国首次上市价格为 60 万元/年(5 万元/月),预计 2025 年能够参与医保谈判,2026 年医保谈判结果执行后开始降价,进入医保后价格下降为 25 万元/每年,并逐年小幅下降。
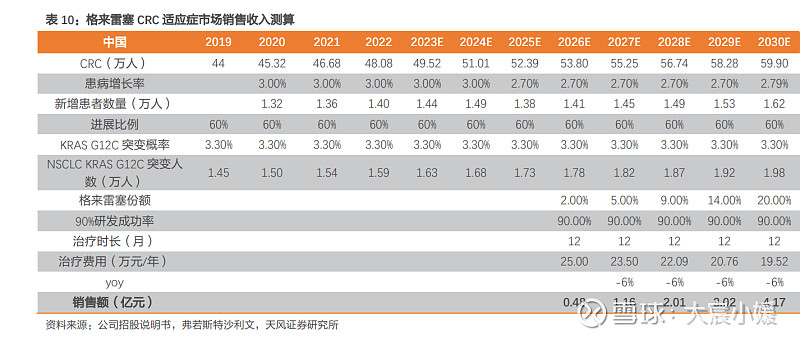
CRC 适应症关键假设: (1)CRC 患者人数:根据弗若斯特沙利文预测中国 CRC 患者人数于 2019 年达到 44 万 人,将于 2024 年达到 51 万人,2019-2024 年 CAGR 为 3.00%,2030 年达到 59.90 万人, 2024-2030CAGR 为 2.71%。其中晚期 CRC 患者比例约为 60%,KRAS G12C 突变占 CRC 患 者比例约为 3.30%。 (2)上市时间:2023 年 2 月,JAB-21822 与西妥昔单抗针对结直肠癌患者的 IIa 期联合 临床试验患者入组完成,注册性临床将于 2023H2 获批。根据研发进度,注册性临床需要 2-3 年时间,我们预计格来雷塞针对 CRC 适应症的中国上市申请将于 2026 年获批,全球 其他地区上市申请将于 2027 年获批。 (3)市占率:目前国外已上市两款 KRAS G12C 抑制剂,分别为安进的 Sotorasib 和 Mirati Therapeutics 的 Adagrasib。国内尚无 KRAS G12C 抑制剂上市,包括公司格来雷塞 在内的多款 KRAS 抑制剂正处于临床试验状态,公司格来雷塞有望凭借良好的疗效和安全 性成为 KRAS G12C 抑制剂领域的有力竞争者,我们预计国内市占率峰值有望达到 20%。 (4)治疗费用:目前已上市的 Adagrasib 美国售价为 13.5 万元/月,Sotorasib 美国售价 为 14.5 万元/月,假设格来雷塞中国首次上市价格 60 万元/年,2026 年进入医保后价格下降为 25 万元/每年,并逐年小幅下降。
PDAC 适应症关键假设: (1)PDAC 患者人数:根据弗若斯特沙利文预测中国 PDAC 患者人数于 2019 年达到 10.8 万人,将于 2024 年达到 12.7 万人,2019-2024 年 CAGR 为 3.29%,2030 年达到 15.2 万 人,2024-2030CAGR 为 3.04%;全球其他地区 PDAC 患者人数于 2019 年达到 36.4 万人, 将于 2024 年达到 41.5 万人,2019-2024 年 CAGR 为 2.66%,2030 年达到 48.7 万人, 2024-2030CAGR 为 2.70%。其中约 80%的患者初诊时为中晚期,KRAS G12C 突变占 PDAC 患者比例约为 1.90%。 (2)上市时间:2023 年 7 月,格来雷塞在中国获批开展单药治疗胰腺癌的注册性临床, 并于 2023 年 9 月启动,成为全球首个获批开展的靶向 KRAS G12C 治疗 PDAC 的注册性 临床。我们预计格来雷塞针对 NSCLC 适应症的上市申请将于 2026 年获批。 (3)市占率:目前国外已上市两款 KRAS G12C 抑制剂,分别为安进的 Sotorasib 和 Mirati Therapeutics 的 Adagrasib。国内尚无 KRAS G12C 抑制剂上市,包括公司格来雷塞 在内的多款 KRAS 抑制剂正处于临床试验状态,公司格来雷塞有望凭借良好的疗效和安全 性成为 KRAS G12C 抑制剂领域的有力竞争者,我们预计国内市占率峰值有望达到 30%, 海外市占率峰值有望达到 10%。 (4)治疗费用:目前已上市的 Adagrasib 美国售价为 13.5 万元/月,Sotorasib 美国售价 为 14.5 万元/月,假设格来雷塞中国首次上市价格 60 万元/年,2026 年进入医保后价格 下降为 25 万元/每年,并逐年小幅下降;国外其他地区售价为 20 万美金/年(140 万元/ 年),并逐年小幅下降。
3. JAB-3312:SHP2 抑制剂临床进度跻身全球第一梯队
JAB-3312 是目前唯一的第二代 SHP2 抑制剂。公司自主研发的 JAB-3312 是全球第二个 获得美国 FDA 批准进入临床开发的 SHP2 变构位点抑制剂,活性比第一代分子强 20 倍, 并已获得美国 FDA 用于食道癌(包括食管鳞癌)治疗的孤儿药认定。截至 2023 年 6 月, JAB-3312 的单药临床试验已确定 MTD 及 II 期临床 RP2D,JAB-3312 与 KRAS G12C 抑制 剂联用的临床试验已进入 IIa 期,与 PD1、EGFR 抑制剂的联用 I/IIa 期临床试验仍在进行 中。公司的第二代抑制剂 JAB-3312 与 RevMed、诺华等公司的第一代抑制剂相比,用药 剂量更小,并且可以采用非间歇性给药模式,具备提升药效和降低毒性等优势,具备更 高成药性的可能,有望在同类竞争产品中脱颖而出。
3.1. 传统 SHP2 催化抑制剂不可成药,变构抑制剂突破技术瓶颈
SHP2 是一类具有突出致癌功能的非受体蛋白酪氨酸磷酸酶。含 Src 同源 2 结构域蛋白酪 氨酸磷酸酶 2(SHP2)是一类由原癌基因 PTPN11 编码的非受体蛋白酪氨酸磷酸酶,属 于蛋白酪氨酸磷酸酶(PTP)家族。SHP2 由 593 个氨基酸残基组成,结构相对保守,其 N 端由两个 SH2 结构域(N-SH2 和 C-SH2)和一个具有催化活性的 PTP 结构域组成,C 端包含两个 p-Tyr 位点(Y542 和 Y580)和一个富含脯氨酸的基序。SHP2 在调节生长因 子、激素、细胞因子和细胞粘附分子的生物反应中至关重要,是控制发育过程和造血功 能的信号转导途径的关键组成部分,在多种不同的组织类型中表达,包括大脑、脂肪、 甲状腺、心脏、肾上腺、肾脏和子宫内膜等。
SHP2 在 RAS 信号通路中具有中心节点作用,有助于克服旁路耐药性。SHP2 在人体内广 泛表达,是受体酪氨酸激酶(RTK)信号通路的下游效应分子,通过活化各种细胞因子和 生长因子受体调控 RAS-MAPK,PI3K-AKT,JAK-STAT 等信号通路,参与细胞增殖、分化、 迁移和代谢。此外,SHP2 还是程序性细胞死亡 1(PD-1)和 T/B 淋巴细胞衰减免疫检查 点通路的重要中介。RTK 过度激活将直接导致下游多条信号通路过强,驱动癌症发生发展, 而 SHP2 是连接 RTK 和下游多条信号通路的关键节点,是致癌途径的必经之处,抑制 SHP2 可产生明显的抗肿瘤效果。SHP2 抑制剂与靶向 RTK(如 EGFR 和 ALK)和 RAS 信号 通路下游节点的各种疗法联用能提高肿瘤对靶向治疗的敏感性,有助于克服肿瘤细胞的 旁路耐药性。
SHP2 处于动态平衡状态,基因突变后增强活性。研究发现 SHP2 既可以作为磷酸酶发挥 显著的致癌功能,也可以以环境依赖的方式作为肿瘤抑制因子。在非活性状态下,SHP2 蛋白的 PTP 域和 N-SH2 结构域之间相互作用,抑制 SHP2 蛋白的活性,限制底物进入催 化位点。在生长因子或细胞因子的刺激下,SHP2 通过其 SH2 结构域与磷酸酪氨酸位点结 合而被招募,使 SHP2 发生构象变化暴露出催化位点,从而实现对 SHP2 的准确催化活化, 进而激活下游信号通路。N-SH2 结构域是 SHP2 的变构调节剂,并在其激活中起核心作 用,通常野生型 SHP2 在非活性构象和活性构象之间维持动态平衡。然而 PTPN11 基因的 突变打破了这种平衡,并影响 SHP2 磷酸酶的活性。PTPN11 基因可发生两种形式的突变: 功能获得(GOF)和功能丧失(LOF)突变。GOF 突变通过减少 N-SH2 和 PTP 结构域之 间的相互作用来增加 SHP2 的磷酸酶活性,并促进野生型 SHP2 中催化口袋的底物结合能力,激活下游通路后导致实体瘤、白血病等病症发生。目前 SHP2 的激活突变已在 Noonan 综合征及多种实体肿瘤中被发现,包括白血病、肺癌、乳腺癌以及神经母细胞瘤 等。
聚焦 SHP2 变构位点,突破传统位点不可成药瓶颈。SHP2 抑制剂的早期研究主要集中于 活性位点,但靶向催化位点高度保守,导致催化位点抑制剂在高同源性的 SHP1、SHP2、 PTP1B 中缺乏选择性,而且结构中大多含有模拟磷酸化底物与催化中心相互作用的极性 和离子功能基团存在,导致催化位点抑制剂的细胞渗透性和生物利用度较差,SHP2 靶点 被认为是不可成药靶点。2016 年诺华在《Natrue》上首次公布其研发的 SHP2 变构抑制 剂 SHP099,其以一种全新的变构抑制机制使 SHP2 蛋白稳定于自抑制构象,通过与 SHP2 变构口袋相互作用来稳定或抑制酶构象的变化,使活性中心不能与底物结合而发挥功能, 由此开启了 SHP2 抑制剂研究的新里程。相比于催化位点抑制剂,变构抑制剂不仅具有良 好的 SHP2 抑制活性和选择性,成药性好、可口服利用等优点还弥补了催化位点抑制剂的 不足。
全球唯一第二代 SHP2 抑制剂,抗肿瘤效果显著。JAB-3312 是加科思自主设计开发的高 活性 SHP2 磷酸酶变构抑制剂,通过在 RTK/RAS/MAPK 信号通路阻断通路激活,抑制 RTK 驱动或 KRAS、BRAF Class 3、NF1 功能缺失突变的肿瘤细胞的生长和增殖,同时该抑制 剂还可以在 PD-1 通路发挥抑制作用,增强 CD8+T 细胞杀伤功能,并通过抑制肿瘤相关 巨噬细胞功能来解除肿瘤微环境中的免疫抑制。目前在研的 SHP2 小分子变构抑制剂的二 维结构可分为 2 类:疏水区 A、中心区 B 和极性区 C(I 式),以及在 A、B 之间增加连接 原子 L(II 式)。根据加科思公开发表的 3 篇专利研发的代表化合物与诺华 SHP099 的对比 显示,加科思公司活性最好的化合物 21 是将极性区 C 从 SHP099 的氨基取代的哌啶环, 优化为 TNO-155 的二元螺环,进一步扩增为三元螺环,增加 C 部分的分子柔性和疏水体 积,有效增强定位效应;引入具有芳香性的吡啶结构与 His114 形成 π-π 相互作用,以提 高其活性。据医药魔方公众号,与第一代 SHP2 抑制剂相比,第二代 SHP2 抑制剂 JAB3312 活性得到极大提高,也实现了更长时间的连续给药。
3.2. JAB-3312 疗效同类最优,全球临床研究进程领先
JAB-3312 正在国内外开展多项单药以及联用药物临床实验。截止 2023 年 6 月,加科思 JAB-3312 正开展 4 项药物联用试验。1)单药疗法试验:已确认 MTD 和 RP2D,于美国及 中国开展的 I/IIa 期临床试验已停止招募患者。2)联合用药实验:与 JAB-21822 联用的 I/IIa 期临床试验正在中国入组,目前已入组超过 100 例患者,初步临床数据已于 2023 年 10 月在 ESMO 大会上口头报告;与 sotorasib 联合用药临床 IIa 期剂量扩展试验正在欧洲 和美国进行;与奥希替尼、帕博利珠单抗联合用药临床 II 期正在进行中,已在特定的肿 瘤类型中观察到疗效信号。
SHP2 和 KRAS 联用有望克服 KRAS G12C 耐药。KRAS G12C 变构抑制剂对包括 NSCLC 在 内的 KRAS G12C 突变癌症具有疗效,然而在治疗不久后 MAPK 通路会通过多种生长受体 (RTKs)发生适应性再激活,这是 KRAS G12C 变构抑制剂产生旁路耐药性的主要机制。 SHP2 靶点是介导多条 RTK 信号传导到 RAS 的关键磷酸酶,SHP2 抑制剂可以阻断所有应 用 KRAS G12C 抑制剂产生耐药模型中的 RAS 通路的负反馈激活,同时可以阻断 PD-1 抑 制信号,增强 CD8+T 细胞杀伤功能,并通过抑制肿瘤相关巨噬细胞功能来解除肿瘤微环 境中的免疫抑制,发挥抗肿瘤作用。SHP2 抑制剂(JAB-3312)联合 KRAS G12C 抑制剂 (JAB-21822)从机制上增强对 RAS 通路的持续抑制,从而增强体内外抗肿瘤活性,SHP2 和 KRAS G12C 联用有望成为突破 KRAS G12C 抑制剂适应性耐药靶点。
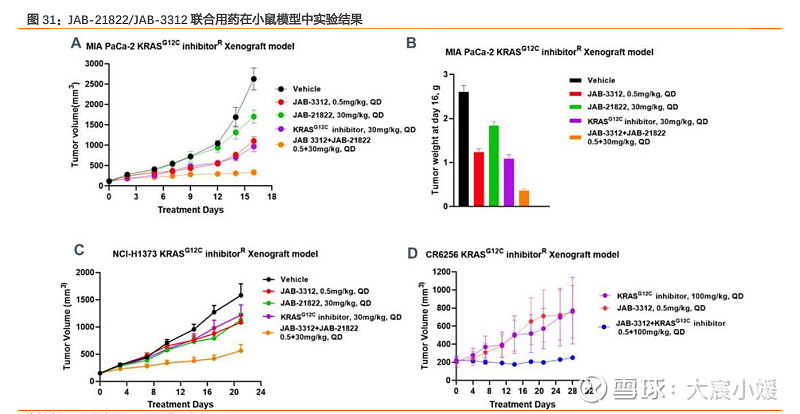
JAB-3312/JAB-21822 在动物模型中的联用效果优于同类竞品。公司在 ESMO ASIA 2022 年公布 JAB-21822 与 JAB-3312 联合用药的临床前研究成果。该研究使用三种动物模型: MIA PaCa-2 胰腺癌细胞系异种移植小鼠模型(CDX)、NCI-H1373 肺癌移植模型和 CR6256 肺癌人源性组织异种移植模型(PDX)。在 MIA PaCa-2 小鼠模型中,截至到实验 结束的第 16 天,JAB-3312/JAB-21822 联用组的肿瘤体积远低于二者单独给药组,也远 低于作为对照的竞品 KRAS G12C 抑制剂。在 NCI-H1373 模型的实验得到类似的结果, JAB-3312/JAB-21822 联用组的疗效依然优于其它组。在 CR6256 肺癌小鼠模型的实验结 果显示,竞品 KRAS G12C 抑制剂对肿瘤的抑制效果不佳,肿瘤在实验第 63 天恢复生长; 但是联合该 KRAS G12C 抑制剂和 JAB-3312 可显著抑制肿瘤生长。
二代 JAB-3312 靶点选择性高,SHP2 抑制活性显著。根据药理学研究数据显示,JAB3312 在体外 SHP2 酶活性检测中具有更强的抑制能力。JAB-3312 抑制 SHP2 所需的半数 抑制浓度 IC50仅为 1.49nM,显著低于 Revolutiona RMC-4550 所需的 10.4nM。在实际的 细胞信号通路试验中(ERK 磷酸化的抑制水平测定),在依赖 SHP2 的 KRAS G12C 突变肺 癌细胞(NCI-H358)和依赖 SHP2 的 EGFR 扩增食道癌细胞(KYSE-520)中,JAB-3312 对 ERK 磷酸化的抑制作用均呈浓度依赖性。JAB-3312 抑制 ERK 磷酸化的 IC50分別为 3.64nM 和 0.32nM,低于 RMC-4550 抑制 ERK 磷酸化所需的 IC50 28nM 和 9.1nM。