
2023年3月3日/医麦客新闻 eMedClub News/--近日,REGENXBIO宣布了一项关于AAV基因疗法RGX-111在I/II期临床试验的中期积极数据。该药物主要用于治疗严重I型黏多糖贮积症(MPS I),目前已获得美国FDA的孤儿药资格认定、儿科罕见病资格认定和快速通道资格。
I型黏多糖贮积症(MPS I)是一种罕见的常染色体隐性遗传病,由机体缺乏α-L-艾杜糖醛酸酶(IDUA)引起,最终会导致中枢神经系统(CNS)损伤、脊髓压缩以及认知缺陷等症状。目前,针对该疾病的标准治疗方式包括酶替代疗法和造血干细胞移植(HSCT)疗法,但前者需终身治疗以缓解疾病进展,且不能治疗MPS I患者的CNS症状,HSCT则在临床上存在诸多高风险和副作用。因此目前的护理治疗标准对于在中枢神经系统中安全实现长期IDUA重建有很大的未满足需求。
RGX-111旨在使用AAV9载体将编码IDUA酶的基因传递至中枢神经系统 (CNS),为机体分泌IDUA酶提供永久性来源,以“一次性治愈”MPS I。该AAV基因疗法还可为大脑快速递送IDUA基因,潜在地防止MPS I患者认知缺陷发展。
RGX-111的I/II期临床试验是一项多中心、开放标签、剂量递增研究,该试验将患者分为两个剂量队列:1.0x1010 GC/ g of brain mass和5.0x1010 GC/g of brain mass,直接注射到患者脑脊液(CSF)。其主要终点是评估RGX-111的安全性,次要终点包括RGX-111对脑脊液、血清和尿液中IDUA酶活性生物标志物的影响、神经认知发展和其他测量结果。
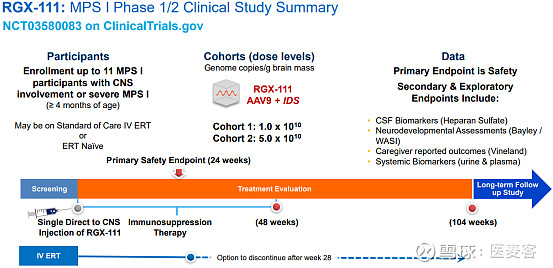
▲ RGX-111在MPS I患者中进行的I/II期临床试验设计(图片来源:REGENXBIO官网)
最新的研究数据显示,RGX-111在参加I/II期临床试验的八名患者中耐受性良好,没有药物相关的严重不良事件(SAEs)。一次性给予RGX-111后,患者在脑脊液、血清和尿液中的IDUA生物标志物活性均为阳性,且表现出神经发育的持续性改善,可见RGX-111显著的临床活性。

AAV基因疗法多领域齐头并进
REGENXBIO是一家领先的临床阶段生物技术公司,致力于AAV基因疗法的开发和商业化。REGENXBIO的NAV技术平台是一种专有的腺相关病毒(AAV)基因递送平台,由100多种新型AAV载体的独家权利组成,包括AAV7、AAV8、AAV9和AAVrh10。目前,REGENXBIO市值9亿美元左右,2021年营收4.7亿美元,净利润1.28亿美元,研发费用支出1.8亿美元。
REGENXBIO及其NAV技术平台正通过授权许可的方式被用于开发多个治疗领域的广泛候选产品线。
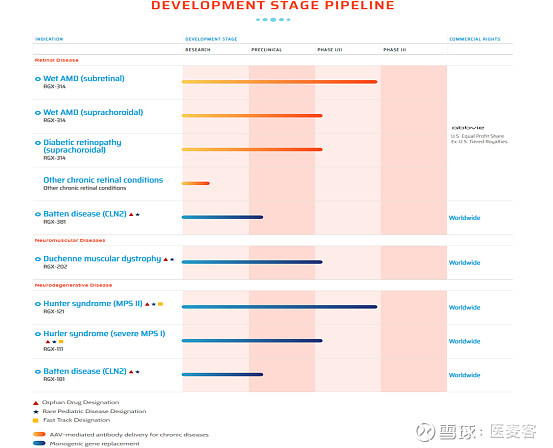 ▲ 技术管线(图片来源:REGENXBIO官网)
▲ 技术管线(图片来源:REGENXBIO官网)
RGX-314 是一款治疗湿性AMD、糖尿病视网膜病变(DR)以及其他慢性视网膜病变的基因治疗药物,其通过AAV8载体将编码可以中和VEGF活性的抗体Fab片段的基因送入细胞。最新报道显示,RGX-314治疗湿性AMD的II期桥接试验结果积极,未来将有效地从临床试验过渡到商业准备阶段。
RGX-121是用于治疗II型粘多糖贮积症(MPS II)的候选产品,旨在使用AAV9载体将人iduronate-2-sulfatase(IDS)基因传递到中枢神经系统(CNS)。目前,RGX-121用于治疗19岁以下MPS II患者的1/2/3期试验数据积极,且有报道显示RGX-121使患者持续获益已达三年,REGENXBIO计划于明年递交上市申请。
RGX-181是用于治疗婴儿晚期神经元类脑膜脂肪褐变性2型(CLN2病)的候选产品,旨在使用AAV9载体将三肽基肽酶1(TPP1)基因直接传递至中枢神经系统(CNS)。2022年,RGX-181完成了对CLN2患者的首次人体给药,结果显示其耐受性良好,没有出现与药物相关的严重不良事件。
RGX-381是用于治疗CLN2眼部疾病的候选产品。与RGX-181不同,RGX-381旨在使用AAV9载体将TPP1基因直接传递到视网膜,以针对CLN2患者的眼部问题。目前,英国卫生局已接受RGX-381的临床试验申请(CTA),并将于2023年上半年启动I/II期临床试验。
RGX-202是一种利用新型微肌营养不良蛋白构建体治疗杜氏肌营养不良症(DMD)的潜在性基因疗法。RGX-202利用AAV8载体和表征良好的肌肉特异性启动子(Spc5-12)支持整个骨骼肌和心肌中基因的递送和靶向表达。2022年1月,GRX-202的新药临床试验(IND)申请获美国FDA批准。

国内AAV基因疗法
治疗罕见病进展
目前,基因疗法已经被广泛应用于治疗基因罕见病,且随着基因编辑技术的不断升级和递送方式的不断优化,全球基因治疗市场规模将进一步扩大。国内诸多企业布局这一赛道并取得了一定进展,AAV基因疗法也成为2022-2023年间国内管线步入临床的基因治疗企业最多的细分领域。以下是对国内AAV基因疗法在罕见病领域的临床获批(IND)情况进行汇总:
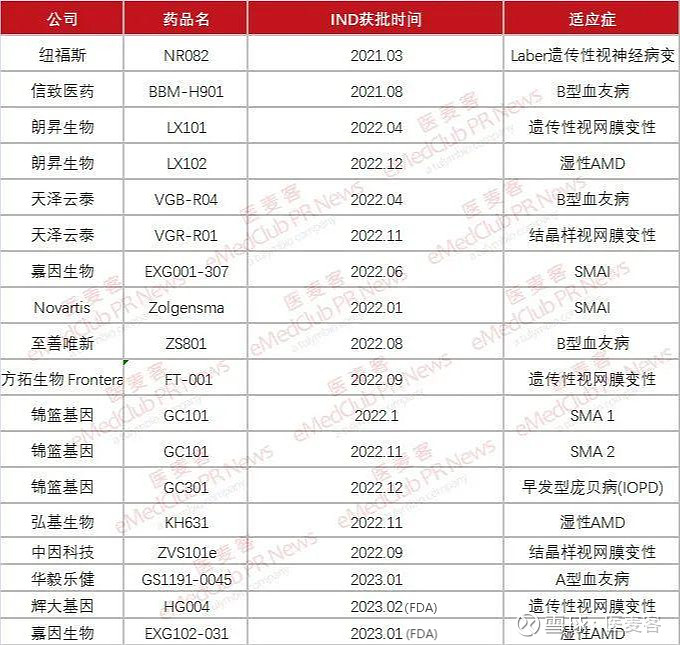 ▲国内AAV疗法在罕见病领域获批IND情况
▲国内AAV疗法在罕见病领域获批IND情况

结语
如今,基因治疗的进步为许多罕见病的治疗提供了新的思路,让无数患者看到了希望。随着AAV产品平台技术的不断发展,医药研发者也在不断追求AAV基因疗法的安全性和有效性,以提供给患者更优质的治疗方案。虽然我国基因治疗领域还处于发展早期,但近年来行业发展迅速,越来越多的基因治疗产品已获批IND,相信在不久的将来,我们将获得更为显著的突破性成果。也期待随着研究的深入,AAV基因疗法的应用范围能够得到进一步扩展,以造福更多患者。
参考资料:
1.网页链接
声明及版权说明
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。
版权说明:本文来自医麦客内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,转载授权请在文章下方留言获取。
——近期热门活动一览——
3月7日,AAV载体生产工艺优化要点与质控策略