郑薇团队(潘海洋/李扬/李沙/赵楠/赵雅韵/杨烨辉)
联系人:郑薇/潘海洋

投资摘要
医药生物同比上涨1.29%,整体表现强于大盘
本周上证综指上涨0.2%,报2964.18点,中小板上涨1.47%,报6309.01点,创业板上涨1.44%,报1711.22点。医药生物同比上升1.49%,报8114.34点,表现强于上证1.29个pp,强于中小板0.03个pp,强于创业板0.06个pp。全部A股估值为12.93倍,医药生物估值为36.2倍,对全部A股溢价率为180.91%。
行业一周总结:CDE密集发布加速临床急需药品上市销售等系列文件
行业方面,国家卫生健康委组织制定了《综合医院风湿免疫科建设与管理指南(试行)》,要求具备条件的综合医院,加强对风湿免疫科的建设和管理,不断提高风湿免疫疾病诊疗水平。11月8日,国家药监局药品审评中心发布关于再次公开征求《临床急需药品附条件批准上市技术指导原则》意见的通知,该指导意见稿中明确适用范围为“未在中国境内上市销售,但临床急需的中药、化学药和生物制品。”同时CDE发布多文,公开征求《药物临床试验登记与信息公示管理制度》和《研发期间安全性更新报告要求及管理规定》意见,《已上市中药药学变更研究技术指导原则》、《生物制品上市后药学变更研究技术指导原则》、《已上市化学药品药学变更研究技术指导原则》、《已上市药品临床变更技术指导原则》意见等。同时,为配合新修订《药品注册管理办法》的贯彻实施,国家药监局药品审评中心组织起草了《突破性治疗药物工作程序》和《优先审评审批工作程序》。此外,11月8日国家药典委员会发布《关于中药配方颗粒品种试点统一标准的公示》,按照国家药品监督管理局统一部署要求,根据国家药品标准工作程序,组织相关企业开展中药配方颗粒品种试点统一标准研究,并组织专家开展标准审评工作。
下周行业观点预判:坚守创新龙头,持续把握血制品等消费领域投资机会
我们认为医药行情仍有望持续,从医药企业三季报来看,整体板块三季报表现较好。结合近期医药政策,我们建议投资者关注创新药及其产业链,创新医疗器械龙头,景气度正在回升的血制品领域,中药消费龙头及配方颗粒主题投资机会。相关标的包括:
(1)创新药及其产业链(恒瑞医药、贝达药业、药明康德、泰格医药、康龙化成等);
(2)创新医疗器械(迈瑞医疗、迈克生物、安图生物、艾德生物、乐普医疗、健帆生物等);
(3)血制品领域(华兰生物、博雅生物、天坛生物等);生长激素(长春高新、安科生物);
(4)中药消费龙头及配方颗粒(中药:片仔癀、云南白药、同仁堂;配方颗粒:中国中药、华润三九、红日药业、以岭药业、天士力)。
11月金股:迈瑞医疗(300760.SZ)
核心逻辑:医疗器械子行业众多,不同细分领域产品在技术、工艺、渠道都有很大的差异,行业技术隔绝,跨产品线难度较大,而迈瑞则做到了多产品线均衡同步发展。迈瑞三条基石产品线分别是生命信息与支持,医学影像、体外诊断,其中多个细分品种市占率已经成为国内前列,产品的品牌影响力被医疗圈广泛认可。我们预测公司2019-2021年净利润为46.59/57.56/69.50亿元,对应EPS为3.83/4.73/5.72元/股,2020年给予50X估值,目标价至236.5元/股,维持“买入”评级。
稳健组合(排名不分先后,滚动调整)
健康元,迈克生物,安图生物,万孚生物,迈瑞医疗,金域医学,恒瑞医药,片仔癀,通化东宝,爱尔眼科,美年健康,泰格医药,药明康德,云南白药,长春高新,凯莱英,科伦药业,乐普医疗
风险提示:市场震荡风险,研发进展不及预期,个别公司外延整合不及预期,个别公司业绩不达预期、生产经营质量规范性风险
目录

正文
1. 坚守创新龙头,持续把握血制品等消费领域投资机会
我们认为医药行情仍有望持续,从医药企业三季报来看,整体板块三季报表现较好。结合近期医药政策,我们建议投资者关注创新药及其产业链,创新医疗器械龙头,景气度正在回升的血制品领域,中药消费龙头及配方颗粒主题投资机会。相关标的包括:
(1)创新药及其产业链(恒瑞医药、贝达药业、药明康德、泰格医药、康龙化成等);
(2)创新医疗器械(迈瑞医疗、迈克生物、安图生物、艾德生物、乐普医疗、健帆生物等);
(3)血制品领域(华兰生物、博雅生物、天坛生物等);生长激素(长春高新、安科生物);
(4)中药消费龙头及配方颗粒(中药:片仔癀、云南白药、同仁堂;配方颗粒:中国中药、华润三九、红日药业、以岭药业、天士力)。
1.1. 创新药及其产业链维持高景气度
11月8日,国家药监局药品审评中心发布关于再次公开征求《临床急需药品附条件批准上市技术指导原则》意见的通知,该指导意见稿中明确适用范围为“未在中国境内上市销售,但临床急需的中药、化学药和生物制品。”同时CDE发布多文,公开征求《药物临床试验登记与信息公示管理制度》和《研发期间安全性更新报告要求及管理规定》意见,《已上市中药药学变更研究技术指导原则》、《生物制品上市后药学变更研究技术指导原则》、《已上市化学药品药学变更研究技术指导原则》、《已上市药品临床变更技术指导原则》意见等。同时,为配合新修订《药品注册管理办法》的贯彻实施,国家药监局药品审评中心组织起草了《突破性治疗药物工作程序》和《优先审评审批工作程序》,相关政策文件再次指向创新药及其产业链。
随着国内药政改革的落地,新药审评审批的提速,创新药的供给明显增加;而医保支付端的优化使得创新药上市后的放量速度较过去明显加快,创新药领域未来料将持续受益。建议投资者关注即将到来的国家医保谈判。
从业绩角度,国内以恒瑞医药为代表的一批创新药企业已开始步入收获期,未来业绩有望持续跑赢行业整体。以龙头恒瑞医药为例,公司2018年包括硫培非格司亭(19K)、吡咯替尼、白蛋白紫杉醇等多款重磅创新药或高端仿制药迎来集中获批上市,超重磅产品PD-1已经获批上市。短期来看,公司创新药业绩有望迎来高速增长期;长期来看,公司研发管线储备众多潜力品种,靶点布局全面,研发进度国内领先,长期业绩有望持续稳定增长,建议投资者长期持续关注。此外,建议投资者关注贝达药业,公司核心产品埃克替尼高增长仍有望持续,后续产品恩沙替尼有望年底左右获批,帕妥木单抗、CM082、贝伐单抗类似物等有望陆续获批,贡献新的业绩增量。

三季报外包型行业业绩总体继续保持高速增长,在行业政策+科创板影响下,外包行业有望显著受益,相关CRO、CMO/CDMO企业值得重点关注。政策上,顶层设计鼓励创新和高端仿制,产业加大研发创新的投入,为外包型行业带来了良好的发展机遇;“4+7”带量采购政策后促使医药回归各自分工,专业化的外包型企业凭借其成本优势有望承接更多外包订单;国内审评审批改革推进释放红利,药品上市许可持有人(MAH)制度的推出有望助推CMO/CDMO行业的发展。科创板的推出将为研发驱动型生物科技类公司创造良好的借助资本发展的条件,而生物科技型公司由于资本实力及分散风险的考虑,研发及固定资产投入更多的倾向于外包,有助于推动CRO业务的订单及投资收益,我们认为与生物科技类公司深度绑定的外包型行业有望显著受益。
1.2. 创新医疗器械处于黄金发展周期
根据器械企业的三季报业绩,建议关注创新医疗器械标的,医疗器械标的业绩增长较为稳健,成长性高,受政策压力较小,业绩有望延续半年报势头。经过梳理,我们认为有两种类型公司值得重点关注:
1、所属存量巨大市场,以进口替代和分级诊疗拉动的基层需求释放为核心逻辑,且具备产业升级能力的优质企业,例如迈瑞医疗、迈克生物、安图生物等。
2、所属新兴高景气度行业,具备良好的市场前景,竞争格局良好,具有溢价能力的细分龙头型企业,中报的业绩高增长进一步验证公司逻辑,例如艾德生物、健帆生物、欧普康视、金域医学等。

1.3. 血制品板块处于底部,批签发边际改善明显
血制品行业具有强监管的特点,2019年初上海新兴静丙事件引起全国对于血制品安全的关注,我们预期监管可能持续加强,行业具有更高的壁垒。年度批签发数据表明批签发逐渐向头部企业集中,强监管下头部企业有望受益。
从2019Q3批签发量上来看,血制品批签发整体明显好转,行业景气度有望回升。具体品种中:白蛋白:在2019Q1批签发见底后快速提升至Q3的近1500万件;免疫球蛋白:大品种:狂免批签发季度间提升明显,静丙批签发一二季度持平,三季度大幅提升;其他品种:破免Q3批签发大幅提升,乙免波动较大;冻干静注乙免、静注乙免批签发季度间呈上升趋势。因子类:三大品种(凝血酶原复合物、因子Ⅷ、纤原)Q3批签发均明显改善。

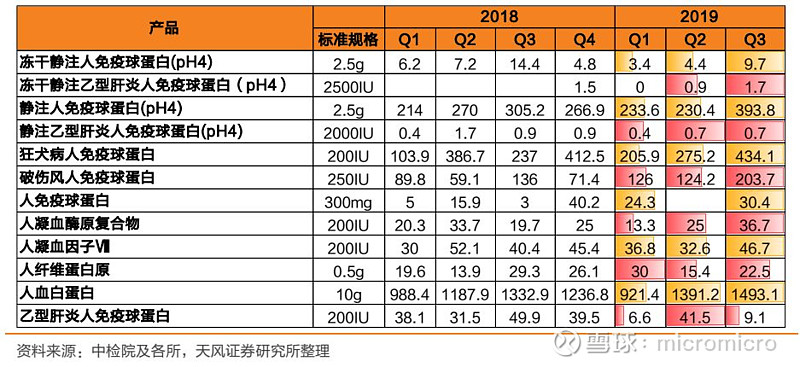
根据三季度批签发数据在同比和环比上的明显回升,以及上市公司半年报应收账款周转天数等的变化,我们判断行业的库存消化已接近完成,行业景气度持续回升,未来企业要持续进行渠道建设、营销和学术推广,进而拉动终端纯销需求的增长。头部企业Q3批签发环比大幅提升,建议关注产品齐全、学术推广强、渠道能力优秀的血制品企业,建议关注天坛生物、华兰生物、博雅生物、振兴生化。
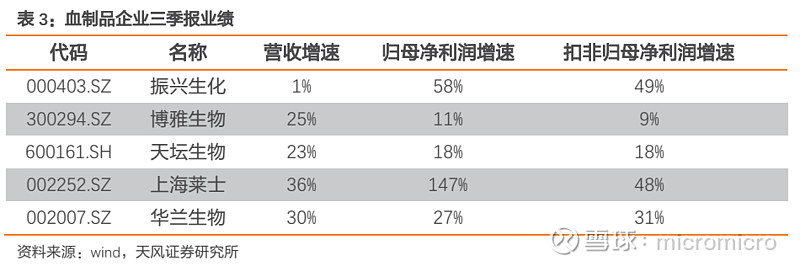
此外,我们建议关注具有消费属性的药品,其具备穿越政策周期的能力,一些不受医保控费影响的相关企业,其三季报业绩同样延续较高增长,建议关注:长春高新、安科生物。
长春高新业绩2019年前三季度营收54.44亿元,同比高速增长31.50%,实现归母净利润12.41亿元,同比增长47.93%,扣非后归母净利润12.32亿元,同比增长50.60%。整体业绩超市场预期,其中第三季度营收20.52亿元,同比增长47.59%,实现归母净利润5.14亿元,同比增长76.82%。公司运营状况良好,前三季度经营活动产生的现金流量净额为15.76亿元,同比增长423.67%。核心子公司金赛拥有长效-水针-粉针的多层次产品搭配,市场优势明显,同时不断加大营销力度,加强产品覆盖率,龙头优势持续巩固。
安科生物2019年前三季度营收11.63亿元,同比增长14.24%,实现归母净利润2.57亿元,同比增长10.95%,扣非后归母净利润2.48亿元,同比增长11.83%。其中第三季度营收4.0亿元,同比增长2.27%,实现归母净利润1.1亿元,同比增长8.12%。预计生长激素实现了快速的增长。
1.4. 关注中药消费龙头及配方颗粒主题投资机会
为了指导和规范已上市中药药学变更研究和管理,CDE依据新版《药品管理法》,参考国内已有相关指导原则和国外先进药品监管机构的相关指导原则,结合国内研发与生产现状,起草了《已上市中药药学变更研究技术指导原则》(征求意见稿),标准的提高将有助于产业健康发展。实际上在10月27日,中国政府网已发布《国务院关于促进中医药传承创新发展的意见》,提出健全中医药服务体系、发挥中医药在维护和促进人民健康中的独特作用等六大意见。根据国务院新闻办发布的《中国的中医药》白皮书,至2020年,我国中医药大健康产业将突破3万亿,年均复合增长率将保持在20%,未来我国中药行业具有较大的潜在发展空间。建议投资者关注中药消费龙头片仔癀、云南白药、同仁堂。
11月8日国家药典委员会发布《关于中药配方颗粒品种试点统一标准的公示》,按照国家药品监督管理局统一部署要求,根据国家药品标准工作程序,组织相关企业开展中药配方颗粒品种试点统一标准研究,并组织专家开展标准审评工作。截至2019年5月底,受理了14家生产企业和1家研究机构提交的301个品种的研究资料共计437份。通过组织12次专家审评会审评,其中的160个品种形成了试点统一标准的拟公示标准。提供上述品种标准草案及研究资料的单位有:广东一方制药有限公司、江阴天江药业有限公司、四川新绿色药业科技发展有限公司、北京康仁堂药业有限公司、华润三九医药股份有限公司、培力(南宁)药业有限公司、神威药业集团有限公司、天士力医药集团股份有限公司和安徽九洲方圆制药有限公司。为确保标准的科学性、合理性和适用性,现就上述160个品种的试点统一标准公示征求社会各界意见,公示期为三个月。鼓励企业参照在国家药品监督管理局网站上公示的《中药配方颗粒质量控制与标准制定技术要求》文件开展从标准汤剂到生产工艺及中药配方颗粒产品的标准研究与复核。我们认为,相关文件的发布将促进行业标准的进一步提高,中药配方颗粒市场有望逐步放开,利好中药配方颗粒相关企业。建议关注中国中药、华润三九、红日药业、以岭药业、天士力。
2. 本周报告汇总

3. 一周行情更新
医药生物同比上涨1.29%,整体表现强于大盘。本周上证综指上涨0.2%,报2964.18点,中小板上涨1.47%,报6309.01点,创业板上涨1.44%,报1711.22点。医药生物同比上升1.49%,报8114.34点,表现强于上证1.29个pp,强于中小板0.03个pp,强于创业板0.06个pp。
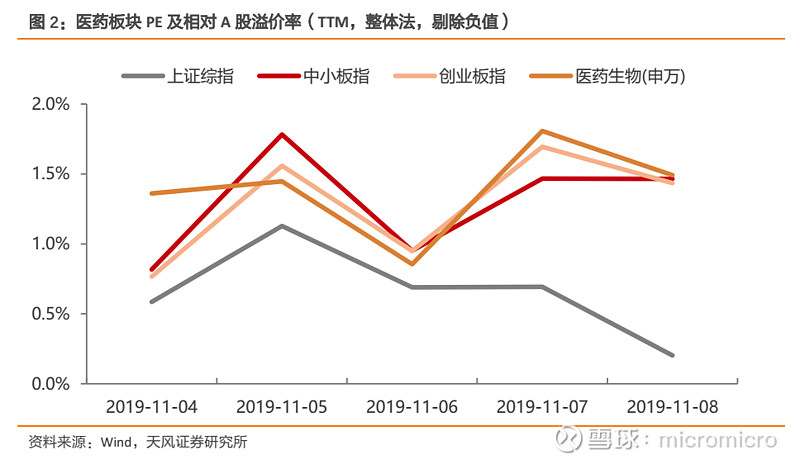
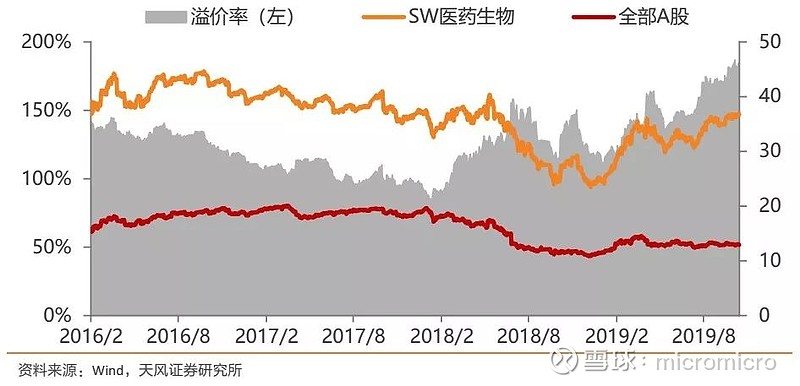
医药生物估值相对A股溢价上升。全部A股估值为12.93倍,医药生物估值为36.2倍,对全部A股溢价率为180.91%。各子行业分板块具体表现为:化学制药37.91倍,中药25.8倍,生物制品43.82倍,医药商业15.31倍,医疗器械46.16倍,医疗服务97.34倍。

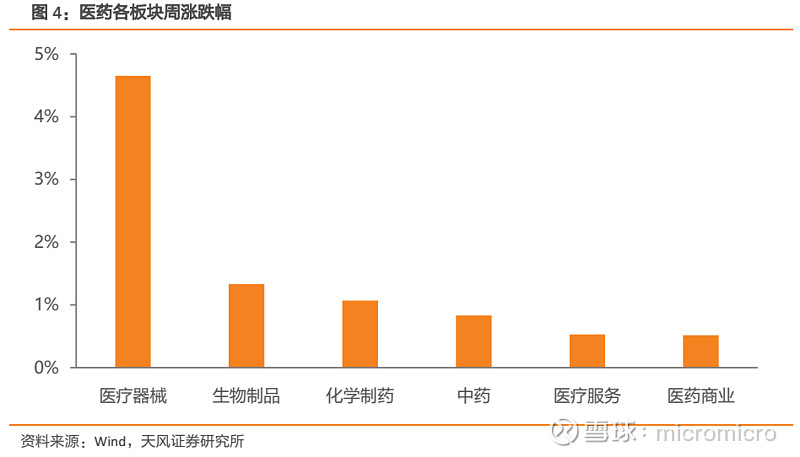
本周医药生物子板块均上涨,医疗器械板块涨幅最大达4.65%。本周医疗器械板块涨幅最大,上涨4.65%;生物制品板块上涨1.33%,化学制药板块上涨1.07%,中药板块上涨0.83%,医疗服务板块上涨0.53%;医药商业板块上涨幅度最小,上涨0.52%。
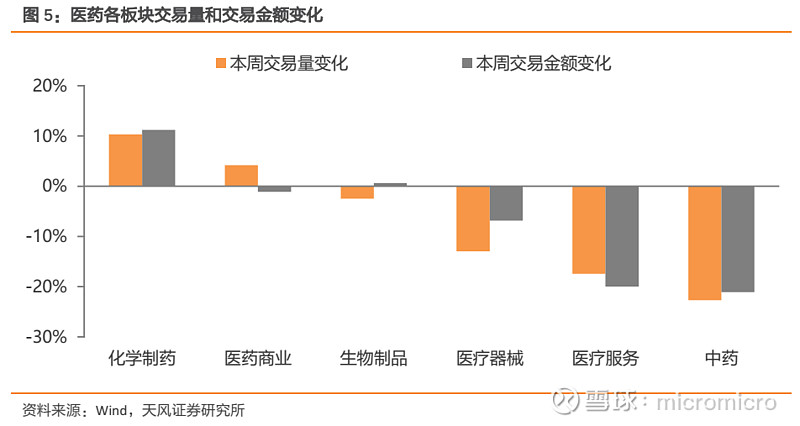
本周化学制药板块交易量和交易金额增幅较大。从交易量来看,本周化学制药板块交易量上升幅度最大,增幅为10.31%,中药板块交易量降幅最大,降幅为22.7%。从交易额来看,本周化学制药板块交易额上升幅度最大,增幅为11.20%,中药交易额降幅最大,降幅为21.10%。
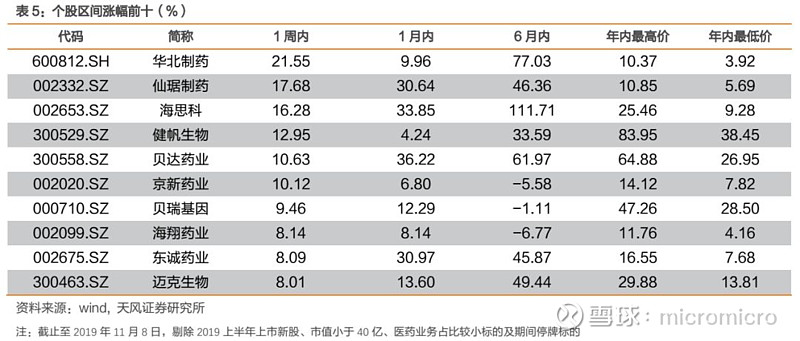
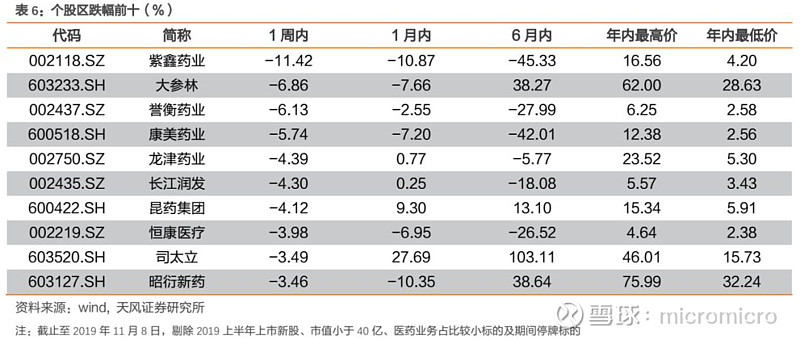
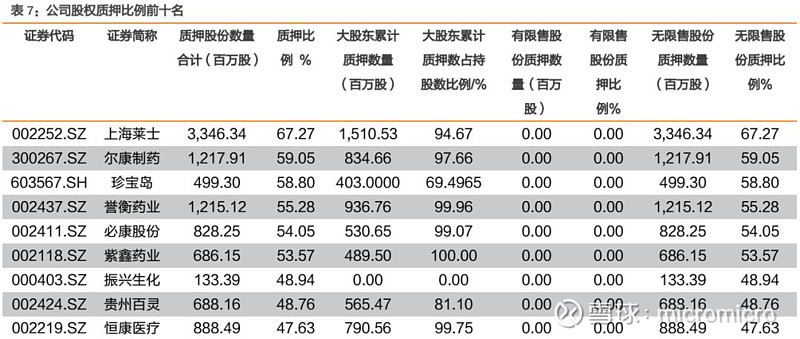

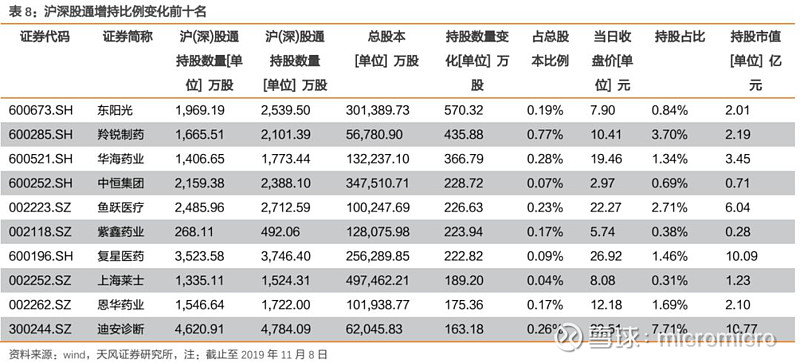
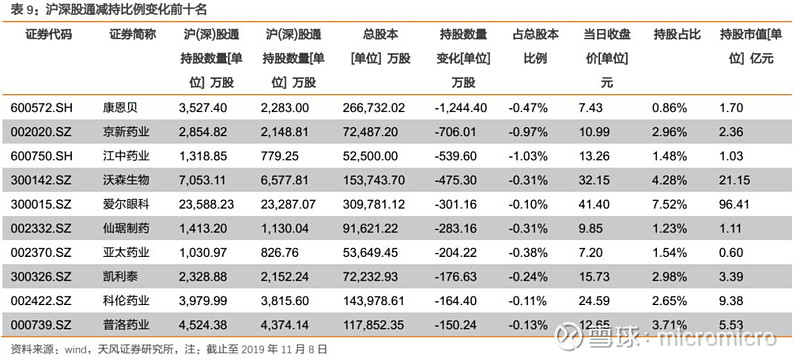
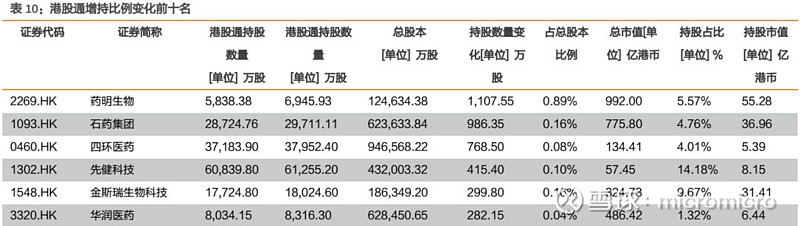

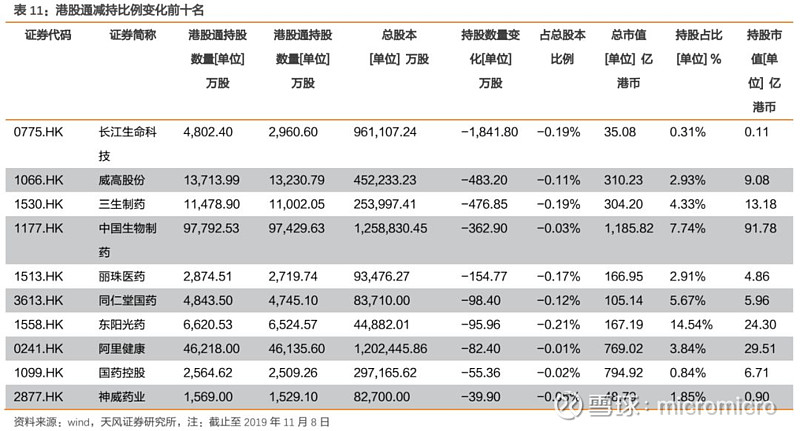
4. 本周月度组合公告汇总

5. 一周行业热点资讯
行业动态
【国家卫生健康委办公厅关于印发综合医院风湿免疫科建设与管理指南(试行)的通知】为促进综合医院风湿免疫科建设发展,提高风湿免疫疾病诊疗能力和规范化水平,国家卫生健康委组织制定了《综合医院风湿免疫科建设与管理指南(试行)》。要求具备条件的综合医院,加强对风湿免疫科的建设和管理,不断提高风湿免疫疾病诊疗水平。目前条件尚不能达到要求的综合医院,要加强对风湿免疫科的建设,增加人员,配置设备,改善条件,健全制度,严格管理,逐步建立规范化的风湿免疫科。(医政医管局)
【国家发改委等部门印发《区域医疗中心建设试点工作方案》】《方案》提出,将从北京、上海两地医疗资源富集地区,以及从武汉、长沙、广州、成都、西安5个优质医疗资源集中地方,选取30家试点输出医院,在患者流出多、医疗资源相对薄弱的云南、新疆、河北、山西、辽宁、安徽、福建、河南8个省区建设分中心、分支机构。(新浪医药新闻)。
【CDE再度发文加速临床急需药品上市销售】11月8日,国家药监局药品审评中心发布关于再次公开征求《临床急需药品附条件批准上市技术指导原则》意见的通知,较2017年12月原技术指南,该指导意见稿中明确适用范围为“未在中国境内上市销售,但临床急需的中药、化学药和生物制品。”(新浪医药新闻)
【关于举办化学药品仿制药一致性评价技术研讨班的通知】11月8日,为贯彻落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)、《关于仿制药质量和疗效一致性评价有关事项的公告》(2018年 第102号),推进仿制药一致性评价工作,中国药品监督管理研究会联合国家药品监督管理局药品审评中心,定于2019年11月26日至27日在北京举办“化学药品仿制药一致性评价技术研讨班”。(CDE)
【关于公开征求《药物临床试验登记与信息公示管理制度》和《研发期间安全性更新报告要求及管理规定》意见的通知】11月8日,为配合新《药品注册管理办法》中提出的申请人在药物临床试验登记与信息公示平台对获准开展的临床试验信息进行登记更新,以及提交研发期间安全性更新报告的要求。国家药监局药品审评中心组织起草了《药物临床试验登记与信息公示管理制度》和《研发期间安全性更新报告要求及管理规定》,对需更新和规定的要求进行了规范性说明。(CDE)
【关于公开征求《已上市中药药学变更研究技术指导原则》、《生物制品上市后药学变更研究技术指导原则》、《已上市化学药品药学变更研究技术指导原则》、《已上市药品临床变更技术指导原则》意见的通知】11月8日,为了指导和规范已上市中药、已上市生物制品、已上市化学药品药学、已上市药品临床变更研究和管理,国家药监局药品审评中心依据新版《药品管理法》,参考国内已有相关指导原则和国外先进药品监管机构的相关指导原则,结合国内研发与生产现状,起草了《已上市中药药学变更研究技术指导原则》、《生物制品上市后药学变更研究技术指导原则》、《已上市化学药品药学变更研究技术指导原则》、《已上市药品临床变更技术指导原则》(征求意见稿)。(CDE)
【关于《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见的通知】11月8日,为配合新修订《药品注册管理办法》的贯彻实施,国家药监局药品审评中心组织起草了《突破性治疗药物工作程序》和《优先审评审批工作程序》(CDE)
新药动态
【我国脑血管病治疗方案成为国际最高标准】11月4日消息,从国家神经系统临床医学研究中心获悉,囯家神经系统疾病临床医学研究中心王拥军教授首创的脑血管病治疗新方案,被全球权威的美国《急性缺血性脑血管病管理指南(2019更新版)》作为最高级别证据向全球推荐,成为该病治疗的国际最高标准,这也是我国脑血管病临床研究对全球脑血管防治做出的重大历史性贡献。(人民日报)
【齐鲁2款重磅仿制药获批:注射用白蛋白紫杉醇、他达拉非片!】11月6日,齐鲁制药两款重磅仿制药获批上市,分别是注射用紫杉醇(白蛋白结合型)和他达拉非片。由于均按照4类注册,获批后视同通过一致性评价,这样以来,这两款重磅品种在国内通过一致性评价的仿制企业均达到3家。(医药魔方)
【恒瑞医药拟不超11.6亿元引进德国两款干眼症药物】11月7日,恒瑞医药发布公告称,其与NovaliqGmbH公司达成协议,引进德国Novaliq公司用于治疗干眼症的药物CyclASol™(0.1%环孢素A制剂)和NOV03(全氟己基辛烷),恒瑞将获得这两个产品在中国的临床开发、生产和市场销售的独家权利。(公司公告)
生物技术
【卫材阿尔兹海默症新药BAN2401在中国获批临床】11月8日,国家药审中心(CDE)更新一批临床默示许可名单,其中卫材(中国)的阿尔兹海默症新药 BAN2401 获批临床,用于轻度阿尔茨海默病(AD)和阿尔茨海默病(AD)引起的轻度认知障碍(MCI)疾病的改善治疗。(丁香园 Insight 数据库)
【FDA发布医疗器械一级召回通知 涉飞利浦、雅培、美敦力】美国FDA近日发布了三项医疗器械I类召回通知,涉及产品分别来自雅培、飞利浦医疗和美敦力。I类召回无论在中国还是美国都是最严重的召回类型,其意味着使用这些医疗设备可能会导致严重的人身伤害甚至死亡。(新浪医药新闻)
点击最上方蓝字关注“思医辨药”
团队介绍
郑 薇:毕业于中国科学技术大学生物化学与分子专业,曾在中科院广州生物医药与健康研究院做过两年课题。毕业后在深圳迈瑞生物医疗电子股份有限公司(美股退市转A股)就职5年。曾在体外诊断事业部做产品研发2年多,后转至战略发展部任职产品市场经理。2015年离开迈瑞,在华泰证券研究所医药团队任高级研究员,负责医疗器械板块;2016年中加入天风证券,2017年入围新财富;2018年任天风证券医药首席分析师。
潘海洋:南开大学金融学硕士,天津大学生物工程学士。曾就职于华泰证券研究所,任医药生物行业研究员。目前任天风证券医药行业高级分析师,覆盖大药品领域:中药、生物药、部分化药等,善于从政策层面把握行业发展变化趋势,基本面研究扎实,把握公司拐点变化能力强。
李 扬:香港中文大学生物信息学硕士,华南理工大学生物工程学士,2017年11月加入天风证券,曾就职于华大基因,先后在研发部和产品部分别负责生物信息流程开发和遗传咨询工作,目前主要研究医疗器械板块,在基因检测、心血管器械、免疫细胞治疗领域研究较为深入。
李 沙:东北师范大学硕士/哈尔滨工业大学生物工程学士,曾于《Nucleic Acids Research》发表影响因子 IF 11.6 研究论文一篇;2017年7月毕业就职彧辉基金,主要从事大健康、消费、环保等领域投研工作; 2018年1月加入天风证券,目前主要负责医疗服务、医药商业板块研究,着力于药品流通与零售行业方向。
赵 楠:中国药科大学药学硕士,沈阳药科大学制药工程学士,南京大学管理学学士,通过CFA一级,2019年3月加入天风证券,曾就职于恒瑞医药,主要从事肿瘤创新药研发,导师为恒瑞全球研发负责人,目前主要研究创新药领域,身处医药行业多年对产业理解较为深入。
赵雅韵:西安交通大学化学硕士,制药工程学士,2019年7月加入天风证券。目前主要研究血制品板块。
杨烨辉:中山大学硕士,曾就职于江中药业研发部,默沙东市场销售部,招商证券、华泰证券研究所,2016年加盟天风证券。有超过8年的医药行业从业+投资研究工作经验,作为团队成员参评获得2011年新财富第三名,2012年新财富第四名,2013年新财富入围,2014年新财富第二名,2017年带队参评新财富入围。

文中报告节选自天风证券研究所已公开发布研究报告,具体报告内容及相关风险提示等详见完整版报告。
证券研究报告 《天风医药 - 坚守创新龙头,持续把握血制品等消费领域投资机会》
对外发布时间 2019年11月11日
报告发布机构 天风证券股份有限公司
本报告分析师 郑薇 SAC执业证书编号:S1110517110003
潘海洋 SAC执业证书编号:S1110517080006
研究报告法律声明
证券研究报告(以下统称“本报告”)署名分析师在此声明:我们具有中国证券业协会授予的证券投资咨询执业资格或相当的专业胜任能力,本报告所表述的所有观点均准确地反映了我们对标的证券和发行人的个人看法。我们所得报酬的任何部分不曾与,不与,也将不会与本报告中的具体投资建议或观点有直接或间接联系。
除非另有规定,本报告中的所有材料版权均属天风证券股份有限公司(已获中国证监会许可的证券投资咨询业务资格)及其附属机构(以下统称“天风证券”)。未经天风证券事先书面授权,不得以任何方式修改、发送或者复制本报告及其所包含的材料、内容。所有本报告中使用的商标、服务标识及标记均为天风证券的商标、服务标识及标记。
本报告是机密的,仅供我们的客户使用,天风证券不因收件人收到本报告而视其为天风证券的客户。本报告中的信息均来源于我们认为可靠的已公开资料,但天风证券对这些信息的准确性及完整性不作任何保证。本报告中的信息、意见等均仅供客户参考,不构成所述证券买卖的出价或征价邀请或要约。该等信息、意见并未考虑到获取本报告人员的具体投资目的、财务状况以及特定需求,在任何时候均不构成对任何人的个人推荐。客户应当对本报告中的信息和意见进行独立评估,并应同时考量各自的投资目的、财务状况和特定需求,必要时就法律、商业、财务、税收等方面咨询专家的意见。对依据或者使用本报告所造成的一切后果,天风证券及/或其关联人员均不承担任何法律责任。
本报告所载的意见、评估及预测仅为本报告出具日的观点和判断。该等意见、评估及预测无需通知即可随时更改。过往的表现亦不应作为日后表现的预示和担保。在不同时期,天风证券可能会发出与本报告所载意见、评估及预测不一致的研究报告。
天风证券的销售人员、交易人员以及其他专业人士可能会依据不同假设和标准、采用不同的分析方法而口头或书面发表与本报告意见及建议不一致的市场评论和/或交易观点。天风证券没有将此意见及建议向报告所有接收者进行更新的义务。天风证券的资产管理部门、自营部门以及其他投资业务部门可能独立做出与本报告中的意见或建议不一致的投资决策。
在法律许可的情况下,天风证券可能会持有本报告中提及公司所发行的证券并进行交易,也可能为这些公司提供或争取提供投资银行、财务顾问和金融产品等各种金融服务。因此,投资者应当考虑到天风证券及/或其相关人员可能存在影响本报告观点客观性的潜在利益冲突,投资者请勿将本报告视为投资或其他决定的唯一参考依据。
评级说明
股票投资评级:自报告日后的6个月内,预期股价相对于同期基准指数收益20%以上为“买入”、10%~20%为“增持”、-10%~10%为“持有”、-10%以下为“卖出”。
行业投资评级:自报告日后的6个月内,预期行业指数相对于同期基准指数,涨幅5%以上为“强于大市”、-5%~5%为“中性”、-5%以下为“弱于大市”。
免责声明
市场有风险,投资需谨慎。本平台所载内容和意见仅供参考,不构成对任何人的投资建议(专家、嘉宾或其他天风证券股份有限公司以外的人士的演讲、交流或会议纪要等仅代表其本人或其所在机构之观点),亦不构成任何保证,接收人不应单纯依靠本资料的信息而取代自身的独立判断,应自主做出投资决策并自行承担风险。根据《证券期货投资者适当性管理办法》,本平台内容仅供天风证券股份有限公司客户中的专业投资者使用,若您并非专业投资者,为保证服务质量、控制投资风险,请勿订阅或转载本平台中的信息,本资料难以设置访问权限,若给您造成不便,还请见谅。在任何情况下,作者及作者所在团队、天风证券股份有限公司不对任何人因使用本平台中的任何内容所引致的任何损失负任何责任。
本平台旨在沟通研究信息,交流研究经验,不是天风证券股份有限公司研究报告的发布平台,所发布观点不代表天风证券股份有限公司观点。任何完整的研究观点应以天风证券股份有限公司正式发布的报告为准。本平台所载内容仅反映作者于发出完整报告当日或发布本平台内容当日的判断,可随时更改且不予通告。