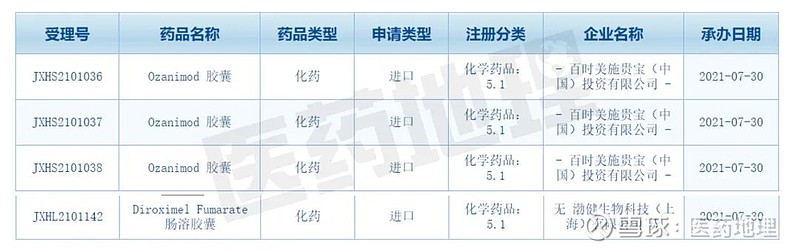
7月30日,CDE官网显示,百时美施贵宝5.1类新药ozanimod胶囊上市申请获受理。同一天获受理的还有渤健生物申报的Diroximel Fumarate肠溶胶囊IND申请。以上两款药物均为近2年发达市场刚获批上市的多发性硬化症新药。在罕用药审评审批及医保支付新政的共同作用下国内多发性硬化症治疗领域正快速接轨国际先进水平。
多发性硬化症(Multiple Sclerosis,MS)是一种严重的、终身性、进行性、致残性的中枢神经系统疾病,属于国家卫健委《第一批罕见病目录》即收录的疾病。据报道,全球MS患者大约有230万,其中仅美国就有50多万患者。我国属于MS低发病区,全国估计约有患者3万名。
虽然MS属于罕见病,但在全球范围内却坐拥超过200亿美元的庞大市场。MS治疗药物一直处于神经系统品类角逐的前沿,自2010年以来获批上市新药达到9款。反观国内,在2018年以前,除了传统的干扰素和激素疗法外,我国MS患者几无选择,导致规范治疗率低,疾病预后差。
随着国家层面对罕见病防治工作的重视和实质性的推动,国内MS治疗药物发展迎来转折。2018年5月,国家公布《第一批罕见病目录》,多发性硬化、戈谢病等121种罕见病被纳入其中。罕见病药物加速审批以及医保支付等激励新政得以落实,中国市场MS治疗药物研发上市进入“快车道”。
数据显示,自2018年7月以来,已有5款MS新药获批上市(表1),并且其中3款已通过医保谈判途径纳入医保目录。今年获批的2款新药富马酸二甲酯和氨吡啶,根据国家医疗保障局最新公布的国家医保药品目录调整申报药品名单,也已通过了2021年医保药品目录调整的形式审查,有望被调入下一年度的医保目录中。
表1 近年NMPA批准上市MS治疗药物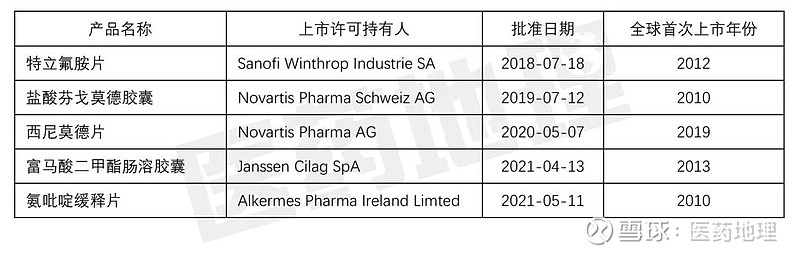
数据来源:CPM新药研发监测数据库
与此同时,在研管线也在快速膨胀(表2)。数据显示,当前总计14款国内MS在研药物中,超过半数为2020年以后新增(注:补充适应症药品按申报新适应症时间计算,未计仿制药)。特别是进入下半年以来,先后有3款进口原研MS治疗药申报NDA,鉴于类似情形的Alkermes公司氨吡啶缓释片NDA申请在4个月内即审评完毕获得许可,或许我们可以大胆预测一下国内MS市场年内或将迎来第三甚至第四款新药。
除了引进原研药品的火热,国内多家药企也加入了赛道的争夺。例如,鉴于MS在欧美地区高加索人种中高发的特点,山西振东制药采用中美双报策略,2019年7月率先向美国FDA递交了MS创新药ZD03的IND申请,尔后顺利获批临床,翌年ZD03在国内的临床申请也获得批准。据振东制药披露,ZD03是一种来源于中药线叶旋覆花的全新药物,与MS一线用药富马酸二甲酯具有相同的作用靶点,但选择性更高,起效剂量更低。又如,2020年底,荣昌生物制药在研1类新药重组人B淋巴细胞刺激因子受体-抗体融合蛋白(商品名:泰爱)启动了用于MS的Ⅱ期临床试验。2021年1月,北京诺诚健华提交BTK抑制剂奥布替尼用于MS的新适应症申请。让我们期待国内创新药企能在MS以及其他罕用药研发领域中有所收获,为罕见病诊疗水平的提高贡献出自己的一份力量。
表2 中国在研MS治疗药物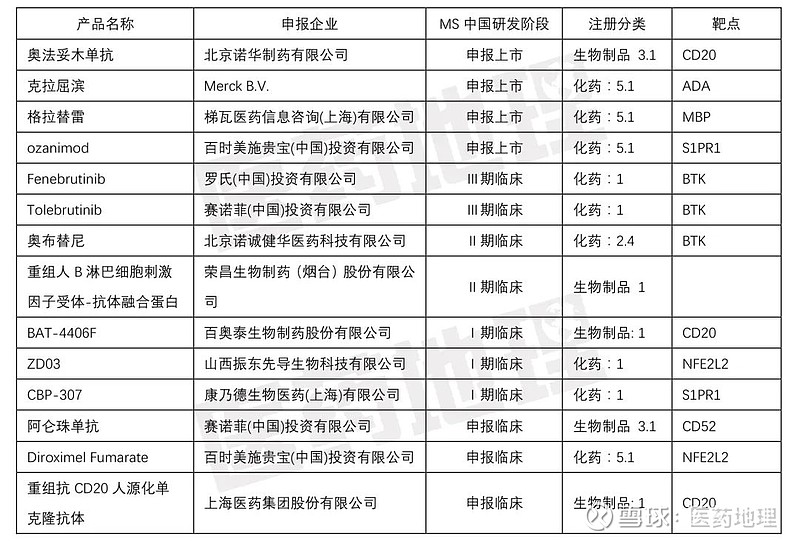
数据来源:CPM新药研发监测数据库

—END—