2021年3月19日 $康乃德生物(CNTB)$ 正式在纳斯达克挂牌上市(NASDAQ:CNTB),发行价17美元,募资1.91亿美元,虽然IPO首日开门红,但上市第4天便跌破发行价,直到最近3个月,股价才有所回暖。对于还未迎来产品收获期的初创生物药公司而言,投资逻辑相对比较明确,一是看研发管线有无拳头产品,二是核心团队给不给力,此外还要看有没有强有力的投资方和合作方。昆仑点评将从以上三个方面为您解读康乃德生物。
“小而美”的产品管线
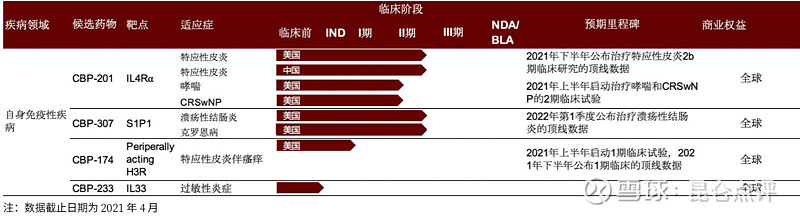
根据公司官网,康乃德生物目前搭建了四条产品管线,均处于临床阶段,分别为靶向IL-4R抗体药物CBP-201、小分子S1P1抑制剂CBP-307、外周限制性H3R拮抗剂CBP-174和靶向IL-33抗体CBP-233。其中,CBP-201与CBP-307为核心的候选药物,相关临床II期试验已在美国和中国开展,分别计划于2021Q4和2022Q1公布临床试验有效性和安全性的顶线数据。
康乃德生物研发管线
CBP-201有望成为度普利尤单抗的潜力竞品
CBP-201为康乃德自主研发的IL-4R抗体(全人源IgG4型单抗)创新药,目前在研适应症包括特应性皮炎(AD)、哮喘、慢性鼻窦炎伴鼻息肉(CRSwNP),均进展至临床II期。
IL-4R抗体被认为是治疗Th2相关炎症性疾病(非特异性皮炎、哮喘、慢性鼻窦炎等)的颠覆性药物,目前上市的IL-4R抗体仅有赛诺菲与再生元合作研发的度普利尤单抗(达必妥)。
度普利尤单抗上市后销售额一路上涨,首年实现销售额2.47亿美元,2018年8.73亿美元,2019年即达到23亿美元,2020年更达40亿美元,已然进入了重磅药物之列。在中国,度普利尤单抗上市5个月便被纳入医保目录。其优异的市场表现证明了IL-4R抗体药物前景广阔,同时也吸引更多的竞争者进军此领域。
IL-4R抗体全球赛道包括度普利尤单抗在内共有8款药物处于临床阶段,6款来自中国企业。
临床阶段国内自主研发的IL-4R抗体药物
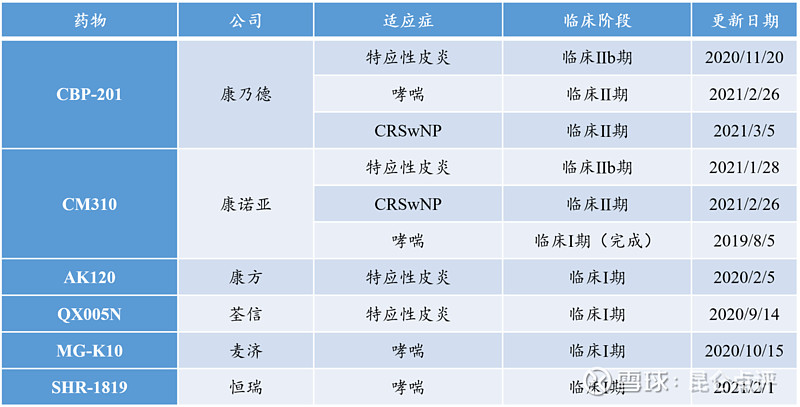
中国IL-4R抗体赛道中,CBP-201研发进度目前领先,康诺亚的CM310紧随其后。分析康乃德与康诺亚已披露的IL-4Rα单抗部分临床数据,与度普利尤单抗进行对比,结果见下表。
CBP-201、CM310与度普利尤单抗对AD患者的安全性与疗效对比
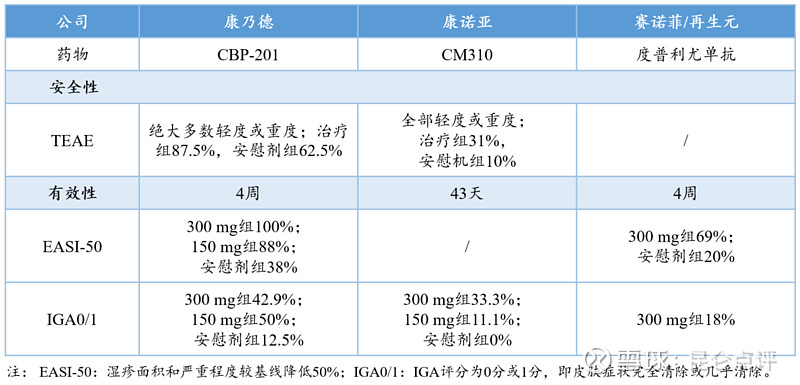
通过上表的对比数据可以看出,安全性上康诺亚CM310治疗期间出现不良事件的比率更低,有效性上CBP-201起效更快、临床反应更明显,并且CBP-201给药间隔打算设为每4周给药一次(度普利尤单抗为每2周给药一次)。
尽管CBP-201在特应性皮炎适应症治疗上体现出了对度普利尤单抗的相对优势,但度普利尤单抗AD药物“王者”地位怕是很难撼动,除非CBP-201未来进行头碰头临床III期试验来确证其优效性。然而,就目前公开信息,CBP-201暂无头碰头临床试验设计计划。
CBP-307治疗前景有待验证
CBP-307是康乃德自主研发的一种第二代口服小分子S1P1受体激动剂药物,目前在开发的适应症包括溃疡性结肠炎(UC)和克罗恩氏病(CD),均进展至临床II期。不过,受到疫情影响,中重度CD的二期临床试验提前结束,只有22名患者完成了12周的给药。康乃德计划启动另一项CBP-307治疗CD的临床II期试验。
溃疡性结肠炎和克罗恩病是炎症性肠病(IBD)的两种形式,以受感染的肠道部位作为区分。克罗恩病在各段消化道的任何部位均可能发生,而溃疡性结肠炎的特征是结肠和直肠内壁的炎症和溃疡。溃疡性结肠炎和克罗恩氏病都属于慢性病,目前尚无治愈的有效方法,患者需终身治疗,临床需求安全性良好并且可长期用于缓解治疗的药物。
S1P1为G蛋白偶联受体家族中成员之一,在肠黏膜内皮细胞及肠系淋巴循环中有着广泛的表达。S1P1受体调节剂能够有效降低外周循环中的T淋巴细胞浓度,从而降低过激的免疫反应对组织造成的伤害。并且,S1P1受体与内皮细胞的保护密切相关,抑制炎性部位的淋巴细胞浸润并抑制结肠黏膜Th-1细胞因子的产生。因此S1P1受体调节剂可能成为治疗IBD的潜在药物。
据不完全统计,S1P1靶点药物全球上市4个,临床Ⅲ期2个,临床Ⅱ期7个,临床Ⅰ期11个,适应症涉及复发性多发性硬化症(RMS)、溃疡性结肠炎(UC)及银屑病等。上市药物获批适应症主要集中在RMS。
S1P1靶点全球上市药物
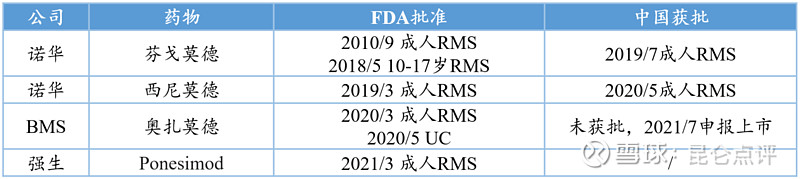
针对溃疡性结肠炎(UC)仅有百时美施贵宝的奥扎莫德获批。奥扎莫德于2020年5月获得FDA批准,成为首个获批治疗溃疡性结肠炎的S1P1调节剂,并且已于7月30日在华申报上市,表明S1P1调节剂对于溃疡性结肠炎的靶点成药性已获得充分验证。
S1P1靶点药物中,除奥扎莫德和CBP-307外,国内Arena与云顶新耀合作的Etrasimod也在开发溃疡性结肠炎适应症,目前已进展至临床III期,进度在CBP-307之前。三者对于UC患者的临床安全性和有效性对比情况见下表。
CBP-307、Etrasimod与奥扎莫德对UC患者的安全性与疗效对比
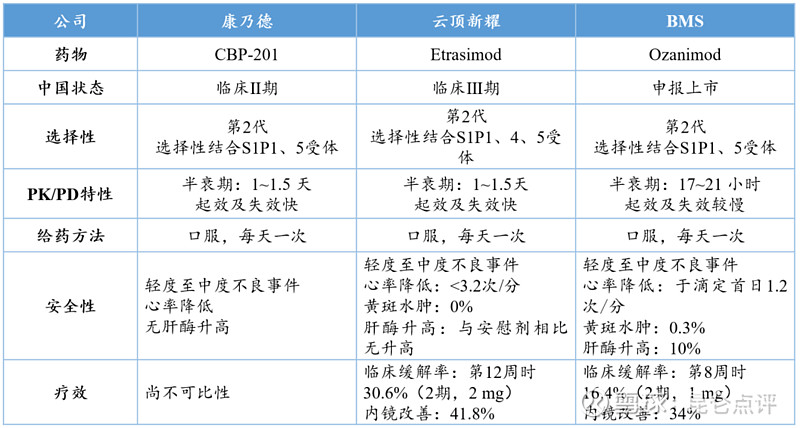
药动/药效学特性方面,CBP-201与Etrasimod半衰期相当,均有起效快失效快的特点,较Ozanimod有一定优势;安全性方面,CBP-201在临床Ⅰ期试验中显示耐受性良好,副作用为轻度或中度,同Etrasimod和Ozanimod一样均呈现剂量依赖性心率降低,此外,CBP-307未引起肝酶水平升高。
CBP-201对195名中重度UC患者12周治疗的全球临床II期试验已启动,期待2022年第一季度能看到CBP-201的积极临床结果。
“专而精”的管理团队
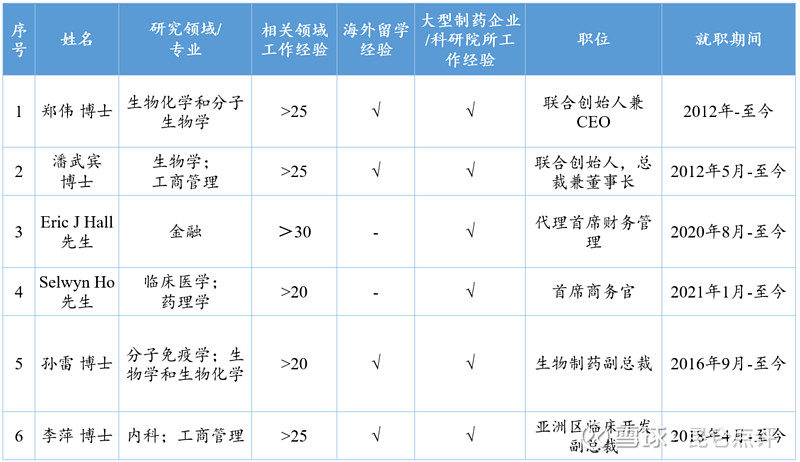
从工作经验和工作履历来看,康乃德核心管理团队具有长达20余年的丰富的研发及管理经验,在自免药物系统方面造诣颇深,且所有管理层成员均具有大型制药企业及其子公司的工作经验。
联合创始人兼首席执行官郑伟博士在发现自身免疫性疾病和炎症的创新疗法方面拥有超过25年的经验。先后担任美国Arena药业公司免疫学总监、美国ChemoCentryx药业公司首席科学家与生物部副总监。由他发现并主持开发的两个试验新药已在十九个国家总共超过两千个病人中进行大规模临床试验。
另一位联合创始人兼总裁和董事长潘武宾博士则拥有超过25年的运营、管理和筹资经验。潘博士是一位连续创业者,2000年归国加盟“(深圳)清华源兴生物医药有限公司”并出任副总裁,期间先后创办了若干相关生物医药企业并任执行副总裁、总经理或董事,分别组织和参与基因治疗、基因疫苗、肿瘤疫苗等药物及纳米、人体组织工程医疗产品研发等工作。2006年,潘博士以联合创始人的身份参与创建了中美冠科生物技术有限公司,与全球最大的制药公司辉瑞在太仓共同设立了亚洲肿瘤研究中心,并先后任中国区总裁、中美冠科COO和执行副总裁。
康乃德高级管理团队主要成员
VC/PE阵容强大,启明、北极光多次加码
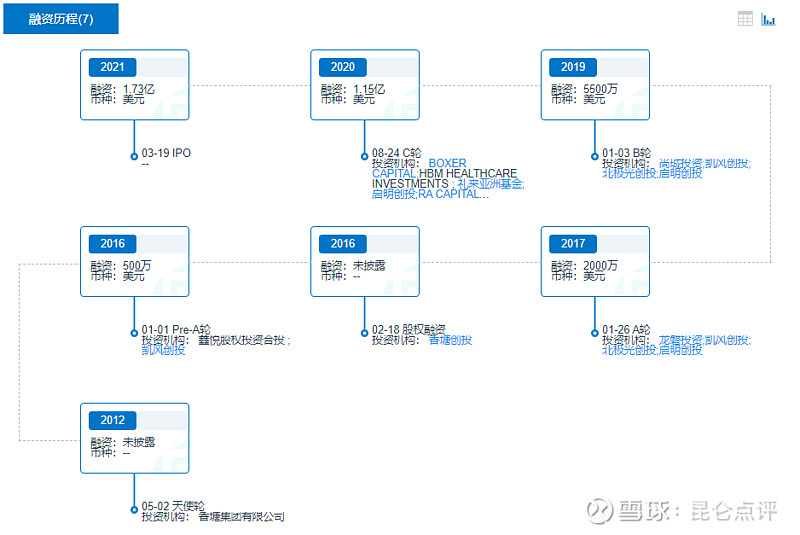
自成立伊始,康乃德就备受资本青睐。据不完全统计,康乃德IPO前累计完成6轮融资,背后集结了启明创投、北极光创投、礼来亚洲基金、尚珹投资、凯风创投等多家VC/PE机构的身影。其中,启明创投在A、B、C三轮融资中投资康乃德,而北极光创投连续参与康乃德A轮、B轮融资。
IPO后,上海旻荟企业管理咨询合伙企业(有限合伙)持股9.8%,启明创投持股9.0%,尚珹资本持股8.8%,RA Capital Management持股6.8%;康乃德生物联合创始人兼董事长、总裁潘武宾持股15.8%,联合创始人兼CEO郑伟持股11.0%。
康乃德生物融资历程
相信之所以能3年时间内完成在资本市场的“三级跳”,资本看重的不仅是当前新药研发的良好大环境,还有康乃德的核心产品研发以及其所在的自身免疫疾病治疗市场的前景。而康乃德能否由专变强,且看CBP-201与CBP-307两款核心产品的临床III期表现。