
综述
双特异性抗体 (bsAbs) 通过识别和靶向两种不同抗原表现出独特的治疗潜力。复杂的分析设计通常会带来更多的双抗副产物杂质,如错误配对的产品,片段和更高水平的聚集等,这使得下游纯化更为复杂和具有挑战性。本文对bsAbs的关键结构和副产物纯化方法进行了详细综述 (每个案例都有对应的引用文献,点击文末链接可以溯源)。
双抗的主要结构
双抗不仅限于2价 (1+1),可以根据不同的结构设计实现多价双抗的构建 (如1+2和2+2),其结构可以主要分为图 1所示的三类:
不对称型bsAb:不对称bsAb通常具有来自两种不同单抗的重链 (HC) 和轻链 (LC),其中部分或全部LC/HC也可能设计成两臂相同的状态,这样可以最大程度避免错配。
对称型bsAb:对称型bsAb也有Fc片段,两边的结构域序列对称,通过附在抗体上的抗原识别结构 (scFvs) 来提供多特异性。
基于片段的bsAb:基于片段的bsAb由可变区通过不同的连接方式组成,如图中的BiTE结构 (scFv除了本身VL和VH间的连接,一条scFv的VH还与另一条scFv的VL连接) 和Diabody结构 (两条scFv自身VL和VH间没有连接,而分别与对方的VH和VL连接)。
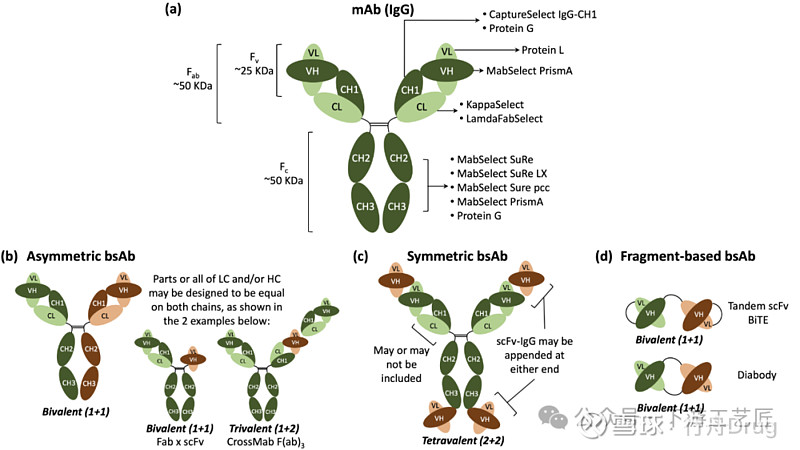
图1. (a) 免疫球蛋白G (IgG)单克隆抗体(mAb) 的示意图,由两条重链 (HCs, 深绿色)和两条轻链组成 (LCs, 浅绿色)。HC由VH,CH1, 铰链区, CH2和CH3结构域组成;轻链由VL和CL结构域组成。VL, VH,CL和CH1结构域构成抗原结合片段(Fab),CH2和CH3结构域构成结晶片段(Fc),VH和VL结构域构成可变区(Fv),主要亲和填料的配体结合位点以箭头标示;(b-d) 代表性bsAb结构的示意图,即不对称(b), 对称 (c) 和基于片段的bsAb
双抗的主要副产物
双抗复杂的设计会随之产生各种类型的副产物,无疑增大了下游纯化的挑战:
错配:由于在细胞培养中存在多种HC和LC的共表达,双抗很容易产生HC和LC的错配,进而产生大量大小和性质相似的非功能性或单特异性抗体 (若完全随机配对,错配产品占比会超过90%)。图2浅蓝色虚线框内为HC错配副产物,浅红色虚线框内为LC错配副产物。降低错配的一种方法是通过分子设计提高目标双抗的形成概率,如广泛应用的knob-into-hole (KiH) 设计。
片段:缺失HC或LC的双抗片段是常见的副产物,如图2浅绿色虚线框内的1/2 bsAb (缺少1条HC和1条LC) 和3/4 bsAb (缺少1条LC)。
聚体:图2浅紫色虚线框内为双抗的各种聚体类型。研究报道基于片段的bsAb中Fc区的缺失使其比原始IgG更容易聚集,对称bsAb也被证明具有显著的聚集倾向 (高达50%的聚体)。这可以部分归因于由于链长度和灵活性增加而导致更容易发生分子间结构域的交换。
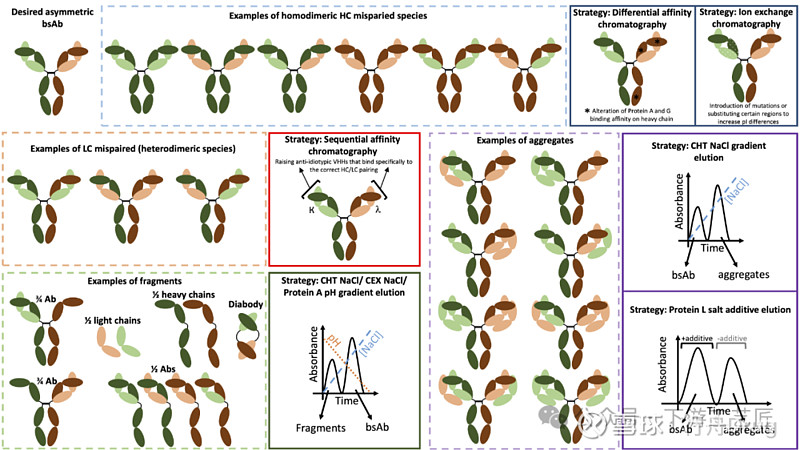
图 2. 代表性不对称双抗的杂质类型:HC错配 (浅蓝色虚线框),LC错配 (浅红色虚线框),片段 (浅绿色虚线框) 和聚体 (浅紫色虚线框),以及相应的去除策略 (相应相同颜色的实现框)。没有在此展示的有:(1) 对于Fab x scFv双抗,有研究表明不同的KappaSelect和基于CH1的亲和层析是有用的; (2) 有研究表明阳离子交换层析在接近scFv-IgG双抗pI的碱性pH值时,可以将diabody-IgG错配产物与目标scFv-IgG双抗分离; (3) 有研究使用疏水和混合模式层析将某些同源二聚体错配产物与目标双抗分离 (此处列出的示例并不详尽)
基于亲和作用的纯化方法
1. 蛋白A和蛋白G亲和层析
蛋白A和蛋白G亲和层析是抗体纯化中使用最多的捕获方法,在bsAb的纯化中同样承担捕获和除杂功能。典型的亲和层析在pH7.0-7.4条件平衡后上样,在用平衡缓冲液淋洗后,用醋酸、柠檬酸或甘氨酸缓冲液在pH
去除错配产品:差异化蛋白A层析是去除同型二聚体HC错配产物的有效方法,这需要在构建bsAb时对其中一条HC进行修饰改造,以改变其与蛋白A间的亲和力。例如一条HC1来自大鼠抗体 (不与蛋白A结合),另一条HC2来自小鼠抗体 (与蛋白A有高亲和力),这样产生的同型二聚体HC1HC1和HC2HC2与蛋白A的亲和力极弱或极强,容易与目标HC1HC2双抗分离。
去除片段:半抗是bsAb纯化中常见的杂质,一半结构在亲和填料上的结合通常弱于完整bsAb,容易在pH梯度洗脱中提前出峰。研究发现在洗脱buffer中添加500mM NaCl或300mM CaCl2能显著提高半抗分离的分辨率。
去除聚体:一般认为亲和层析去除聚体比较困难,但是也有文献报道使用Protein L时在洗脱缓冲液中添加ArgHCl可以有效去除聚体。
亲和配体的利用:图 1所示不同亲和填料与抗体的作用位点不同,可以针对特定的bsAb设计选择相应的亲和填料,实现目标产品的高效捕获。如Protein L亲和层析可以特异性与Kappa轻链的可变区VL结合,可以用于含VL片段的捕获和去除。
2. 固定化金属亲和层析
一些没有特定亲和配基可以相互作用的bsAb片段可以考虑使用固定化金属亲和层析 (IMAC)。IMAC通常通过固定化金属离子 (镍、锌、钴离子) 与含有多个组氨酸标签的蛋白结合,然后通过超过500mM咪唑进行洗脱,并且可以在淋洗缓冲液中加入低浓度咪唑降低非特异性吸附。
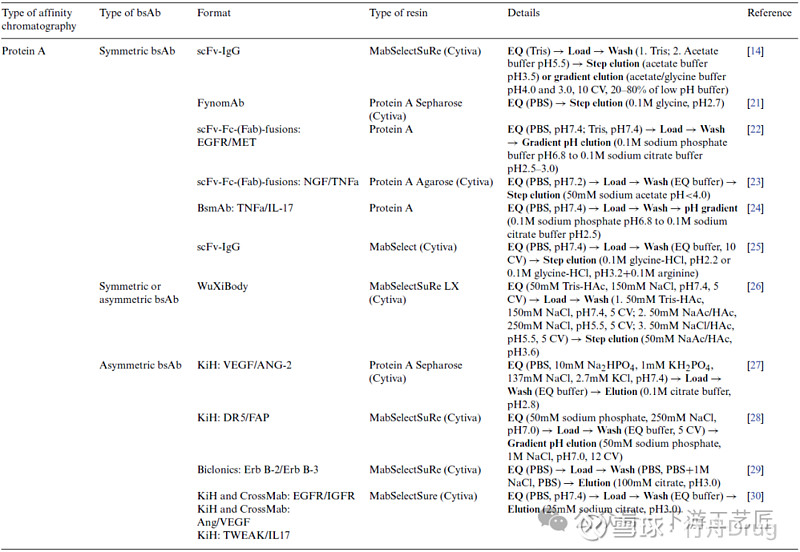
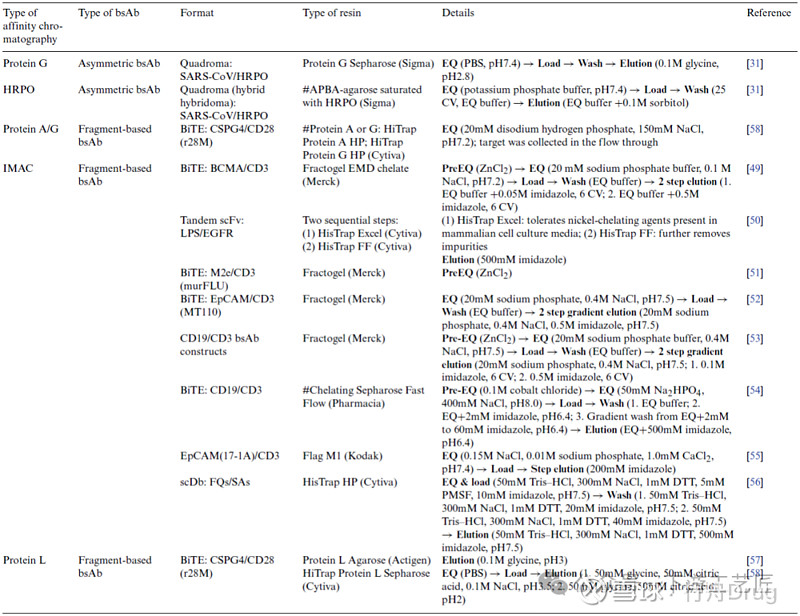
表 1. bsAb纯化方法之亲和层析,除了用#标记的组使用亲和层析作为精纯步骤,其他组都用亲和层析作为捕获步骤
基于电荷的纯化方法
基于电荷的离子交换层析在双抗应用较多作为精纯步骤,也有较少作为第一步的捕获步骤。根据目标bsAb和相关副产物的等电点pI差异选择操作pH是离子交换层析的关键步骤。表2总结了离子层析在bsAb纯化中除杂的应用:
去除错配产品:WuXiBody的独特设计是工程化T细胞受体 (TCR) 恒定区取代一个亲本mAb的CH1/CL区域,TCR区的pI较低,因此不含TCR区的错配同型二聚体副产物pI更高,容易通过离子层析实现去除。去除片段:同样利用pI的差异可以去除bsAb片段,如有报道在阳离子层析中通过含有PEG固定相的线性pH梯度洗脱去除3/4抗体片段。
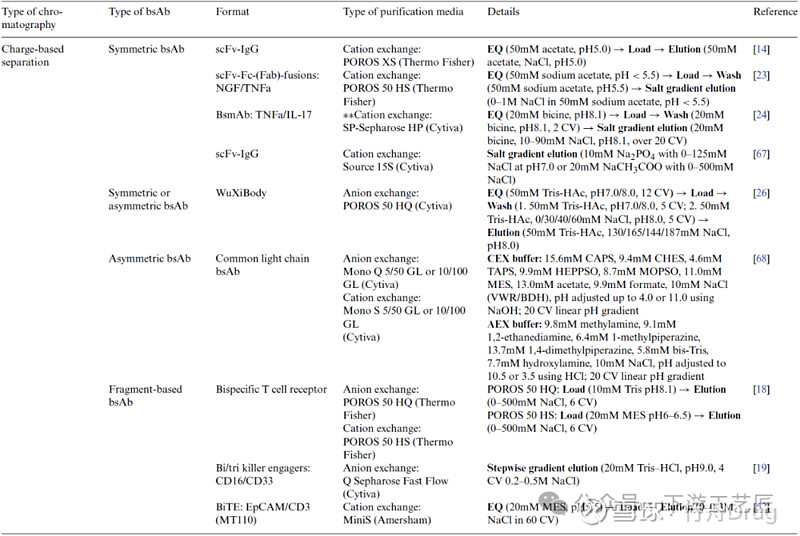
表 2. bsAb纯化方法之基于电荷的分离方法
基于尺寸的纯化方法
尺寸排阻层析 (SEC):尽管SEC存在实验室规模到生产规模的放大限制,但仍被广泛应用于精纯步骤。以PBS体系为流动相,SEC分离的保留时间和分辨率与bsAb和副产物间分子量和水合动力学半径的差异直接相关。
切向流过滤 (TFF):TFF也是基于分子尺寸的分离方式,有研究使用截留分子量300 kDa的Pellicon XL有效去除bsAb聚体。需要注意的是,使用TFF会造成终产品体积变大,较大膜面积,较大换液缓冲液体积和较长工艺时间等缺陷。
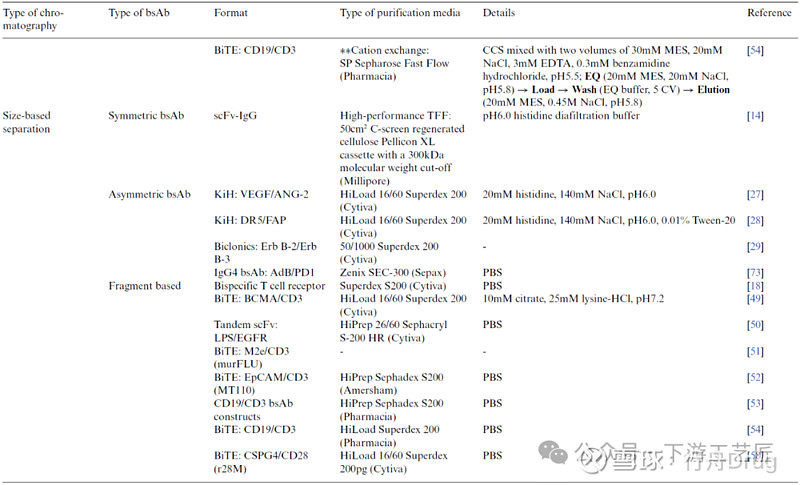
表 3. bsAb纯化方法之基于尺寸的分离方法
基于疏水的纯化方法
疏水层析 (HIC) 基于目标产品和杂质之间的疏水性差异进行分离,在高浓度亲液盐作用下bsAb暴露表面非极性残基,随即与填料上的疏水残基结合。随着盐浓度的逐渐降低,使得不同疏水性强度的目标产品和杂质实现分离。
有趣的是,某些bsAb在HIC上表现出多峰洗脱行为,较长的暂停时间会富集后期洗脱峰,较长的保留时间和较高的操作温度会降低洗脱峰的分辨率,这表明构象变化发生的时间尺度与色谱分离的时间尺度相当。另外,盐浓度过高可能导致蛋白与填料的不可逆结合,此时可以在流动相中添加5%乙二醇和1M精氨酸来促进bsAb的洗脱。

表 4. bsAb纯化方法之基于疏水性的分离方法
基于混合模式的纯化方法
混合模式层析利用超过一种相互作用原理提供更有效的分离能力,如CHT (bsAb的表面氨基与CHT带负电荷的磷酸基团相互作用,bsAb的表面羧基与CHT的钙离子有螯合作用),Toyopearl MX-Trp 650M,Capto adhere和Capto MMC等。
去除错配产品和片段:Toyopearl MX-Trp 650M混合模式层析可以分离出同时含有κ和λ轻链的bsAb,而只含有κ轻链或λ轻链的同源二聚体可以被去除。Capto adhere, Capto MMC和CHT等也有类似的效果,其中CHT在双抗纯化中的应用非常广泛,其复杂的配基设计总会提供意向不到的分离效果。去除聚体:有案例在亲和纯化后样品中含有~17%的5/4抗体,CHT纯化时bsAb在更低的盐浓度洗脱下来,而5/4抗体在更高盐浓度洗脱。
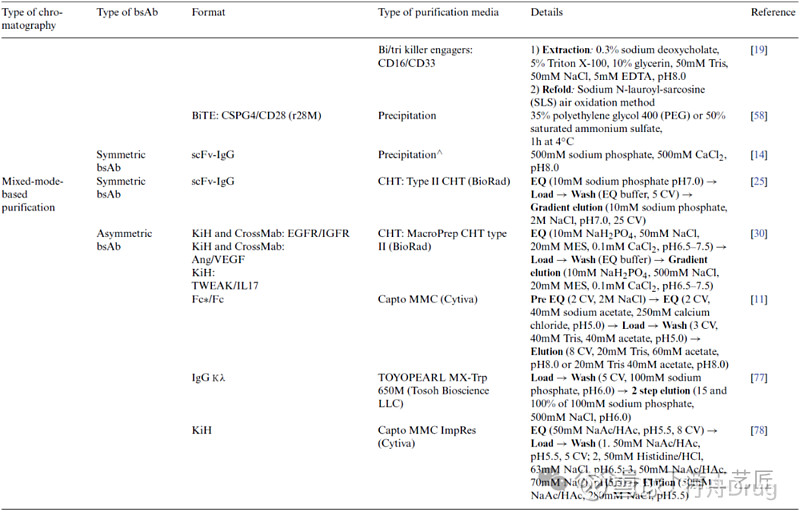
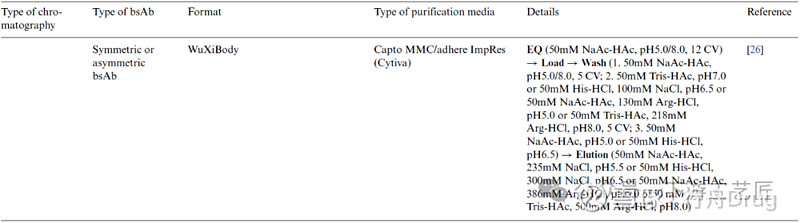
表 5. bsAb纯化方法之基于混合模式的分离方法


原文链接:Current trends and challenges in the downstream purification of bispecific antibodies.pdf